柴胡桂枝汤加减通过调节Wnt/β-catenin 信号通路对骨质疏松大鼠的改善作用及机制研究
2023-12-04郭中华史栋梁曹玉举王云飞杨少祥秦合伟张仲博任博文周松林王俊杰王莉莎万小冠
郭中华,史栋梁,曹玉举,王云飞,杨少祥,秦合伟,张仲博,任博文,周松林,王俊杰,王莉莎,万小冠
(1.河南省中医院骨病一科,郑州 450053;2.郑州中医骨伤病医院骨科,郑州 450016;3.河南省中医院康复科,郑州 450053;4.河南省中医院疼痛科,郑州 450053;5.郑州市第九人民医院骨科,郑州 450053)
骨质疏松症(osteoporosis,OP)是一种全身性多因素骨骼疾病,其特征是骨量减少、骨微结构破坏和骨脆性增加[1-2]。 随着人口老龄化程度的扩大,OP 的患病率不断上升,已成为许多国家的重要公共卫生问题[3-4]。 目前,OP 的治疗主要采用药物疗法、物理疗法和运动疗法。 尽管OP 的治疗取得了很大进展,但治疗效果仍不能达到临床预期,如许多新开发的抗OP 药物价格昂贵,限制了其广泛的临床应用,药物不良反应最终影响患者服药依从性等[5]。 因此开发新的治疗OP 的药物变得非常重要。 柴胡桂枝汤出自张仲景《伤寒论》,已有研究显示其在临床上治疗类风湿关节炎方面疗效显著[6]。但关于柴胡桂枝汤能否改善OP 尚不清楚。 最近的研究显示,激活Wnt/β-连环蛋白(β-catenin)信号通路可延缓OP 的发生和发展[7]。 而柴胡桂枝汤能否通过调节Wnt/β-catenin 信号通路改善OP 尚不明确。 因此,本研究严格参考临床相关研究[8]在柴胡桂枝汤原方的基础上通过加减一些药物合为柴胡桂枝汤加减(Chaihu Guizhi Decoction,CGD),观察CGD 对OP 大鼠的影响并探究相应的作用机制。
1 材料和方法
1.1 实验动物
84 只SPF 级雌性SD 大鼠(7 周龄,体重200 ~210 g)购于广东南模生物公司[SCXK(粤)2022-0062],饲养于河南省中医院SPF 级实验室[SYXK(豫)2021-0018]。 本研究遵循3R 原则,且所有动物实验都已获得河南省中医院动物伦理委员会的审核及批准(HNSZYY2022010012)。
1.2 主要试剂与仪器
CGD 由黄芩10 g、葛根30 g、党参10 g、桂枝15 g、柴胡24 g、生姜10 g、白芍15 g、清半夏12 g、炙甘草10 g、焦神曲10 g、白术20 g、大枣10 g 组成,购于河南省中医院中药房。 加入5 倍药材质量的水浸泡药材2 h,大火烧开后转文火煮1 h,经过滤得煎液,重新加水再煎煮第2 次。 将两次所得的煎煮液混合并加热浓缩至5 g/mL。
维甲酸(规格50 mg,批号:20211128)购自深圳振强生物公司;戊酸雌二醇(estradiol valerate,EV)(批号:20220213)购自北京凯诗源生物公司;Wnt/β-catenin 通路抑制剂DKK-1(批号:20211218)购自上海禾午生物公司;大鼠Ⅰ型胶原C 端肽(Ctelopeptide of type Ⅰ collagen,CTX-Ⅰ)、骨 钙 素(osteocalcin,BGP)ELISA 试剂盒(批号:20211123、20220706)购自上海钰博生物公司;碱性磷酸酶(alkaline phosphatase,ALP)钙-钴染色试剂盒、抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)染色试剂盒(批号:20220704、20220619)购自上海歌凡生物公司;兔源一抗Wnt3a、β-catenin、GAPDH 和二抗(批号:ab219412、ab32572、ab8245、ab97051)均购自英国Abcam 公司。 SktScan 1176 micro-CT 仪购自德国Bruker 公司;BX53 光学显微镜购自日本奥林巴斯;DYY-7C 型蛋白电泳仪购于北京六一仪器厂。
1.3 实验方法
1.3.1 分组及OP 模型的构建
将84 只SD 大鼠随机分为Model 组、CK 组、高剂量CGD 组(CGD-H 组)、低剂量CGD 组(CGD-L组)、戊酸雌二醇组(EV 组)、Wnt/β-catenin 通路抑制剂(DKK-1)组和CGD-H+DKK-1 组,每组12 只。除CK 组外,其他组大鼠均通过灌胃70 mg/kg 维甲酸的方式(每天1 次,持续4 周)构建OP 大鼠模型[9]。 CK 组大鼠在相同时间段内灌胃等量的生理盐水。 通过观察股骨微观结构以及股骨病理损伤来判断造模是否成功。 造模成功后,根据参考文献及前期预实验结果进行给药处理,CGD-L 组、CGDH 组、EV 组[10]大鼠分别需灌胃5 g/kg CGD、20 g/kg CGD、9 mg/kg EV,且均需腹腔注射等量的生理盐水;DKK-1 组[11]大 鼠 需 腹 腔 注 射100 mg/kg DKK-1 且灌胃等量的生理盐水;CGD-H+DKK-1 组大鼠在灌胃20 g/kg CGD 的同时还需腹腔注射100 mg/kg DKK-1;Model 组、CK 组大鼠均需灌胃及腹腔注射等量的生理盐水,每天给药1 次,给药共持续4 周。
1.3.2 标本收集
末次给药24 h 后,腹腔注射2%戊巴比妥钠麻醉所有大鼠,尾静脉取血(离心收集血清)用于CTX-Ⅰ、BGP 的检测;处死大鼠并收集其左右两侧的股骨组织,利用micro-CT 仪检测左侧股骨微观结构相关指标骨体积分数、骨小梁厚度、骨密度、骨小梁数量的变化;将大鼠右侧股骨组织,分为两部分,一部分固定于4%多聚甲醛中用于HE、ALP 钙-钴、TRAP 染色,另一部分冻存于-80℃中用于Western blot 实验。
1.3.3 ELISA 法检测血清中CTX-Ⅰ、BGP 水平
按照试剂盒说明检测血清中CTX-Ⅰ、BGP水平。
1.3.4 股骨微观结构相关指标的检测
取各组大鼠左侧股骨固定于10%福尔马林溶液中,利用micro-CT 仪平扫大鼠左侧股骨,扫描参数设置为:管电压50 kV,管电流400 μA,分辨率10 μm,曝光时间300 ms,扫描角度360°。 使用Med Project 4.1 和Micro View 软件对大鼠左侧股骨二维图像生成三维渲染,并自动计算骨体积分数、骨小梁厚度、骨密度、骨小梁数量的变化。
1.3.5 HE 染色检测大鼠股骨病理变化
将固定于4%多聚甲醛中的股骨组织脱钙、包埋、切片(5 μm 厚)、HE 染色后,观察股骨病理变化。
1.3.6 ALP 钙-钴染色检测大鼠股骨中成骨细胞活性
取1.3.5 中的组织切片,经脱蜡后,用ALP 孵育液孵育12 h,自来水冲洗;加入硝酸钴孵育5 min,自来水冲洗;加入硫化工作液孵育2 min,自来水冲洗;核固红染色,自来水冲洗;将切片脱水、透明、封片。 利用光学显微镜观察细胞质内深褐色沉淀形成情况,褐色沉淀形成越多,表明成骨细胞活性越高。
1.3.7 TRAP 染色检测大鼠股骨组织中破骨细胞活性
取1.3.5 中的组织切片,经脱蜡后,用TRAP 固定液固定1 min,自来水冲洗;TRAP 孵育液孵育1 h,自来水冲洗;苏木素染液染色7 min,自来水冲洗;将切片脱水、透明、封片。 利用光学显微镜观察细胞质内紫红色沉淀形成情况,紫红色沉淀形成越多,表明破骨细胞活性越高。
1.3.8 Western blot 检测各组大鼠股骨组织中Wnt3a、β-catenin 蛋白
用RIPA 裂解缓冲液提取股骨组织总蛋白,提取的蛋白经定量、电泳、转膜、封闭后,在4℃下将膜分别与一抗Wnt3a(1 ∶1000)、β-catenin(1 ∶2000)、GAPDH(1 ∶1000)过夜孵育。 次日,将膜与二抗(1∶2000)共同孵育2 h。 ECL 试剂用于蛋白印迹观察,ImagePro Plus 软件评估条带强度。
1.4 统计学方法
使用GraphPad Prism 8 进行数据分析,所有数据均以平均数±标准差(±s)表示,各组数据均符合正态且方差齐。 单因素方差分析多组间的差异,进一步两两比较行SNK-q检验。P<0.05 为差异有统计学意义。
2 结果
2.1 CGD 对大鼠血清中CTX-Ⅰ、BGP 水平的影响
与CK 组比较,Model 组大鼠血清中CTX-Ⅰ水平升高,BGP 水平降低(P<0.05);与Model 组相比,CGD-L 组、CGD-H 组、EV 组大鼠血清中CTX-Ⅰ水平降低,BGP 水平升高,DKK-1 组大鼠血清中CTX-Ⅰ水平升高,BGP 水平降低(P<0.05);与CGD-H 组比较,CGD-H+DKK-1 组大鼠血清中CTX-Ⅰ水平升高,BGP 水平降低(P<0.05)。 见表1。
表1 CGD 对各组大鼠血清中CTX-Ⅰ、BGP水平的影响(±s,n=12)Table 1 Effect of CGD on serum CTX-Ⅰand BGP levels of rats in each group

表1 CGD 对各组大鼠血清中CTX-Ⅰ、BGP水平的影响(±s,n=12)Table 1 Effect of CGD on serum CTX-Ⅰand BGP levels of rats in each group
注:与CK 组比较, *P<0.05;与Model 组比较, #P<0.05;与CGD-L组比较, △P<0.05;与CGD-H 组比较, ▲P<0.05。Note.Compared with CK group, *P <0.05.Compared with Model group, #P<0.05.Compared with CGD-L group, △P<0.05.Compared with CGD-H group, ▲P<0.05.
组别Groups CTX-Ⅰ(ng/mL) BGP(ng/mL)CK 12.25±1.03 13.75±1.01 Model 28.74±1.75* 6.28±0.17*CGD-L 23.45±1.61# 8.25±0.28#CGD-H 14.46±0.98#△ 12.31±0.69#△EV 14.57±1.05#△ 12.51±0.76#△DKK-1 35.56±1.73# 3.69±0.22#CGD-H+DKK-1 20.32±1.77▲ 9.32±0.45▲
2.2 CGD 对大鼠股骨微观结构的影响
与CK 组比较,Model 组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量降低(P<0.05);与Model 组比较,CGD-L 组、CGD-H 组、EV 组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量升高,DKK-1 组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量降低(P<0.05);与CGD-H 组比较,CGD-H+DKK-1 组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量降低(P<0.05)。 见图1和表2。
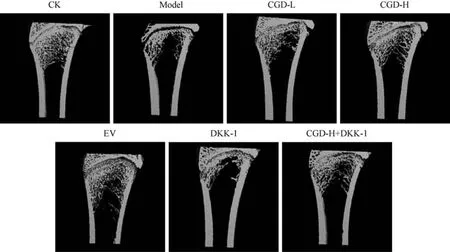
图1 Micro-CT 仪检测大鼠股骨微观结构Figure 1 Micro-CT apparatus for detecting the microstructure of rat femur
表2 CGD 对各组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量的影响(±s,n=12)Table 2 Effect of CGD on femoral bone volume fraction, trabecular thickness, bone density and trabecular number of rats in each group

表2 CGD 对各组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量的影响(±s,n=12)Table 2 Effect of CGD on femoral bone volume fraction, trabecular thickness, bone density and trabecular number of rats in each group
注:与CK 组比较, *P<0.05;与Model 组比较, #P<0.05;与CGD-L 组比较, △P<0.05;与CGD-H 组比较, ▲P<0.05。Note.Compared with CK group, *P<0.05.Compared with Model group, #P<0.05.Compared with CGD-L group, △P<0.05.Compared with CGD-H group, ▲P<0.05.
组别Groups骨体积分数(%)Bone volume fraction骨小梁厚度(mm)Trabecular thickness骨密度(g/mm3)Bone density骨小梁数量(n/mm)Number of trabeculae CK 19.67±0.54 0.078±0.002 0.29±0.01 5.89±0.23 Model 9.89±0.34* 0.023±0.001* 0.12±0.01* 1.72±0.14*CGD-L 12.62±0.42# 0.039±0.002# 0.18±0.01# 2.32±0.15#CGD-H 17.72±0.48#△ 0.066±0.004#△ 0.27±0.02#△ 5.21±0.26#△EV 17.81±0.50#△ 0.068±0.003#△ 0.26±0.01#△ 5.24±0.27#△DKK-1 6.31±0.27# 0.011±0.001# 0.06±0.01# 1.06±0.09#CGD-H+DKK-1 13.66±0.45▲ 0.042±0.002▲ 0.19±0.02▲ 2.94±0.20▲
2.3 CGD 对大鼠股骨病理损伤的影响
CK 组大鼠股骨组织切片呈现出丰富、连续、致密的骨小梁;Model 组大鼠股骨组织切片表现为有大的骨髓腔形成以及骨小梁数量减少,符合OP 的典型特征,见图2。 与Model 组比较,CGD-L 组、CGD-H 组、EV 组大鼠股骨病理损伤减轻,DKK-1 组大鼠股骨中形成的骨髓腔变大,骨小梁数量减少;与CGD-H 组相比,CGD-H+DKK-1 组大鼠股骨大的骨髓腔形成以及骨小梁数量减少的特征更加明显。
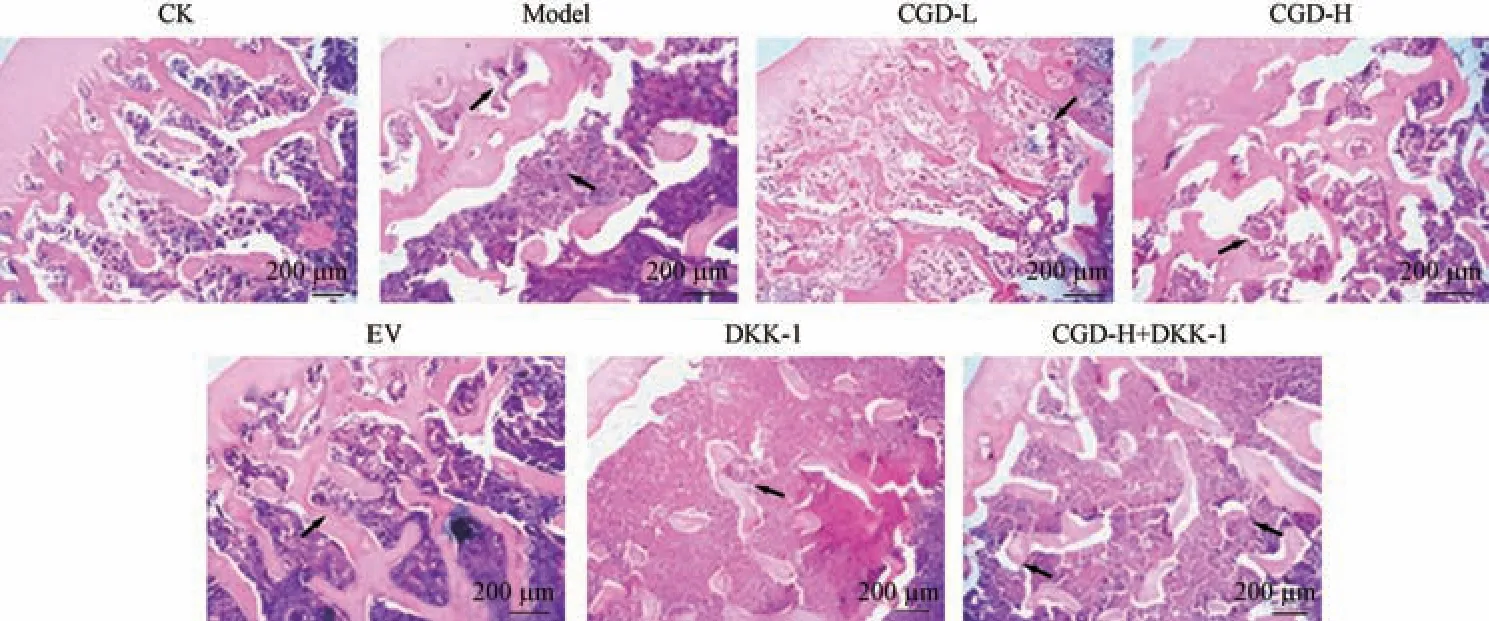
注:箭头所指处为骨髓腔。图2 HE 染色检测大鼠股骨病理变化Note.Arrow pointed to the bone marrow cavity.Figure 2 Pathological changes of rat femur detected by HE staining
2.4 CGD 对大鼠股骨组织中成骨细胞活性的影响
如图3 所示,与CK 组相比,Model 组股骨组织中成骨细胞质内深褐色沉淀减少;与Model 组比较,CGD-L 组、CGD-H 组、EV 组大鼠股骨组织中成骨细胞质内深褐色沉淀增多,DKK-1 组大鼠股骨组织中成骨细胞质内深褐色沉淀减少;与CGD-H 组比较,CGD-H+DKK-1 组大鼠股骨组织中成骨细胞质内深褐色沉淀减少。
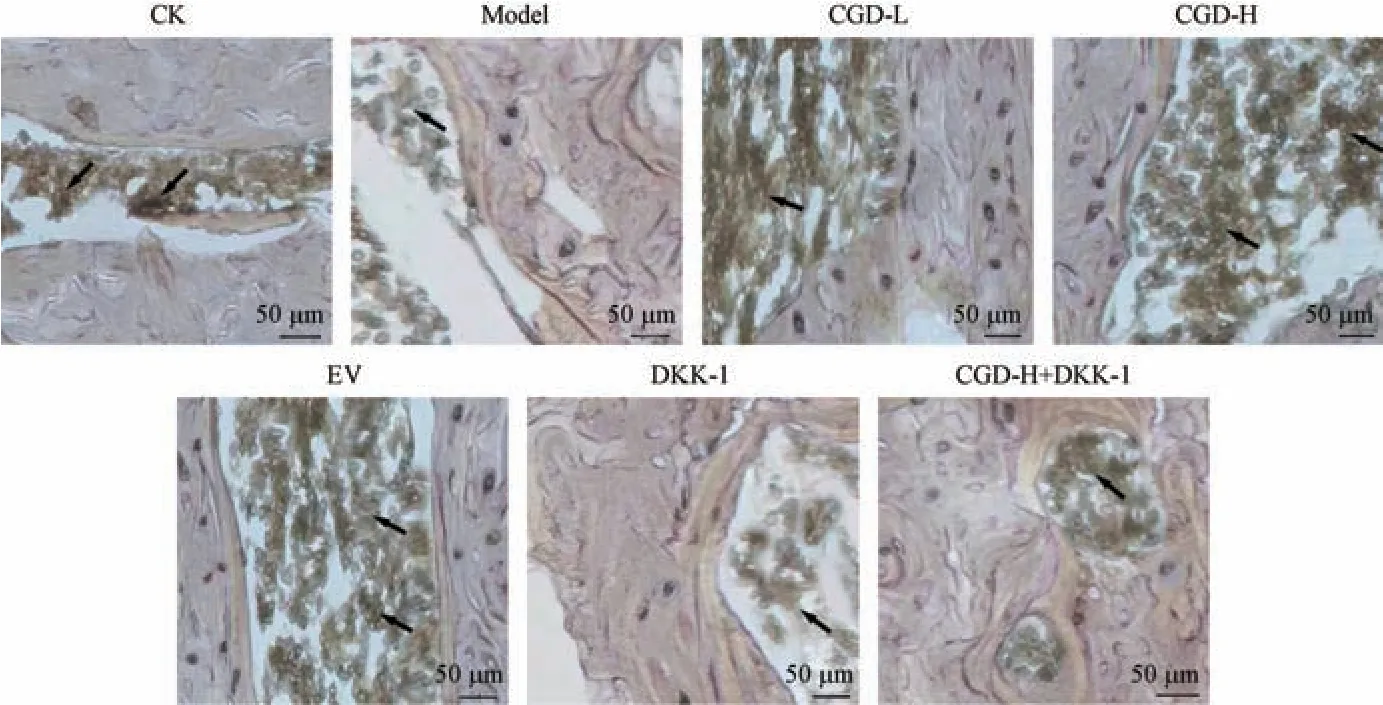
注:箭头所指处为成骨细胞质内深褐色沉淀。图3 ALP 钙-钴染色检测大鼠股骨中成骨细胞活性Note.Arrow pointed to a dark brown deposit in the osteoblastic cytoplasm.Figure 3 Detection of osteoblast activity in rat femur by ALP calcium cobalt staining
2.5 CGD 对大鼠股骨组织中破骨细胞活性的影响
图4 结果显示,与CK 组比较,Model 组大鼠股骨组织中的破骨细胞质内紫红色沉淀(箭头所指处)明显增多;与Model 组比较,CGD-L 组、CGD-H组、EV 组大鼠股骨组织中的破骨细胞质内紫红色沉淀明显减少,DKK-1 组大鼠股骨组织中的破骨细胞质内深褐色沉淀增多;与CGD-H 组比较,CGD-H+DKK-1 组大鼠股骨组织中的破骨细胞质内深褐色沉淀增多。
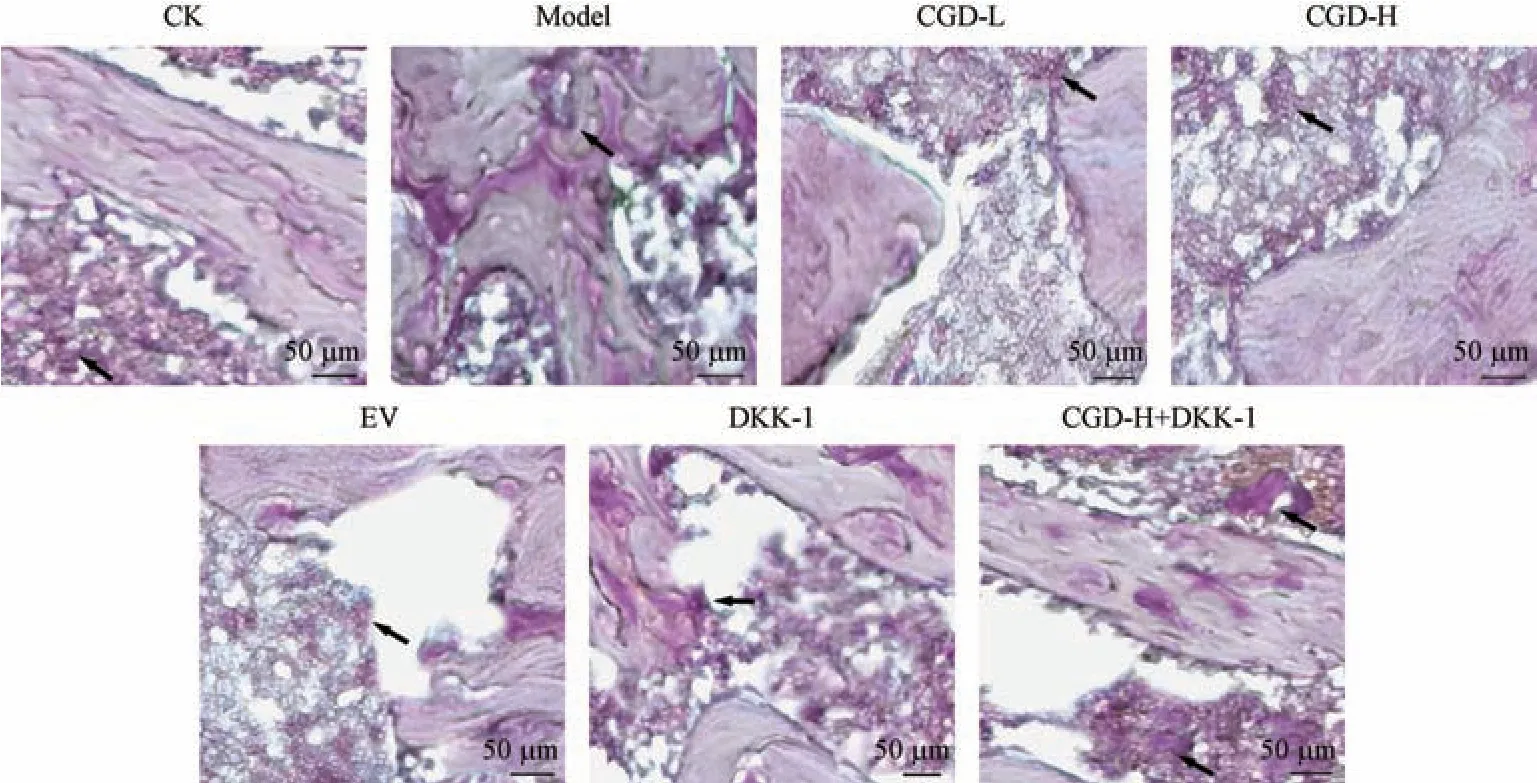
注:箭头所指处为破骨细胞质内紫红色沉淀。图4 TRAP 染色检测大鼠股骨组织中破骨细胞活性Note.Arrow pointed to a purplish red deposit in the osteoclast cytoplasm.Figure 4 Detection of osteoclast activity in rat femur by TRAP staining
2.6 CGD 对大鼠股骨组织中Wnt/β-catenin 相关蛋白表达的影响
如图5 所示,与CK 组比较,Model 组大鼠股骨组织中Wnt3a、β-catenin 蛋白表达降低(P<0.05);与Model 组比较,CGD-L 组、CGD-H 组、EV 组大鼠股骨组织中Wnt3a、β-catenin 蛋白表达升高,DKK-1组大鼠股骨组织中Wnt3a、β-catenin 蛋白表达降低(P<0.05);与CGD-H 组比较,CGD-H+DKK-1 组大鼠股骨组织中Wnt3a、β-catenin 蛋白表达降低(P<0.05)。
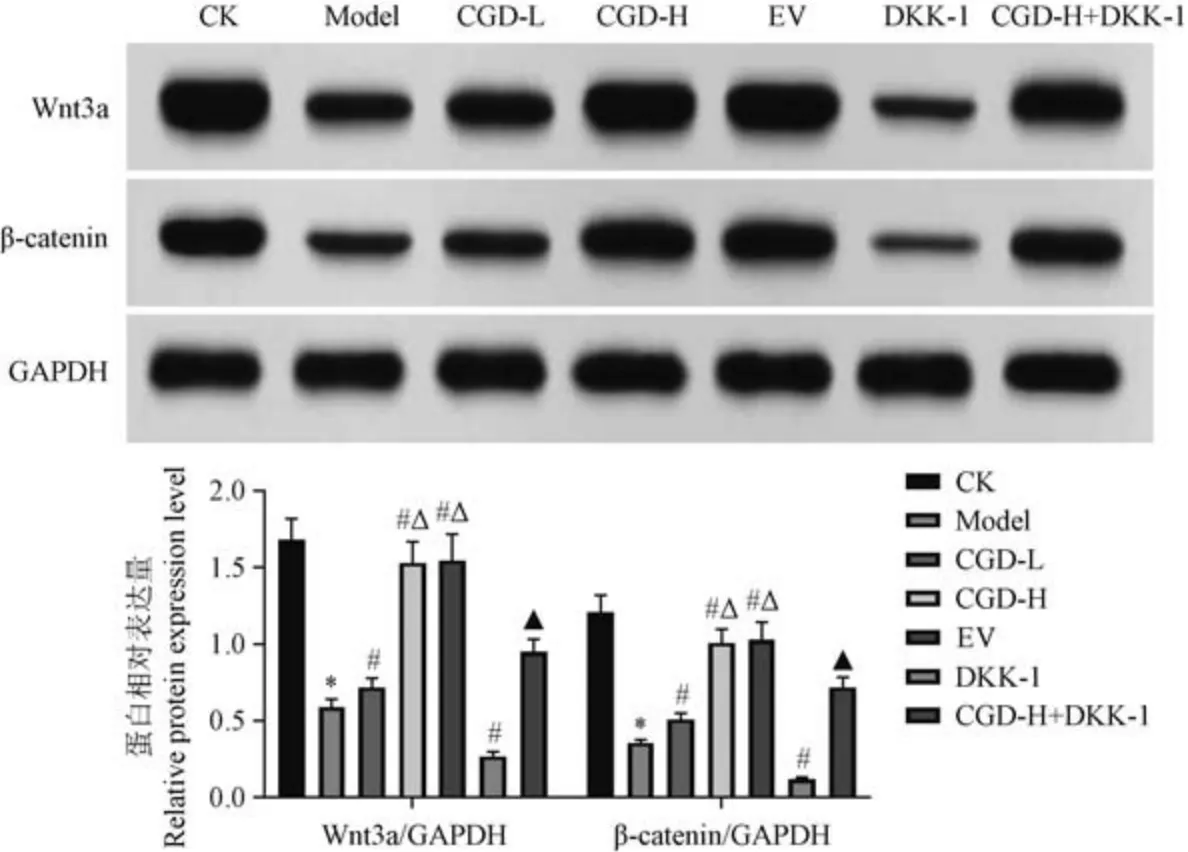
注:与CK 组比较, *P<0.05;与Model 组比较, #P<0.05;与CGD-L 组比较, △P<0.05;与CGD-H 组比较, ▲P<0.05。图5 Western blot 检测各组大鼠股骨组织中Wnt3a、β-catenin 蛋白Note.Compared with CK group, *P<0.05.Compared with Model group, #P<0.05.Compared with CGD-L group, △P<0.05.Compared with CGD-H group, ▲P<0.05.Figure 5 Western blot detection of Wnt3a and β-catenin proteins in femoral tissue of rats in each group
3 讨论
OP 是一种以矿化骨量减少为特征的疾病,在解剖学上主要表现为皮质厚度和孔隙率减少,松质骨小梁的数量和大小减少,髓质空间扩大[12]。 有研究报道,骨的生物力学能力不仅与存在的骨量有关,还与它的微观结构(骨体积分数、骨小梁厚度、骨密度、骨小梁数量等)有关[13]。 本研究通过灌胃维甲酸的方式构建OP 大鼠模型,结果显示,Model组大鼠的股骨组织切片表现为有大的骨髓腔形成以及骨小梁数量减少,Model 组大鼠股骨骨体积分数、骨小梁厚度、骨密度、骨小梁数量显著低于CK组,提示成功构建了OP 模型大鼠。 研究报道,破骨细胞介导的骨吸收和成骨细胞介导的骨形成之间的不平衡导致了OP,其中,成骨细胞和破骨细胞活性的不平衡起主要作用[14];CTX-Ⅰ是骨吸收标志物,而BGP 为骨形成的标志物,因此,血清中CTX-Ⅰ、BGP 水平可作为衡量OP 过程中骨形成的重要指标[15-16]。 本研究发现,与CK 组相比,Model 组破骨细胞活性升高、成骨细胞活性降低,血清中CTX-Ⅰ水平升高、BGP 水平降低,表明成骨细胞介导的骨形成低于破骨细胞介导的骨吸收,导致了骨量减少,进而形成了OP。
OP 属“骨痿”范畴,中医认为其主要病机为肝失所养、脾失健运,故主张以疏肝理气、健脾为治疗原则[17]。 CGD 在原方的基础上通过去人参避免补益太过;加入焦神曲健脾和胃;白术健脾益气;党参补中益气,合为CGD 方,以增强其疏肝和胃、健脾之功效。 目前,不同种类的的CGD 方已应用于多种疾病的研究,如CGD 可抑制三阴性乳腺癌裸鼠体内肿瘤的生长[18];CGD 治疗功能性消化不良效果显著[19]。 而关于CGD 对OP 的影响尚未见报道。 本研究显示,CGD 可抑制破骨细胞活性及CTX-Ⅰ水平,上调成骨细胞活性并促进BGP 表达,且CGD 剂量越高,对应的趋势越明显,而CGD-H 组与EV 组相比对应指标的趋势变化差异不显著,说明CGD 可能是通过促进成骨细胞介导的骨形成,并抑制破骨细胞介导的骨吸收来改善大鼠OP 的。 此外,尽管EV 治疗OP 效果显著,但其极易产生胃肠道反应、精神状态不佳等副作用[20]。 提示CGD 可能成为治疗OP 的潜在优良药物。
大量研究表明,Wnt/β-catenin 通路可以刺激成骨细胞增殖和分化,在OP 进展中发挥重要作用[21]。 如二甲双胍激活Wnt/β-catenin 通路可治疗糖尿病性OP[22];益肾健骨颗粒通过激活Wnt/β-catenin 通路促进去卵巢大鼠成骨细胞增殖而改善绝经后骨质疏松[23]。 以上研究表明激活Wnt/β-catenin 通路可以改善OP。 本研究显示,经Wnt/β-catenin 通路抑制剂DKK-1 处理后,Model 组大鼠对成骨细胞介导的骨形成的抑制作用以及对破骨细胞介导的骨吸收的促进作用增强,表明Wnt/β-catenin 通路确实参与了OP 过程。 本研究还发现,CGD 可上调Model 组大鼠股骨组织中Wnt3a、β-catenin 蛋白表达,且CGD 剂量越高,Wnt3a、β-catenin 蛋白表达上调趋势越明显,猜想CGD 改善大鼠OP 可能是通过激活Wnt/β-catenin 通路实现的。 为了验证该猜想,本研究在高剂量CGD 处理的基础上再用DKK-1 干预OP 大鼠,结果发现,DKK-1减弱了高剂量CGD 对大鼠OP 的改善作用。
综上所述,CGD 可能通过激活Wnt/β-catenin通路改善大鼠OP。 该研究可能为OP 的治疗提供了一个新的视角。 CGD 对大鼠OP 的改善作用可能还涉及其他通路,本研究尚未探究,这将是后续研究的重点内容之一。
