胚胎发育不良性神经上皮肿瘤影像学表现
2023-12-03王东东申玉兰
吴 捷 王东东 申玉兰
胚胎发育不良性神经上皮肿瘤(dysembryoplastic neuroepithelial tumor, DNET)是一种少见的神经系统良性肿瘤,2021年WHO 中枢神经系统肿瘤分类中DNET 属于WHO Ⅰ级,其基因/分子特征为FGFR1突变[1],好发于儿童及青少年,临床表现多为药物难治性癫痫[2],提高对DNET 表现的认识,有利于指导DNET的术前诊断与鉴别诊断。
方法
1. 临床资料
搜集整理复旦大学附属华山医院2015年1月—2021年10月经手术病理证实的DNET 患者临床资料及磁共振图像36 例,其中男性22 例,女性14 例,平均年龄(22.7±8.3)岁,最大年龄57 岁,最小年龄6岁。36例病例中,3例头晕头痛,2例初次出现癫痫,其余31 例均为难治性癫痫,病程最短16 天,最长25年。
2. MR成像检查
所有检查均在 3.0 T 磁共振扫描仪(DISCOVERY MR750 W,AW Volume Share TM 5)上进行,采用16 通道相控阵头线圈,成像序列包括T1 加权成像(T1WI)、T2 加权成像(T2WI)、弥散加权成像(DWI)、液体抑制反转恢复序列(FLAIR)及增强序列扫描(参数见表1)。注射对比剂钆喷酸葡甲胺(Gd-DTPA,剂量为0.1 mmol/kg)后行横断面及矢状面扫描。
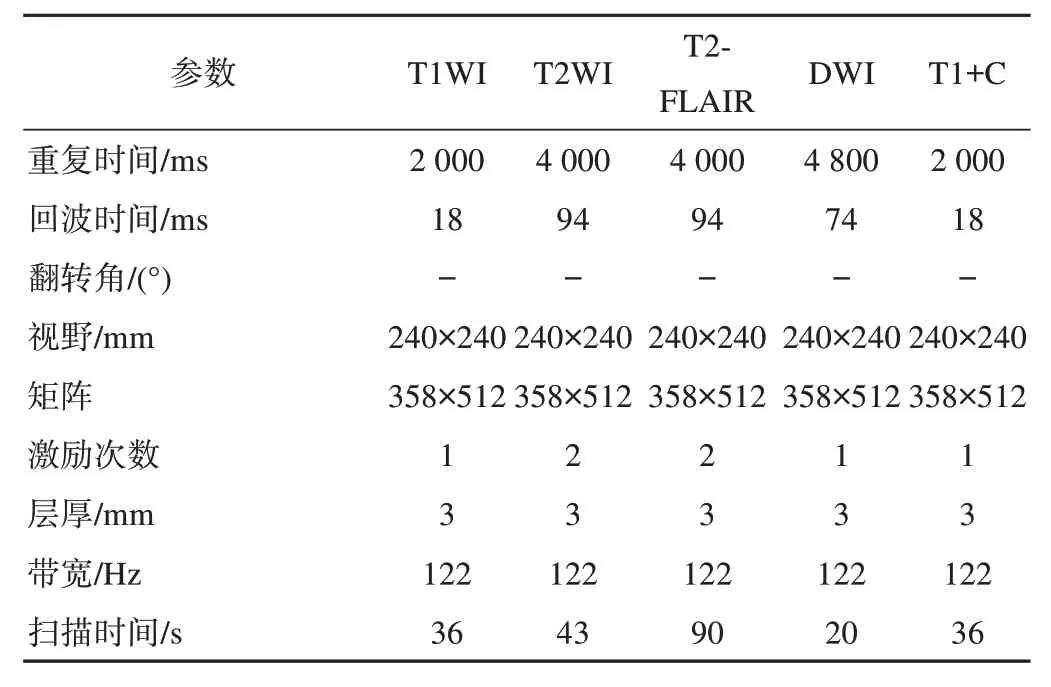
表1 磁共振序列参数
3. 图像分析
所有影像学检查均由2 名高年资医师(工作年限大于10年)进行分析,结果不一致时通过商讨后达成一致,主要内容包括病灶的数目、形态、大小、分布部位、病变累及的范围及对周围邻近结构影响,MR图像特征,增强扫描后病灶的强化特点。
结果
36 例DNET 患者均为单发病灶。病灶分布:19例位于颞叶,9例位于额叶,3例位于额顶叶,2例位于顶叶,2 例位于枕叶,1 例位于颞叶深部海马区;病灶以累及脑皮质为主,31 例病灶累及皮质,5 例病灶部分累及皮质下白质,病灶主体仍在皮质。病灶形态:8 例为单纯类圆形或椭圆形囊性灶,17 例病变为楔形或倒三角形,11 例为沿脑皮质不规则分布,其中8例呈脑回样改变。21例病灶内可见多发大小不等类圆形囊性结构。磁共振表现:T1WI 均以低信号为主,3 例病灶内T1WI 见线状稍高信号,T2WI 以高信号为主,11 例病灶内见线状稍高信号及等信号改变,3 例见稍低信号改变。T2-FLAIR 失配征28 例。增强扫描15 例无明显强化改变,16 例病灶内见线状及斑片状轻度强化改变,5 例见壁结节状轻度强化。术前MRI 分型:Ⅰ型类囊性24 例(图1),Ⅱ型结节状5例,Ⅲ型发育异常样7例。具体见表2。
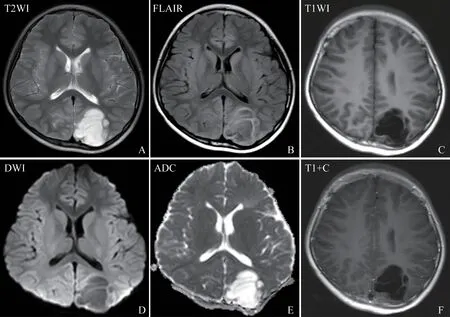
图1 典型病例影像

表2 36例DNET的影像学表现
讨论
DNET 患者常以癫痫发作就诊,发病年龄通常小于20 岁,约70%~85%[3];本组研究36 例患者中,20 岁以下占50%,30 岁以下达80.56%。DNET 病理大体表现为界限清楚的孤立结节状肿块或界限不清的病变,多数位于皮质,较大时可延伸到皮质下白质。病灶好发于幕上颞叶,其次为额叶,其他顶叶、枕叶相对少见。其特征都是由少突胶质样细胞、成熟神经元及星形细胞组成,钙化(25%)并不罕见,但很少观察到坏死和微血管增生[4]。本组病例分布以颞叶(19/36,52.8%)、额叶(9/36,25%)为著,与文献所报道的颞叶约占62%,额叶约31%[5]相仿,其余病例分布于顶、枕叶、海马区、基底节区及部分桥脑;31 例病灶累及皮质,5 例病灶部分累及皮质下白质,主体病灶仍在皮质。
本研究中8 例为单纯类圆形或椭圆形囊性灶,其病理组织特异性胶质神经元成分(specific glioneuronal element,SGNE)由多个大小不等的假性囊肿构成;17 例病灶呈“楔形”或“倒三角形”,则可能与神经纤维通路的放射状分布有关;其余11例则为沿脑皮质不规则分布。本组36 例病例累及范围均较局限,对周围结构无明显受压,边缘亦未见明显水肿信号,提示肿瘤的生长较缓慢,可伴有邻近颅骨骨质变薄、部分病例见骨质吸收。
DNET 肿瘤组织主要由特异性胶质神经元成分和黏液样基质构成,MRI 表现以T1WI 低信号、T2WI高信号为主。本组病例MRI 表现为T1WI 低信号,其中3 例病灶内T1WI 见线状稍高信号,可能与瘤体内存在微出血或拱形血管结构有关[6];T2WI 以明显高信号为主,11 例病灶内见线状稍高信号及等信号,3例见稍低信号改变,提示瘤内有分隔或少许微出血灶或者钙化;27 例病灶边缘可见FLAIR 序列环形高信号,其中13 例为较完整的环形改变,其余病例环形结构缺失;部分病灶内见分隔,表现为T2WI 序列内线状等、稍高信号影,反映了DNET结构以及正常组织、胶质结节与“特异性胶质神经元成分”之间的分界。
T2-FLAIR 失配征定义为病灶T2WI 上均匀的高信号,同时FLAIR 上中心低、边缘高信号[8],多项研究证实其为弥漫性星形细胞瘤伴IDH 突变、但无1p/19q 共缺失的成像生物标志物,具有100%的阳性预测值,可为术前诊断IDH 突变型星形细胞瘤伴1p/19q 未联合缺失型提供依据,其病理特征为肿瘤内部的微囊变[9]。有研究[10]评估DNET病灶T2-FLAIR失配征的表现情况,并以此尝试鉴别幕上DNET与低级别胶质瘤。本研究结果显示36 例DNET 患者影像学T2-FLAIR 失配征28 例,77.8%的比例略高于先前的研究报道72.7%[10],因此,T2-FLAIR 失配征在DNET 病灶中并不少见,并非仅见于弥漫性星形细胞瘤伴IDH 突变伴1p/19q 未联合缺失,故不能作为幕上DNET和低级别胶质瘤的鉴别征象。
组织学根据SGNE 含量将DNET 分为单纯型、复杂型和非特异型[4],单纯型和复杂型DNET 通常术前被视为Ⅰ型,而非特异型DNET 则被视为Ⅱ型或Ⅲ型[7],其中Ⅰ型(囊性/多囊样)DNET,其致痫区定位于肿瘤本身,手术需尽量完整切除病灶;Ⅱ型(结节样)由于致痫区涉及瘤周皮质,手术方案需采取病灶扩大切除;Ⅲ型(发育异常样)致痫区涉及比Ⅱ型更广泛的区域,同样手术需采取扩大切除。磁共振强化方式是DNET 术前分型的重要参考,其强化机制为:(1)肿瘤组织内血管的拱形构造;(2)癫痫反复发作破坏血脑屏障。本组病例内15 例无明显强化,16 例病灶内见线状及斑片状轻度强化,5 例见壁结节状轻度强化,因此根据MRI 表现和强化方式可将本研究病例分为:Ⅰ型24例,Ⅱ型5例,Ⅲ型7例。
本研究的主要局限性:(1)本研究所纳入36 例DNET 患者样本量相对较少,部分影像学征象比例较以往文献有所出入;(2)T2-FLAIR 失配征虽可见于DNET 患者,但本研究并未利用T2-FLAIR 失配征对幕上DNET 和皮质下低级别胶质瘤进行鉴别。为此,我们将在后续研究中扩大样本量并进一步与低级别胶质瘤比较,以明确T2-FLAIR失配征的鉴别价值。
综上,DNET 临床及影像学表现具有一定特征性,常见于难治性癫痫的青少年患者,影像学表现为幕上皮质下楔形、倒三角形病灶,部分DNET可表现T2-FLAIR失配征。
