藜麦蛋白的提取、功能特性及改性方式研究进展
2023-12-03付丽霄汤晓智
付丽霄,冯 潇,汤晓智
(南京财经大学食品科学与工程学院,江苏省现代粮食流通与安全协同创新中心,江苏高校粮油质量安全控制及深加工重点实验室,江苏南京 210023)
藜麦(Chenopodium quinoaWilld.),是一种原产于南美洲的假谷物,被称为南美的“超级谷物”,由于其具有卓越的营养品质而被广泛认可[1-2]。藜麦对寒冷、高海拔、干燥等严苛的环境有很好的耐受性,因此现代藜麦的种植区域已经从玻利维亚、秘鲁、厄瓜多尔和智利等主产国扩散到中国、澳大利亚和英国等国家[3-5]。藜麦种子是FAO 认定的重要营养来源。联合国粮农组织(FAO)报道称,藜麦种子对盐分和胁迫条件的耐受性以及在边缘地区生长的潜力有助于提高21 世纪的农业生产力[6]。
藜麦被认为是改善世界粮食安全的重要作物[7]。不仅含有人体所需的所有必需氨基酸,而且富含不饱和脂肪酸与多糖等营养素,还含有矿物质和维生素等微量营养素[8-9]。藜麦的蛋白质含量约为12%~23%,高于大麦、水稻、玉米和小麦。大多数谷物蛋白缺乏赖氨酸,而藜麦蛋白中的赖氨酸含量为5.1%~6.4%,是大米和玉米的两倍[10]。藜麦蛋白富含色氨酸,含硫氨基酸如蛋氨酸和半胱氨酸的含量也较高[10-13]。藜麦蛋白不仅营养价值高,含有全部必需氨基酸,氨基酸比例均衡,而且具有溶解性、起泡性和凝胶性等功能特性。近年来,藜麦蛋白作为全营养蛋白质已经得到广泛的认可,已添加在人造肉、烘焙制品和挤压制品中,这说明藜麦蛋白具有广泛的应用范围及潜力[14-15]。深入研究藜麦蛋白的功能特性,了解改性方式对藜麦蛋白功能特性的影响,对于改善藜麦蛋白的加工适应性以及提高藜麦蛋白的利用率均具有重要的理论指导意义[6,16]。
本文主要综述了目前关于藜麦蛋白的营养价值和常用的提取方法如碱提酸沉法、盐溶法和酶辅助提取法的研究进展,概述了藜麦蛋白的功能特性及不同改性方式对藜麦蛋白性质的影响,为藜麦蛋白的深入研究提供参考。
1 藜麦蛋白的组成及营养价值
藜麦中蛋白质含量较高,体外消化率高且氨基酸种类多,藜麦蛋白可以代替肉类和奶制品为人体提供蛋白质,同时也是生物活性肽的良好来源[3]。Ferreira等[17]测定了78 份取自巴西、玻利维亚和秘鲁的藜麦,构成校正集和预测集,其中校正集的蛋白质含量为23.94%±5.04%,预测集的蛋白含量为24.0%±3.05%。藜麦蛋白主要包括11S 球蛋白(37%)和2S 清蛋白(35%),其次是含量较低的醇溶蛋白和7S 球蛋白[18]。11S 球蛋白与大豆11S 球蛋白结构相似,是由六对酸、碱多肽组成的六聚体,酸、碱多肽的分子量分别为30~40 kDa 和20~25 kDa,通过二硫键连接组成[19-20]。与11S 球蛋白相比,7S 球蛋白的亚基是由疏水相互作用连接[21]。清蛋白在还原条件下分子质量为8~9 kDa,而藜麦蛋白质不同组分的比例会由于产地不同而有所不同[17,19]。
藜麦是优质蛋白质,含有人体必需的9 种氨基酸,即缬氨酸、亮氨酸、异亮氨酸、苯丙氨酸、色氨酸、蛋氨酸、赖氨酸、苏氨酸和组氨酸,并且氨基酸组成与人体中的相似[22-23]。藜麦不含限制性氨基酸,如赖氨酸、蛋氨酸和色氨酸[24]。Dakhili 等[25]发现藜麦的赖氨酸含量(5.4 g/100 g 蛋白)是小麦(2.7 g/100 g蛋白)的2 倍,大米(3.8 g/100 g 蛋白)的1.42 倍,所以藜麦适宜赖氨酸缺乏症患者食用。与此同时,藜麦蛋白的消化率高于小麦及玉米等谷物,更易于被人体消化吸收[26]。藜麦、小麦、大豆、大米蛋白的氨基酸组成见表1。根据表1 可知,藜麦中的赖氨酸、组氨酸和甘氨酸含量比其他谷物的含量高,其中组氨酸是孕产妇、婴幼儿所需的氨基酸[24]。除此之外,藜麦还富含谷氨酸、天冬氨酸和精氨酸。

表1 藜麦蛋白和其他谷物蛋白的氨基酸组成[19,25-29]Table 1 Amino acid composition of protein from quinoa and other cereals[19,25-29]
2 藜麦蛋白的提取方法
目前,藜麦蛋白分离提取的方法主要有碱提酸沉法、盐溶法、酶辅助提取法、有机溶剂法和水提法等[19],本文主要介绍应用较多的前三种方法。
2.1 碱提酸沉法
碱提酸沉法主要是通过添加碱溶液使植物中的蛋白质增溶,之后加酸调节pH 至蛋白质的等电点沉淀蛋白[30]。现阶段关于藜麦蛋白的提取大多数都采用简单、快速的碱提酸沉法[16],碱提酸沉法的提取率较高。但是用此方法提取蛋白易造成环境污染,过酸或过碱也会导致蛋白质变性,而且消耗水、碱和酸的量大。马洪鑫等[31]采用碱提酸沉法提取藜麦蛋白,发现其提取率最高可达76.84%。王棐等[16]以脱皮藜麦为原料提取藜麦蛋白,发现在最佳提取条件下藜麦蛋白的提取率达到67.13%。用这种方法提取蛋白时需特别注意pH 的变化,过酸或过碱的条件都会引起蛋白质结构的变化,使蛋白质变性失活,从而影响藜麦蛋白的功能特性[32]。Abugoch 等[33]报道pH 为9 时的蛋白溶解度明显高于pH 为11 时的溶解度。Ruiz 等[32]也研究发现,与在较高pH 下(pH10、11)提取的蛋白相比,较低pH 下(pH8、9)提取的蛋白质的溶解度更高。可能是因为在高pH 下,蛋白变性程度较大,引起疏水基团暴露,从而导致溶解度较低。因此,本文建议碱提的pH 为8~9。
2.2 盐溶法
盐溶法通过在蛋白溶液中加入少量的中性盐如NaCl,使蛋白分子表面的电荷增加,增强蛋白分子与水分子的相互作用,从而增大蛋白质在溶液中的溶解度,利用透析等方法除盐之后,冷冻干燥得到蛋白。与碱提酸沉法相比,盐溶法提取出的藜麦蛋白的纯度较高,可以达到77.75%,而且中性盐不容易导致蛋白质变性。但是,盐溶法提取率较低、提取时间长,而且会对蛋白表面结构造成破坏[31]。目前,较常用的盐有氯化钠、硫酸铵和磷酸钠,盐浓度是盐溶法提取蛋白的重要影响因素。Elsohaimy 等[26]研究了不同NaCl 浓度对藜麦蛋白提取率的影响,发现提取介质中添加较低浓度的NaCl(0~0.5 mol/L)能使藜麦蛋白的提取率显著提高,达到353.61~467.58 μg/mL。当盐浓度较低时,阳离子中和蛋白质表面的电荷,防止其聚集[34]。Guerreo-Ochoa 等[35]研究发现,较高浓度的NaCl(1 mol/L)溶液对藜麦蛋白的提取有一定的负面影响。NaCl 对提取蛋白的负面影响可能是由于在较高的盐浓度下,蛋白表面的静电斥力被屏蔽,在蛋白与蛋白的疏水相互作用力下,蛋白质发生聚集和沉淀[36]。碱提酸沉法和盐溶法提取出的藜麦蛋白的扫描电镜图呈现于图1 中,碱溶蛋白整体结构完整,表面光滑,呈连续的聚集块状结构,而盐溶蛋白结构疏松,表面颗粒粗糙,不规则[37]。
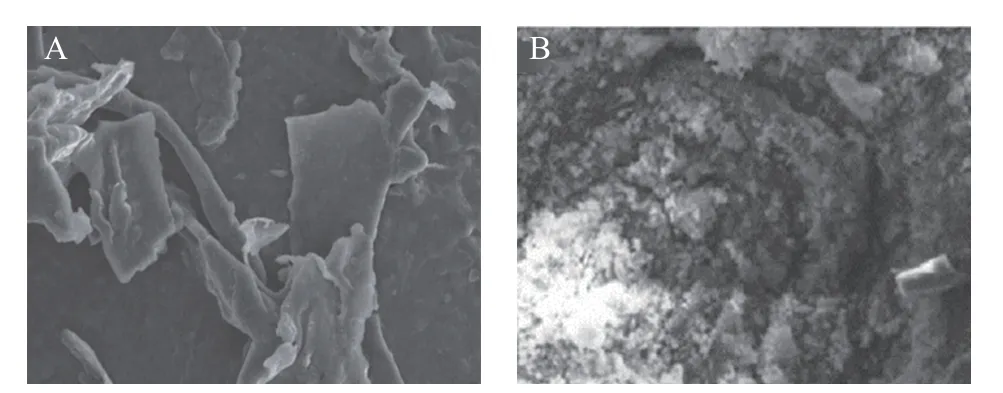
图1 藜麦蛋白的扫描电镜图[23,37]Fig.1 SEM of quinoa protein[23,37]
2.3 酶辅助提取法
酶辅助提取蛋白质的应用是基于特定的酶降解纤维素、半纤维素和果胶,即植物细胞壁和纤维的主要成分,以及蛋白酶水解部分蛋白质以增加其溶解度,从而破坏细胞壁的完整性[38]。通过降解细胞壁,使蛋白质体的释放成为可能[39]。将含有蛋白的溶液进行离心,上清液冷冻干燥后得到蛋白粉末[40]。酶法提取藜麦蛋白,反应条件温和,操作相对比较简便,而且对蛋白品质无影响,但其成本较高[41]。目前关于酶法提取藜麦蛋白的文献较少。田格等[42]以藜麦种子为原料,通过复合酶(纤维素酶和糖化酶)协同超声提取藜麦蛋白,提取得到的藜麦蛋白提取率为76.82%。Miranda 等[43]通过比较碱提和酶辅助碱提取扁豆蛋白,发现在中性(pH7.0)和碱性条件下后者的溶解度更高。但是目前酶辅助提取法与其它提取方法对藜麦蛋白功能特性影响的比较未见报道。
3 藜麦蛋白功能特性
近年来,研究人员发现藜麦蛋白具有重要的功能和理化特性,如溶解性、消化性和凝胶性等,适合将其添加到不同的食品体系中,藜麦蛋白得到人们越来越多的关注[25-26]。藜麦蛋白也被认为是生物活性肽的良好来源。研究表明藜麦蛋白在胃肠道消化过程中能释放出具有生物活性的多肽,通过调节肠道菌群降低血压[14]。You 等[44]研究发现,经胃蛋白酶-胰蛋白酶消化的藜麦蛋白水解物具有较高的二肽基肽酶抑制活性,说明藜麦多肽具有预防Ⅱ型糖尿病的功能。但是到目前为止,关于藜麦蛋白生理功能的研究较少,所以本文主要介绍藜麦蛋白的物理化学性质,未来关于藜麦蛋白生理功能的研究将有较广阔的前景。
3.1 溶解性
溶解性表现的是蛋白质在水相中的分散能力[39],且pH 对藜麦蛋白的溶解性有较大影响。藜麦蛋白在酸性条件下溶解度较低,这与11S 球蛋白的等电点在4~5 左右有关。在碱性条件下,藜麦蛋白溶解度显著提高。Mir 等[45]研究发现藜麦蛋白溶解度从60.22%(pH9)升高到75.34%(pH10),再降低到70.78%(pH12)。这是由于在碱性条件下蛋白质所带负电荷逐渐增加,静电斥力增大,导致藜麦蛋白溶解度增大,继续增大pH(pH12)会使蛋白质变性聚集,降低溶解度[41]。藜麦蛋白的溶解性也和温度有关系,较低温度时(20~35 ℃),藜麦蛋白的溶解度与温度成正相关,但当温度升高到35 ℃以上时,溶解度开始下降[42]。因此,需要根据不同的实验需求选择合适的pH 和温度溶解藜麦蛋白。
3.2 乳化性
蛋白质的乳化特性是指它能在油-水体系中通过吸附在油水界面而形成稳定均一乳液的能力[46]。蛋白质的这一功能特性是由乳化活性指数(emulsifying activity index,EAI)和乳化稳定性指数(emulsifying stability index,ESI)确定的。研究发现,蛋白质的乳化性与溶解性有着密切的关系,溶解性的改善可能有利于乳化性的提高[47]。王棐等[16]通过研究发现藜麦蛋白的乳化性高于豌豆蛋白但低于大豆蛋白。目前有一些方法可以提高藜麦蛋白的乳化性,如Cen等[48]通过超声处理藜麦蛋白,发现随着超声强度的增大(150~450 W),藜麦分离蛋白的接触角会从56.89°增大到68.83°,这说明超声处理可以增强藜麦蛋白的表面疏水性,提高其乳化能力。且适当的盐离子添加,可以减少蛋白质间静电斥力,增加界面蛋白的吸附量,提高藜麦蛋白Pickering 乳液凝胶的粘弹特性及冻融稳定性(图2)。郭思倩等[49]发现萌发之后提取的藜麦蛋白的乳化性显著提高,具体原因还尚不明确,有待进一步的研究。Dias 等[40]研究表明,酶辅助法提取的扁桃仁蛋白的乳化性比水提法更强,但该方法是否可以应用于提高藜麦蛋白的乳化性,值得进一步的探索。

图2 超声及盐离子对藜麦蛋白Pickering 乳液稳定性的作用[48]Fig.2 Effects of ultrasound and salt ions on the stability of quinoa protein Pickering emulsion[48]
藜麦蛋白浓度对蛋白的乳化稳定性具有重要影响,当蛋白质浓度较低时,不足以覆盖油滴表面,使得油相部分暴露,此时油滴为了趋于稳定,和邻近油滴共用蛋白,从而导致絮凝,形成不稳定的乳液体系。蛋白浓度逐渐增加时,界面蛋白浓度增加,油滴表面完全被蛋白分子包裹,形成致密的蛋白膜,油滴粒径随着膜厚度的增加逐渐减小,乳液稳定性增强[50]。
3.3 起泡性
泡沫是具有连续相液体或固体的气泡分散体[51-52]。研究人员发现泡沫的起泡能力(foaming capacity,FC)和起泡稳定性(foaming stability,FS)主要受物理化学性能的影响[52-54]。Lopez 等[55]针对藜麦分离蛋白的起泡性能,采用混合法制备泡沫,用30 min 后记录的泡沫剩余体积计算其起泡稳定性,运用泡沫形成体积与液体初始体积的比值计算藜麦蛋白的起泡能力。藜麦蛋白的起泡性和泡沫稳定性均强于大豆蛋白,但低于蛋清蛋白[44]。蛋白质的起泡性会受到外部环境的影响,如藜麦分离蛋白的起泡能力随着藜麦蛋白浓度的增加而显著增加。当藜麦分离蛋白的浓度为0.1%时,其起泡量为58.37%±2.14%,而当藜麦分离蛋白的浓度为3%时,其起泡量为78.62%±2.54%。藜麦分离蛋白具有形成高稳定泡沫的能力,提高了其在食品加工中的应用潜力[26]。
3.4 持水性与持油性
持水和持油能力分别表示蛋白质在特定测试条件下吸收和保留水和油的能力,对蛋白质产品的质地和口感等有重要的影响[56-57]。高持水性有助于保持中等和高水分食品的多汁性和柔软性,如香肠和肉类模拟食品。目前研究发现藜麦分离蛋白的持水性高于小麦分离蛋白,与大豆分离蛋白相似[32,58]。尹丽莎等[59]发现藜麦分离蛋白的持水性和持油性都随着超声处理时间的延长呈现先下降再上升的趋势。这可能是因为在超声过程中,蛋白结构变得疏松,水分子更容易与蛋白结合。且空化效应使得蛋白颗粒变小,比表面积增大,同时蛋白的空间结构被破坏,暴露了埋藏在分子内的疏水基团,增加了蛋白的吸附和结合脂质的能力,进而改善了藜麦蛋白的持水和持油性[59]。由于藜麦蛋白具有较强的持水力,所以未来可将其应用于不同的食品中以改善食品的持水力和质地。如添加到肉制品中,提高肉制品的多汁性。
3.5 凝胶性
食品蛋白质,特别是球状蛋白质,在变性后能够通过聚集和其他蛋白质/化合物相互作用形成凝胶[60]。藜麦蛋白凝胶性较弱,形成凝胶强度较低且持水力弱[61]。Xu 等[62]报道在蛋白质形成凝胶时,加入适量的盐离子可以增强凝胶强度。离子类型、浓度和pH 对凝胶的结构与性质有显著影响[61]。Yang等[61]比较了不同浓度的NaCl 和CaCl2对藜麦分离蛋白热诱导凝胶的影响,研究结果表明,未加盐的藜麦分离蛋白凝胶的微观结构最细、最均匀。当NaCl浓度逐渐增大时(0~200 mmol/L),G'明显增加。可能是由于盐离子所带的电荷减弱了蛋白间的静电斥力,从而增强了蛋白质分子之间的吸引力,形成更紧密的凝胶网络结构[63]。有研究表明,碱性条件下(pH10 和pH11)提取的藜麦蛋白在加热时不形成凝胶,冷却后也只形成软凝胶[18]。这是因为在强碱性条件下蛋白变性程度较高,导致大颗粒聚集增多,小颗粒聚集减少,降低了凝胶网络结构的紧密性[18]。未来研究也可以通过酶交联(TG 酶等)、复合油脂形成混合凝胶以增强藜麦蛋白凝胶的凝胶性质。
3.6 消化特性
蛋白质的消化率是评估其营养品质的参数之一[64]。藜麦蛋白的消化率较高,利于人体消化。Mu等[11]通过研究藜麦全麦粉及藜麦分离蛋白的消化率发现后者的消化率高于藜麦全麦粉的消化率,其原因可能是藜麦全麦粉中含有更多能阻碍蛋白酶和蛋白质结合的皂苷。目前有研究发现小麦籽粒蛋白的体外消化率为45.98%~59.12%,藜麦蛋白的体外消化率为76.3%~80.5%,即藜麦蛋白的消化率高于小麦籽粒蛋白消化率[48,65]。Nasir 等[66]研究发现藜麦蛋白的消化率为75.95%~78.11%。藜麦浓缩蛋白的消化率高于藜麦分离蛋白的消化率,并且在较高的温度下预热时,消化率会降低。这可能与淀粉的存在有关,淀粉在加热到糊化温度(64.5 ℃)以上之后粘度增加,减弱了胃蛋白酶对蛋白质的作用[67]。藜麦蛋白的高消化率使其在人的胃中易于消化,从而对人体健康有益[14]。
4 藜麦蛋白的改性研究
蛋白质改性是提高蛋白质功能特性的一种重要方法[68]。通过适当的改性,能够改善藜麦蛋白的功能特性,拓展藜麦蛋白在食品工业中的应用[69]。藜麦蛋白的改性技术主要有物理改性和酶法改性,化学改性应用于藜麦蛋白改性的研究仍较少。本文介绍的两种改性方式对蛋白的负作用小,而且不易破坏藜麦蛋白的营养价值。
4.1 物理改性
物理改性主要是指通过加压、超声和加热等物理手段改变蛋白质的结构及蛋白质分子间的聚集方式,从而改变蛋白质的功能特性[70]。例如,超声可以使蛋白质部分展开,改变蛋白质的二、三级结构进而改变其功能特性[71]。Li 等[72]发现超声处理(400 W)之后,经碱性蛋白酶处理的水解产物的溶解度提高。在此过程中,α-螺旋含量减少,无规卷曲含量增多。这表明超声处理诱导蛋白展开,增多与酶接触的机会,进而提高了溶解度。Mir 等[45]通过高强度超声处理藜麦蛋白之后发现其乳化性明显提高。因为超声产生的剪切力使蛋白质的颗粒减小,比表面积增大,增强了蛋白质溶液的稳定性,此外,超声引起的空化力破坏了维持蛋白质空间结构稳定的非共价键,使蛋白质的疏水基团暴露出来,让蛋白质分子更容易扩散到油水界面,进而改善了蛋白质的乳化性[73-74]。Huang 等[75]研究发现,在水浴加热和微波处理条件下,藜麦蛋白的溶解度随温度的升高(40~90 ℃)而下降。因为热诱导使藜麦蛋白结构展开,暴露了蛋白质分子内的疏水基团,从而导致蛋白质表面极性降低,蛋白质的溶解度随表面极性的降低而下降。
4.2 酶法改性
酶法改性主要是利用酶制剂使蛋白质的氨基酸残基和多肽链发生变化,改变蛋白质的结构,从而达到改善蛋白质功能特性的目的[76]。酶法改性条件温和,副产物少。酶解蛋白一般具有较好的溶解性和界面性质,例如乳化性和起泡性。Hesam 等[77]以藜麦浓缩蛋白为原料,经胰酶水解制备了藜麦蛋白水解物,结果发现,酶解后蛋白质的溶解度提高。可能是因为藜麦蛋白分子量降低,且不溶性蛋白会产生新的可溶性多肽,所以其溶解度增加[38]。Aluko 等[78]研究发现,碱性蛋白酶水解的藜麦蛋白比藜麦浓缩蛋白的起泡能力强,可能是由于藜麦蛋白的球状特性,降低了其在气泡周围形成界面膜的能力,而酶解降低了藜麦蛋白的分子量,增加了藜麦蛋白的柔韧性,促进了气泡周围界面膜的形成和泡沫的产生。
5 总结与展望
目前,提取藜麦蛋白较常用的传统方法是碱提酸沉法和盐溶法,新方法提取藜麦蛋白的研究鲜有报道。而且对藜麦中总蛋白提取的研究较多,分级提取7S 和11S 的研究较少。由于不同蛋白组分的功能特性不同,所以分级提取不同的蛋白组分进行研究具有重要意义。藜麦蛋白营养价值和功能特性的研究处于起步阶段,有很多深入的研究机理仍较缺乏。例如藜麦蛋白的凝胶性较弱,形成的凝胶强度低且持水力差,严重限制了其在食品加工领域中的应用,但是导致其凝胶性弱的原因尚未见报道。由于较弱的凝胶性会限制藜麦蛋白在植物蛋白凝胶食品中的应用,因此如何有效调控藜麦蛋白凝胶性的机理及如何通过绿色有效的方法提高其凝胶性是未来值得探索的方向。目前国内外对藜麦蛋白改性的研究主要集中在物理改性和酶法改性方面,但是单一的改性方法限制了藜麦蛋白的应用。因此,在未来可以结合不同领域中的新方法,进一步优化蛋白的功能特性,提高蛋白的利用率,从而拓宽藜麦蛋白的应用范围。综上所述,藜麦蛋白具有丰富的营养价值,突出的功能特性,在当今健康食品和营养产业快速发展的时代背景下,其在食品中的应用将会更加广泛。
