藜麦蛋白肽的酶解制备及体外降血脂与降尿酸活性研究
2023-12-03钟婉滢苗建银叶灏铎胡一晨
钟婉滢,苗建银, ,叶灏铎,马 凤,胡一晨
(1.华南农业大学食品学院,广东省功能食品活性物重点实验室,广东广州 510642;2.农业农村部杂粮加工重点实验室,四川省杂粮产业化工程技术研究中心,食品与生物工程学院,成都大学,四川成都 610106)
高脂血症是全身性代谢综合征,患者因自身体内的低密度脂蛋白清除功能较差和低密度脂蛋白受体表达不活跃,导致体内甘油三酯、胆固醇和低密度脂蛋白指标出现异常的升高[1-2]。血脂异常与人类大多数疾病有关,包括心血管疾病和脂肪肝疾病[3]。据统计,2018 年中国国民的非高密度脂蛋白胆固醇整体水平超过了多数西方国家[4]。因此,高脂血症正逐步危害国民健康,并影响人们的生活质量。常见的降血脂药物有他汀类药物和非他汀类药物,他汀类药物会刺激血糖升高从而导致糖尿病的危害发生,而非他汀类药物的疗效不如前者[5]。研究发现,多数天然提取物能有效抑制高血脂症,如多糖[6]、蛋白质及其多肽[7]、黄酮[8]、脂肪酸[9]等,其中多肽中特有的氨基酸能影响脂类物质的代谢,阻碍后者与胆酸的作用,从而达到机体吸收脂类物质水平量下降的目的[10]。已经发现食物中蛋白质组分能调节血脂异常的情况,其降血脂效应来源于它们的肽片段和精氨酸残基的存在[11-12]。降血脂肽的活性机制主要通过破坏胶束溶解度和膳食胆固醇的吸收从而改变肝肠胆汁酸、促进胆固醇分解代谢以及调节致脂蛋白和基因的表达[13]。因此,从天然食品原料中开发安全有效的降血脂活性成分对国民的健康水平起关键作用。
藜麦(Chenopodium quinoaWilld.)属于苋菜科植物,在我国北方地区大面积推广栽种[14-15],其蛋白质含量在13.1%至16.7%之间,超过大米、大麦、玉米和黑麦的蛋白含量,其中藜麦的赖氨酸、蛋氨酸和苏氨酸含量高于常规谷物中的限制性氨基酸水平[16]。从健康角度出发,藜麦由于具有优质的蛋白质而被认为是一种功能性食品[17]。藜麦蛋白经酶水解后释放的多肽酶解物含有较高的生物活性[18-20],如抗氧化活性[21]、血管紧张素转换酶(ACE)抑制活性[22]、调节血糖[23]等。然而,藜麦蛋白肽对于降血脂和降尿酸功效的研究较少。现阶段对植物源蛋白降血脂肽的研究非常丰富[24],如燕麦多肽[25]、大豆多肽[26]等。此外,多数植物源蛋白肽具有降尿酸的效果,如茶蛋白肽[27],核桃多肽[28]。因此,藜麦蛋白肽的降血脂和降尿酸双重功效值得深入研究。
本研究利用碱提酸沉法从藜麦提取蛋白,以胰脂肪酶抑制率为响应值,根据单因素和响应面试验确定藜麦蛋白降血脂肽的最优酶解工艺条件,通过体外降血脂、降尿酸活性实验和氨基酸组成深入分析藜麦多肽的功能活性。本研究为综合利用藜麦资源,开发具有降血脂和降尿酸功效的功能性食品提供科学参考。
1 材料与方法
1.1 材料与仪器
藜麦原料(采收于2021 年10 月)来自农业农村部杂粮加工重点实验室;胰蛋白酶(25 万 U/g)、木瓜蛋白酶(20 万 U/g)、碱性蛋白酶(20 万 U/g)、胃蛋白酶(300 万 U/g)、中性蛋白酶(10 万 U/g)广西南宁庞博生物工程有限公司;黄嘌呤氧化酶(50 U/mg)、别嘌呤醇、黄嘌呤 上海麦克林生化有限公司;月桂酸-4-硝基苯酯 天津市富宇精细化工有限公司;4-硝基苯丁酸酯 西安市晶博生物科技有限公司;牛磺胆酸钠(STC)上海源叶生物科技有限公司;胰脂肪酶(来自猪胰腺)(3~9 万 U/g)上海阿拉丁生物科技公司;100 mmol/L Tris-HCl 溶液 广州亿涛生物科技有限公司;胆固醇酯酶(15 万 U/g)、Triton X-100 北京索莱宝科技有限公司;其他试剂均属于分析纯。
SC-3610 低速离心机 安徽中科中佳科学仪器有限公司;HH-1 数显恒温水浴锅 常州澳华仪器有限公司;SG-5402A 四联磁力加热搅拌器 上海硕光电子科技有限公司;PHS-3CpH 计 上海力辰邦西仪器科技公司;恒温培养箱 常州澳华仪器有限公司;2300 EnSpireTM多功能酶标仪 美国PerkinElmer公司。
1.2 实验方法
1.2.1 藜麦蛋白的提取 参考叶灏铎等[29]方法并稍作改动。将藜麦打磨后的粉末过20 目筛,以料液比1:20 加入定量的藜麦粉末和95%乙醇用于脱脂,在室温下用磁力搅拌器以1000 r/min 均匀搅拌12 h,烘干获得脱脂藜麦粉。以1:40 加入定量的脱脂藜麦粉和0.1 mol/L 的NaOH 溶液,在45 ℃恒温水浴锅中用玻璃棒不断搅拌3 h,离心获取碱提清液。加入0.1 mol/L 的HCl 溶液将上清液的pH 调为4.5,静置至再无沉淀生成后离心,收集蛋白沉淀,冷冻干燥后称重,参考杨丽娥等[30]的方法按下式计算粗蛋白得率。粗蛋白含量分析参照GB 5009.5-2016 中《食品中蛋白质的测定》的凯氏定氮法[31]。冻干蛋白放置于-20 ℃储存备用。
式中:A 为粗蛋白粉质量,mg;B 为原料总质量,mg。
1.2.2 藜麦蛋白肽的制备 加入适量水于一定量的藜麦蛋白粗提物中,根据所添加酶调节溶液相应的pH,使用恒温水浴进行酶解反应,3 h 后对反应液进行灭酶,静置冷却,以4000 r/min 下离心,20 min 后收集酶解上清液,冷冻干燥于后续实验使用。
1.2.3 蛋白酶的筛选 配制3%的藜麦蛋白溶液,以酶底比0.3%分别加入胰蛋白酶、木瓜蛋白酶、胃蛋白酶、碱性蛋白酶和中性蛋白酶,调节各自pH 为8.0、6.5、1.5、9.5 和7.0,酶解温度分别为37、55、37、55 和45 ℃,酶解时间为3 h。以胰脂肪酶抑制率为指标,挑选效果明显的蛋白酶。
1.2.4 单因素实验 参考叶灏铎等[29]方法并稍作改动。选择最优蛋白酶,考察不同因素对胰脂肪酶抑制率的影响,优化条件为:酶解时间(0.5、1、2、3、4、5 h)、pH(1.0、1.5、2.0、2.5、3.0)、酶解温度(32、37、42、47、52 ℃)、酶底比(0.1%、0.2%、0.3%、0.4%、0.5%)和底物浓度(1%、2%、3%、4%、5%)。除考察因素外,初始条件不变:底物浓度3%,酶底比为0.3%,pH1.5,酶解温度37℃。
1.2.5 响应面优化试验 采用Desigh Expert 8.0.6.1软件建立响应面试验。在最优酶解时间和酶底比的基础下,探究不同水平的pH、酶解温度和底物浓度对胰脂肪酶抑制率的影响。设计见表1。
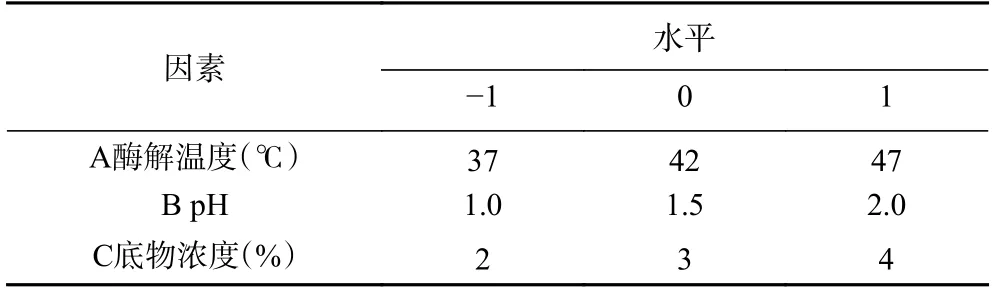
表1 响应面试验条件Table 1 Response surface experiment conditions
1.2.6 胰脂肪酶抑制率的测定 参照万林[32]的方法并作出略微改动。分别制备5 mg/mL 胰脂肪酶溶液、缓冲液(pH8.2,0.1 mol/L Tris 缓冲液)和反应底物(1% Triton X-100、5 mmol/L 醋酸钠水溶液、1 mg/mL月桂酸-4-硝基苯酯)。样品组依次加入200 μL 样品溶液、500 μL 底物溶液、400 μL 缓冲液和300 μL 脂肪酶溶液。于37 ℃培养箱静置2 h,将反应液离心收集上层清液,测定420 nm 波长下的吸光值。按下式计算并求IC50:
式中:A 为样品组吸光值;B 为无脂肪酶组的吸光值;C 为无样品组吸光值。
1.2.7 藜麦多肽降血脂活性分析
1.2.7.1 藜麦多肽抑制胰脂肪酶分析 使用磷酸缓冲溶液配制不同样品溶液浓度(10、50、100、200、500 μg/mL),测定胰脂肪酶抑制率,并计算IC50值。
1.2.7.2 藜麦多肽结合胆酸盐分析 参考李成龙[33]的方法作出略微改动。将0.01 mol/L HCl 溶液和样品溶液各取1 mL 在37 ℃反应1 h,调节pH 至6.3,加入1 mmol/L 牛磺胆酸钠(STC)标准溶液和磷酸盐缓冲液各5 mL,37 ℃反应1 h,离心取2 mL 上层清液和6 mL 60%硫酸溶液在70 ℃恒温水浴中反应30 min,随后静置冷却。于387 nm 波长处测量每组吸光度。牛磺胆酸钠溶液在不同浓度下(0、0.05、0.1、0.15、0.2、0.25 mmol/L)测定吸光度,制定胆酸盐标准曲线。以下式计算并求EC50:
式中:A 是胆酸盐加入量,μmol;B 是胆酸盐剩余量,μmol。
1.2.7.3 藜麦多肽抑制胆固醇酯酶分析 参照苏建辉等[34]的方法作出略微改动。制备4.2 μg/mL 的猪胰腺胆固醇酶溶液,将0.1 mol/L NaCl、0.2 mmol/L 4-硝基苯丁酸酯、5.16 mmol/L STC 配制成pH7.0的0.1 mol/L 磷酸钠缓冲液。以1:2.5:5:5 的比例依次加入底物溶液(4-硝基苯丁酸酯)、样品溶液、缓冲液和胆固醇酯酶溶液,在25 ℃恒温水浴锅中反应5 min,于405 nm 波长下测定每组上清液的吸光值。空白组不加样品,样品对照组不加酶液,空白对照组不加酶液和样品。按下式计算,并求IC50:
式中:A 是空白组吸光值;B 是空白对照组吸光值;C 是样品组吸光值;D 是样品对照组吸光值。
1.2.7.4 藜麦多肽抑制黄嘌呤氧化酶分析 参考叶灏铎等[27]的方法检测黄嘌呤氧化酶抑制率,并作稍微修改。使用缓冲溶液配制不同浓度的样品溶液(0.5、1、2、4、8 mg/mL)。以比例1:1:1 先后加入样品溶液、0.04 U/mL 黄嘌呤氧化酶溶液和0.48 mmol/L黄嘌呤溶液,室温条件下振荡混匀30 min,随后测定波长为290 nm 下各组分上清液的吸光值,随后计算IC50值。使用下式计算黄嘌呤氧化酶抑制作用:
式中:A 是样品组吸光值;B 是不加酶组吸光值;C 是不加样品组吸光值;D 是不加酶和样品组吸光值。
1.2.8 氨基酸组成分析 参照GB 5009.124-2016《食品中氨基酸的测定》[35]。
1.3 数据处理
使用EXCEL 2019 软件处理数据;使用SPSS 21.0 软件进行多组间差异的方差分析(单因素ANOVA检验中Duncan 法),其中,不同字母表示相同指标下的差异显著(P<0.05);部分数据使用GraphPad Prism 8 软件绘制图表。数据以平均值±标准差表示。每组实验至少重复3 次后求平均值。
2 结果与分析
2.1 藜麦蛋白的提取
根据碱提酸沉的原理,经过95%乙醇浸没的藜麦原料除去脂肪后,在碱液中提取藜麦水溶蛋白,将pH 调节到等电点4.5 后获得藜麦蛋白沉淀,冷冻干燥后的粗蛋白得率为23.90%,提取过程基本除去多糖等成分[27]。经凯氏定氮法测得粗蛋白的质量分数为55.74%,说明大部分蛋白得到有效提取。根据以上条件提取的粗蛋白用于后续实验。
2.2 单因素实验
2.2.1 最优酶选择 蛋白酶的底物专一性决定了酶解反应的作用位点,导致不同蛋白酶作用下酶解产物产生不一样的组成和特性[36]。以胰脂肪酶抑制率作为蛋白酶酶解藜麦蛋白的活性指标,选用五种不同的蛋白酶制备藜麦蛋白水解物。结果由图1 所示,与其他四种酶相比,胃蛋白酶所得藜麦蛋白多肽的胰脂肪酶抑制率最高,其胰脂肪酶抑制率可达到81.64%±0.46%,说明胃蛋白酶酶解藜麦蛋白所得肽段有较强的抑制胰脂肪酶作用。藜麦蛋白与胃消化酶系进行反应得到的酶解物,随后酶解物作用于体内靶目标才能达到降血脂的作用,因此选择胃蛋白酶体系可以模拟藜麦蛋白与胃消化酶系的反应[37-38]。后续将使用胃蛋白酶作为工具酶进行酶解工艺优化试验。

图1 不同蛋白酶对胰脂肪酶抑制率影响Fig.1 Effect of different proteases on the inhibition rate of pancreatic lipase
2.2.2 酶解时间对藜麦蛋白酶解物抑制效果的影响由图2 可知,酶解时间的增加会导致酶解物的胰脂肪酶抑制率先上升后下降,酶解1 h 的抑制率达到最大值85.13%±0.83%,反应1 h 后酶活性逐步降低。这可能是因为酶在反应初始阶段酶活力较高,与藜麦蛋白的酶切位点较多,获得的多肽对脂肪酶的抑制效果最佳,而酶解时间越长会导致多肽的活性结构逐步被破坏水解成游离的氨基酸,降低抑制脂肪酶的活性[39]。因此,选择酶解时间为1 h 进行下一步酶解工艺优化试验。

图2 酶解时间对胰脂肪酶抑制率影响Fig.2 Effect of enzymolysis time on the inhibition rate of pancreatic lipase
2.2.3 pH 对藜麦蛋白酶解物抑制效果的影响 由图3 所示,胰脂肪酶抑制率随pH 的增加呈先升高后降低的趋势,当pH 为1~1.5 时胰脂肪酶抑制率缓慢增加(P>0.05),增加至pH2 呈现显著性下降(P<0.05),随后继续增大pH 呈现缓慢下降(P>0.05),其中,在pH1.5 时得到最大值为81.29%±2.02%。胃蛋白酶的最佳酶活力在1.0~2.0 之间,低于或超出该范围下的pH 会影响酶的三维结构,导致抑制胰脂肪酶的活性下降[40]。因此,后续将选择pH1、1.5 和2 进行响应面优化。

图3 pH 对胰脂肪酶抑制率影响Fig.3 Effect of pH on the inhibition rate of pancreatic lipase
2.2.4 酶解温度对藜麦蛋白酶解物抑制效果的影响如图4 所示,随着酶解温度的变化,多肽酶解物抑制胰脂肪酶的活性先上升后下降(P<0.05)。当酶解温度达到42 ℃时,酶解物的胰脂肪酶抑制率为87.77%±1.73%并达到最高值。胃蛋白酶在最适合的温度下发挥最大的活性效果,加速分子热运动使溶剂渗透和溶质扩散,因此藜麦蛋白得到充分的酶解,获得的酶解物多肽的活性更好[41]。此外,超过最适酶解温度的范围时蛋白酶可能因变性而失去了酶活力,酶解得到多肽的数量下降,导致酶解物抑制胰脂肪酶抑制率的活性也下降[42]。高佩佩[43]的研究中有类似报道,牛乳酪蛋白在不同温度下进行酶解,当酶解温度达到40 ℃时胰脂肪酶抑制率达到最大值。因此,选择37、42 和47 ℃进行下一步的响应面优化。

图4 酶解温度对胰脂肪酶抑制率影响Fig.4 Effect of enzymolysis temperature on the inhibition rate of pancreatic lipase
2.2.5 酶底比对藜麦蛋白酶解物抑制效果的影响由图5 可得知,酶底比含量越高,酶解物抑制胰脂肪酶抑制率水平先增大后减少(P<0.05),其中酶底比为0.2%时的抑制率达到最大值85.85%±2.89%,与李瑞霞等[44]的实验结果一致。当酶底比少于0.2%时,酶解反应未饱和,藜麦蛋白得不到充分的酶解;当酶底比大于0.2%后,胃蛋白酶和藜麦蛋白酶解反应过饱和,多余的酶和底物形成物料浪费[45]。因此,将选0.2%的酶底比作为后续的酶解工艺优化试验。

图5 酶底比对胰脂肪酶抑制率影响Fig.5 Effect of enzyme to substrate ratio on inhibition rate of pancreatic lipase
2.2.6 底物浓度对藜麦蛋白酶解物抑制效果的影响如图6 所示,胰脂肪酶抑制率随底物浓度的增加呈显著上升趋势(P<0.05),在3%达到最大值81.53%±1.53%后逐渐下降,在4%后趋于平衡(P>0.05)。随着底物浓度的增加,酶促反应速率先提升后下降,这可能是因为当底物浓度超过最适合的范围,会导致多肽的反应位点受阻,并且底物之间发生相互作用从而降低抑制活性。此外,底物与胃蛋白酶已经发生完全反应,酶促反应受到限制[46]。因此,后续将选择底物浓度为2%、3%和4%进行响应面优化。

图6 底物浓度对胰脂肪酶抑制率影响Fig.6 Effect of substrate concentration on the inhibition rate of pancreatic lipase
2.3 响应面优化试验
通过单因素实验确定因素水平的范围,响应面拟合方程只在狭窄区域内近似真实情况,因此需先从单因素实验结果获取最佳值区域后才能建立有效的响应面拟合方程[47]。根据单因素实验结果,选择最佳水平中有显著性差异的因素进行优化,自变量分别为酶解温度、pH 和底物浓度,以胰脂肪酶抑制率为评价指数,设计3 因素3 水平实验表(见表2)。
根据表2 的响应面结果进行多元回归拟合,获得酶解温度(A)、pH(B)和底物浓度(C)与胰脂肪酶抑制率(Y)三个因素的二次多项回归方程:
Y=90.2+1.23A+1.63B+0.41C+1.31AB-0.16AC-0.98BC-4A2-6.13B2-4.66C2
显著性检验表3 中的F值和P值可以反映胰脂肪酶抑制率与每个因素之间的关联性和显著性,F值的高低反映各因素对实验模型的影响效果[48]。验证回归模型及方程的显著性,结果显示F值=25.65,P值=0.0002<0.01,表明设计模型具有极显著差异,试验办法可信赖度高[49]。在回归方程中,一次项B 和二次项A2、B2和C2表明差异极显著(P<0.01),一次项A 表明差异显著(P<0.05),一次项C 和交互项的差异不显著(P>0.05),说明酶解温度和pH 对酶解反应有显著影响,但底物浓度和交互作用的酶解作用不明显。回归模型中F(A)=6.97,F(B)=12.39,F(C)=0.77,据此表明影响胰脂肪酶抑制率的三种因素顺序为pH>酶解温度>底物浓度。其中模型的失拟项F值为3.38,P值为0.1353>0.05,差异不显著表明建立的回归模型受到实验操作等偶然因素的影响较小,变异系数CV 值=1.58%<10%,实验结果可信赖度高[41]。以上结果表明所建立的响应面实验具有可靠性,模型的拟合度较高[50],符合藜麦蛋白酶解物在不同实验条件下的变化规律,从而获得胰脂肪酶抑制率较高下的最优藜麦蛋白酶解条件。

表3 方差分析Table 3 Variance analysis
相应等高线图与曲面图能反映A、B 或C 三者中的两个因素之间的相互作用效果[51]。如图7 所示,酶解温度、pH 和底物浓度的交互作用对胰脂肪酶抑制率的影响先上升后下降,存在一定范围内的最大值。在一定的底物浓度下,随着pH 和酶解温度的变化,途中响应面中部曲线聚集效果明显,说明藜麦蛋白酶解物抑制胰脂肪酶实验模型主要由pH和酶解温度的影响,与表3 中方差分析结果一致。
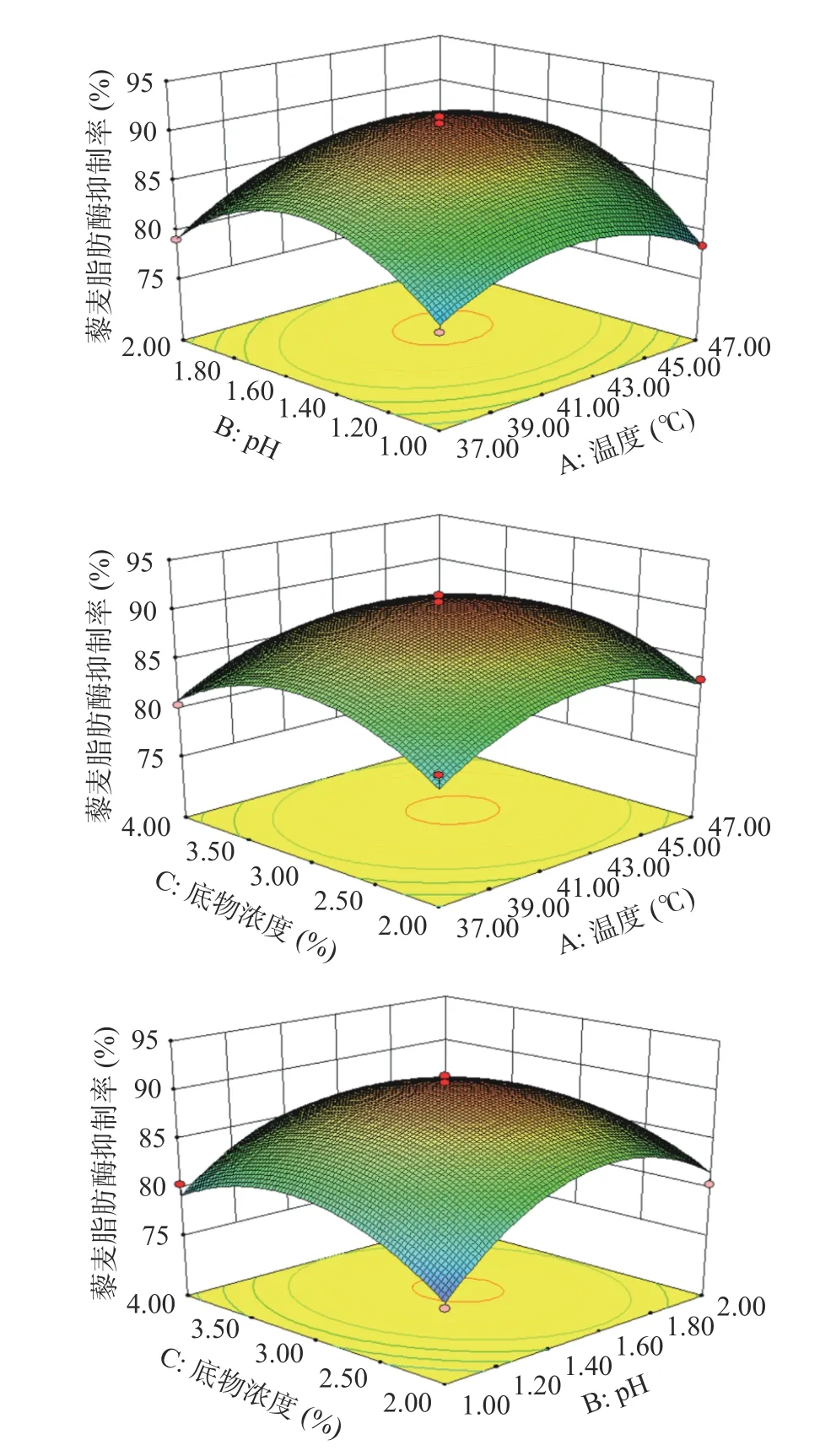
图7 酶解温度、pH 和底物浓度对胰脂肪酶抑制率影响的响应面Fig.7 Response surface of the effect of temperature,pH,and substrate concentration on the inhibition rate of pancreatic lipase
综合考虑酶解温度、pH 和底物浓度对胰脂肪酶抑制率的影响,获得藜麦降血脂肽的最佳制备工艺为酶解温度42.88 ℃、pH1.57、底物浓度3.03%、酶解时间1 h 和酶底比0.2%,考虑到实际操作,酶解工艺优化为:酶解温度42.9 ℃、pH1.6、底物浓度3.03%、时间1 h 和酶底比0.2%。此时藜麦多肽对胰脂肪酶抑制率为90.43%。对预测的最佳条件进行实验验证,得到的藜麦降血脂肽与胰脂肪酶的实际抑制率为90.93%±0.10%,与预测结果值相当接近。
2.4 藜麦多肽活性分析
2.4.1 藜麦多肽对胰脂肪酶的抑制作用 当机体摄入高脂肪食物后,脂肪不能直接吸收,而是通过胰脂肪酶的作用水解得到脂肪酸和3-单酰基甘油酯,进而与胆汁盐类混合,以胶粒状进入肠道的脂质细胞和上皮细胞膜的顶部[52]。降低脂肪酶的水解效果可影响肠道对脂肪的同化[53]。如图8 所示,随着藜麦多肽浓度的增加,对胰脂肪酶的抑制作用呈上升趋势。500 μg/mL 时获得最高值62.53%±0.11%(P<0.05),并且IC50是7.49 μg/mL(表4)。刘晓静[54]用响应面优化亚麻籽蛋白的酶解工艺并进行分级制备,测得≤1 kDa 的亚麻籽肽的胰脂肪酶抑制作用的IC50为6.20 mg/mL。霍世欣等[55]使用聚酰胺柱色谱分离法获得荷叶的黄酮提取物,检测提取物的胰脂肪酶抑制作用IC50为0.0076 mg/mL。王建成等[56]将红松仁蛋白酶解物超滤得到5 种分子质量不同的组分,其中1~5 kDa 组分的胰脂肪酶抑制作用最强(IC50=194.43 μg/mL)。此外,藜麦多肽能抑制胰脂肪酶的活性,推测藜麦多肽影响胰脂肪酶的结构变化,导致胰脂肪酶对底物的分解作用受阻,达到降血脂功效[57]。综上所述,藜麦多肽还没有经过进一步分离纯化就具有较强的胰脂肪酶抑制作用,后续实验通过筛选将获得胰脂肪酶抑制作用更好的单体。

图8 最佳酶解物对胰脂肪酶抑制率的影响Fig.8 Effect of optimal enzymatic hydrolysate on the inhibition rate of pancreatic lipase

表4 藜麦多肽活性评价Table 4 Evaluation of peptides activity in quinoa
2.4.2 藜麦多肽对胆酸盐的结合能力 胆固醇经过体内代谢分解成胆酸盐,肝肠中胆酸盐含量下降可促进胆固醇的分解代谢,肠道吸收胆固醇的能力下降,进而促进降血脂的功效[58-59]。如图9 所示,在0.1~2 mg/mL 范围内,牛磺胆酸钠结合率随浓度的增加而呈现递增的趋势。藜麦多肽浓度为2 mg/mL 时,牛磺胆酸钠结合率达到最大值76.95%±0.37%(P<0.05),通过SPSS 软件分析EC50值为0.53 mg/mL(表4)。姜欣洋等[60]用50%的乙醇提取补骨脂,测定提取物的牛磺胆酸钠结合作用,EC50达到1.26 mg/mL。宋玲钰[61]对花生蛋白的酶解工艺进行优化,花生蛋白酶解物在10 mg/mL 下牛磺胆酸盐抑制率为55.47%。结合相关研究可知,藜麦多肽的胆酸盐结合能力较强,这可能是因为藜麦多肽与胆酸盐结合能力显示藜麦多肽可以发挥降血脂的可能性,通过阻碍胆酸盐进入肠道,使胆酸盐随排泄物排出,使胆固醇分解成胆酸盐的水平下降,实现降血脂的效果[58]。

图9 最佳酶解物对牛磺胆酸钠结合率的影响Fig.9 Effect of optimal enzymatic hydrolysate on the binding rate of sodium taurocholate
2.4.3 藜麦多肽抑制胆固醇酯酶分析 胆固醇酯酶水解胆固醇酯从而获得两种生成物(胆固醇和脂肪酸),胆固醇溶于胆固醇胶束后才会被人体吸收,因此抑制胆固醇酯酶的活性是降低胆固醇的吸收的有效方法[54]。如图10 所示,一定浓度范围内,藜麦多肽对抑制胆固醇酯酶作用呈现显著上升的趋势。在2 μg/mL 时胆固醇酯酶抑制率达到最高值41.18%±0.20%(P<0.05),活性比香菇多酚[62](5 mg/mL 下达到40.11%)明显。其中,藜麦多肽对胆固醇酯酶抑制作用的IC50为4.73 mg/mL(表4),与六堡茶茶褐素[53](IC50=57.2 mg/mL)和石榴皮多糖[63](IC50=25.00 mg/mL)相比,藜麦多肽的胆固醇酯酶抑制作用更强。这说明藜麦多肽具有良好的抑制胆固醇酯酶活性,推测藜麦蛋白经胃蛋白酶作用获得的酸性多肽和胆固醇酯酶结合从而降低对底物的催化作用[64-65]。综上所述,藜麦多肽是具有降血脂功能的潜在天然活性肽。
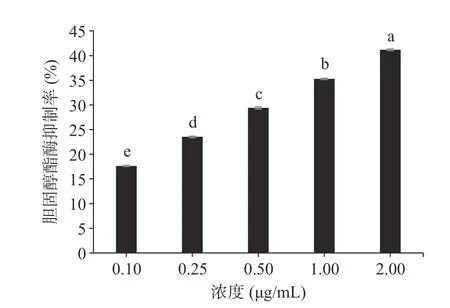
图10 最佳酶解物对胆固醇酯酶抑制率的影响Fig.10 Effect of the optimal enzymatic solution on the inhibition rate of cholesterol esterase
2.4.4 藜麦多肽的降尿酸活性分析 黄嘌呤酶会促进体内嘌呤代谢,使次黄嘌呤变成黄嘌呤,从而氧化得到尿酸、嘧啶和嘌呤等代谢物质,尿酸在体内累积过多会导致通风或肾结石等症状[27]。因此,抑制黄嘌呤氧化酶的催化作用,可以降低尿酸积累[66]。如图11所示,当藜麦蛋白酶解物的浓度处于8 mg/mL 时,黄嘌呤氧化酶抑制效果高达67.96%±0.90%(P<0.05)。利用SPSS 软件分析IC50值为5.97 mg/mL,比鲣鱼合成肽(ACECD)(IC50=7.23 mg/mL)的抑制效果更好[67]。此外,詹苏泓等[68]将远东拟沙丁鱼蛋白经超滤得到分子质量小于1000 kDa 的酶解物组分,其IC50达到15.89 g/L。实验结果表明,在最优酶解条件下的藜麦降血脂肽也兼具潜在的降尿酸活性。

图11 最佳酶解物对黄嘌呤氧化酶抑制率的影响Fig.11 Effect of optimal enzymatic hydrolyzates on xanthine oxidase inhibition rate
2.5 氨基酸组成分析
藜麦多肽的氨基酸组成如表5 所示,多肽混合物中谷氨酸占比最高(19.85%),其次为精氨酸和天冬氨酸,含量分别为10.80%和9.58%,研究表明精氨酸在体内促进一氧化氮生产增加血流量,从而降低体内低密度脂蛋白胆固醇水平[69]。必需氨基酸的含量占总氨基酸的34.23%,接近WHO/FAO 所倡议的36%必需氨基酸值,必需氨基酸的占比越高,说明藜麦蛋白的营养价值越高[70]。酸性氨基酸含量的比例为31.66%,对降血脂活性有积极的作用[71]。疏水性氨基酸的比例为34.11%,研究表明活性肽中含有高比例的疏水性氨基酸有助于降血脂作用[72]。宋淑敏等[73]发现汉麻降脂肽的5 个肽段都有较高含量的疏水性氨基酸,与结合胆酸盐的活性可能有密切关系。高含量的疏水性氨基酸对胆汁酸结合的效果发挥重要的作用,疏水性氨基酸通过疏水相互作用与胆汁酸结合,生成不溶物排出[33,74]。此外,郑睿[75]从亚麻籽中获得胆固醇溶解度抑制率最高的4 个肽,其氨基酸序列都具有大量疏水性氨基酸。还有研究指出疏水性氨基酸的含量越大,更有利于侵入脂质胶束中[76]。在降尿酸活性上,李宇娟[77]将鲣鱼分离纯化得到降尿酸肽,推测多肽发挥降尿酸作用是因为高比例的疏水性氨基酸能和黄嘌呤氧化酶结合,从而抑制酶活性。结合以上研究,经过最优酶解工艺的藜麦蛋白活性肽含有丰富的氨基酸,有降血脂和降尿酸的能力。

表5 藜麦多肽的氨基酸组成Table 5 Amino acid composition of quinoa peptides
3 结论
本研究以藜麦为原料,碱提酸沉法获取藜麦蛋白,利用胰脂肪酶抑制率评价藜麦蛋白酶解物单因素和响应面试验中的最优工艺参数:酶解温度42.9 ℃、pH1.6、底物浓度3.03%、酶解时间1 h 和酶底比0.2%,此条件下获得的胰脂肪酶抑制率为90.93%±0.10%。初步验证了藜麦多肽的降血脂和降尿酸活性,结果表明藜麦多肽具有很强的胰脂肪酶抑制作用、牛磺胆酸钠结合作用、胆固醇酯酶抑制作用和黄嘌呤氧化酶抑制作用。氨基酸分析表明,藜麦蛋白肽中高比例的必需氨基酸、疏水性氨基酸和酸性氨基酸对活性有一定影响。本研究可提高藜麦的利用价值,同时为藜麦蛋白肽的研究提供新思路。实验仅从体外实验研究藜麦多肽的降血脂和降尿酸活性,后续将会对高活性肽组分进行纯化鉴定,测定体内降血脂和降血压活性,并深入探究具体的作用机制。
