植物三萜皂苷调控昆虫抗性及其生物合成调控的研究进展
2023-12-02潘磊黄蕊闫乐乐曾文芳鲁振华段文宜孙世航崔国朝牛良王志强
潘磊 黄蕊 闫乐乐 曾文芳 鲁振华 段文宜 孙世航 崔国朝 牛良 王志强


摘要:植物生长过程中,时刻面对植食性昆虫的威胁,如营养生长以及生殖生长、叶子和嫩枝。昆虫对于寄主植物的直接伤害来自对寄主植物取食,分为吸取植物汁液和咀嚼植物组织2种方式。此外,昆虫取食会对植物造成多种疾病,从而导致间接植物受损。为应对昆虫的攻击,植物会产生一些生物活性化合物(包括三萜皂苷),以增强它们对食草昆虫的防御能力。萜类是植物代谢物中种类最多的一类,在植物生长和发育中,它们被广泛用于维持各种基本功能,很多数萜类化合物,如三萜皂苷,在植物应对非生物和生物胁迫过程中行使特定的保护作用。本文阐述了植物中三萜皂苷代谢产物在抵御昆虫危害过程中的最重要功能,并概述了对三萜皂苷类代谢途径、调节和多样化理解的最新进展。因此,植物生物活性化合物的研究有助于不同生态系统中的害虫综合治理。
关键词:害虫;三萜皂苷;植物防御;生物合成;调控;研究进展
中图分类号:S433.1文献标志码:A
文章编号:1002-1302(2023)20-0001-08
害虫取食严重威胁着作物生产,每年虫害导致的粮食作物减产高达总产量的30%[1]。植食性昆虫通过吮吸汁液、咀嚼取食或钻入作物营养器官等不同方式对寄主植物造成伤害,化学杀虫剂被广泛使用以控制农作物害虫。但化学杀虫剂降解慢、毒性高,并会对有害昆虫天敌和传粉昆虫造成毒害[2];因其对非目标生物、环境和人类健康的巨大潜在风险,许多剧毒的化学杀虫剂已被禁用。寻找植物来源的次生代谢产物是生物农药开发、健康和可持续农业的一个重要手段。植物能够产生许多次级代谢产物,包括生物碱、糖苷、萜类化合物、皂苷和类固醇[3],其中,许多天然产物可帮助植物应对植食性昆虫或自然界的病原体[4]。三萜皂苷是植物来源一类重要次级代谢产物,其化学结构特征为三萜或甾体苷元和一个或多个糖链,见图1[3]。它们是人类重要的药物、香料物质和化妆品添加剂的来源[5]。同时,由于三萜皂苷对细菌、真菌和昆虫的抗性特性,这些物质通常被认为在植物防御中发挥重要作用[6]。本研究对三萜皂苷化合物介导的植食性昆虫抗性的特性的影响进行了综述,并对三萜皂苷的生物合成途径、抗虫机制、化合物种类多样性、转录调控、关键调控基因特征规律的研究现状进行了归纳与总结,以期为未来植物抗虫机制研究、生物农药的研发及害虫的绿色防控提供一定的借鉴作用和理论指导。
1 植物三萜皂苷调控植食性昆虫抗性的研究进展
植物体内合成的具有驱虫或杀虫活性的次生代谢物多是萜类化合物,其次是生物碱和酚类化合物,酰基糖和氰苷的报道较少,但也很重要[7]。植物界中萜类化合物种类众多,是许多植物生长发育过程的基础,从小分子挥发物(如单萜和倍半萜)到激素(如细胞分裂素、脫落酸、赤霉素)和细胞结构成分如色素(如类胡萝卜素)都属于萜类。所有萜类化合物均来源于相同的异戊二烯五碳结构单元:异戊烯基焦磷酸(isopentenyl diphosphate,IPP)和其异构体二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)。根据五碳结构单元的组成数目,萜类化合物可分为挥发性单萜(C10)、倍半萜(C15),非挥发性二萜(C20)、三萜(C30)、四萜(C40)和多萜(>C40)等类型[8]。众多研究表明,植物中单萜、二萜和三萜在应对昆虫威胁时发挥了重要作用,但萜类化学物介导昆虫抗性的例子更多来源于三萜皂苷。
三萜类化合物因其在植物中作为植物激素(如油菜甾醇)的调节作用而广为人知,此外,它还是重要的化学防御物质。如葫芦科植物中常见的三萜类次生代谢物葫芦素影响了寄主植物昆虫的抗性,葫芦含有的三萜葫芦素C使其拥有了对蜘蛛螨的抗性[9]。三萜皂苷是糖基化的三萜化合物,易溶于水,广泛参与植物对植物性昆虫的防御过程[6]。通过在人工饲料添加的方式证实,甾体皂苷(luciamin)对麦蚜有毒性,导致蚜虫的存活率不断下降,是第一种被证实具有杀虫功效的皂苷[10]。皂荚树种提取的皂苷能够抑制摄食,以干扰害虫发育,并对甲虫幼虫和蚜虫若虫产生毒性作用,以皂苷处理过的叶片为食的幼虫表现出食物消耗较少和死亡率高[11]。韭菜蛾是韭菜、洋葱和大蒜等蔬菜作物的重要害虫,研究发现从大葱干花和叶中分离出的化合物对韭菜蛾生长和发育具有不利影响,该活性化合物被分类为甾体皂苷[12]。十字花科植物山芥(Barbarea vulgaris)对跳蚤甲虫(Phylloreta nemorum)和小菜蛾(Plutella xylostella)具有良好的抗性,研究表明,常春藤皂苷(hederagenin)是调控山芥跳蚤甲虫和小菜蛾抗性的主要原因,皂苷的杀虫行为取决于苷元结构和糖链的存在,常春藤苷元上糖链部分的去除导致抗虫生物活性损失[13-15]。草地贪夜蛾幼虫又称秋黏虫,是一种起源于美洲的农业重大害虫,破坏性极强,许多研究均报道了皂苷对该害虫的杀虫作用[16]。夜香木(Cestrum nocturnum)属茄科植物,原产地为热带美洲及西印度,夜间开花、花期持久、具有香气,是一种观赏植物。该植物叶片中皂苷提取物对一些昆虫,如草地贪夜蛾和杂拟谷盗(Tribolium confusum)具有毒性,这种毒性可能是由皂苷的细胞毒性作用所致,组织学研究表明皂苷的作用位置在昆虫的脂肪体和肠道[17]。油茶是食用油的来源之一,这种油富含多种皂苷活性成分。茶皂素(tea saponin)是从茶树种子中提取的,研究发现,茶皂素对小菜蛾幼虫和蚜虫具有杀虫活性[18]。茶叶是中国最重要的经济作物之一,茶尺蠖是茶叶种植中的重要害虫,对茶树造成严重损害,降低了茶叶产量和质量。研究表明,茶皂素对鳞翅目害虫具有良好的杀虫活性[19]。
2 植物三萜皂苷的生物合成过程
萜类生物合成的异戊二烯五碳结构单元异戊烯基焦磷酸(isopentenyl pyrophosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl pyrophosphate,DMAPP)均来源于甲羟戊酸(mevalonate,MVA)途径和质体中的2-C-甲基-D-赤藓醇-4-磷酸(2-C-methl-D-erythritol-4-phospate,MEP)途径。MVA途径包括6个酶促步骤,涉及乙酰辅酶A 酰基转移酶(acetyl-CoA C-acetyltransferase,AACT)、羟甲基戊二酰辅酶A合酶(3-hydroxy-3-methylglutaryl-CoA synthase,HMGS)、羟甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl-CoA reductase,HMGR)、甲羟戊酸激酶(MVA kinase,MVK)、二氧磷基甲羟戊酸激酶(phospho-MVA kinase,PMK)和甲羟戊酸焦磷酸脱羧酶(diphospho-MVA decarboxylase,MPDC)[20]。MVA途径将乙酰辅酶A转化为IPP,该途径定位在细胞质[21]。MEP途径包括7个酶促步骤:1-脱氧-D-木酮糖-5-磷酸合成酶(1-deoxy-D-xylulose 5-phosphate synthase,DXS)、1-脱氧-D-木酮糖-5-磷酸还原异构酶(1-deoxy-D-xylulose 5-phosphate reductoisomerase,DXR)、2-C-甲基-d-赤藓糖醇4-磷酸胞苷酰转移酶(2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase,MCT)、4-二磷酸胞苷-2-C-甲基-D-赤藓糖激酶(4-cytidine 5-diphospho-2-C-methyl-D-erythritol kinase,CMK)、2-甲基赤藓糖-2,4-环二磷酸合酶(2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase,MDS)、1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸合酶(4-hydroxy-3-methylbut-2-enyl-diphosphate synthase,HDS)和1-羟基-2-甲基-2-(E)-丁烯基-4-二磷酸还原酶(4-hydroxy-3-methylbut-2-enyl diphosphate reductase,HDR)[22]。该途径始于丙酮酸和甘油醛-3-磷酸,同样终于IPP和DMAPP[20]。
MVA途径形成的IPP和DMAPP主要用于倍半萜、多萜、植物甾醇、油菜甾醇和三萜的合成,MEP途径的IPP和DMAPP优先用于半萜、单萜、双萜、倍萜、四萜(类胡萝卜素等)、植物激素如细胞分裂素、赤霉素的生成[20]。尽管MVA和MEP途径在不同的亚细胞区域中独立运行,但2种通路之间的代谢串扰[23]。而后异戊二烯前体在萜类合酶(terpene synthase,TPS)的作用下产生了一系列结构多样的线性或环状萜类。TPS由一个中等大小的基因家族编码,通常有30~100个成员[24]。已知半萜(C5)、单萜(C10)、倍半萜(C15)、二萜(C20)和二倍半萜(C25)是由Ⅰ类和Ⅱ类TPS催化合成,但大多数三萜(C30)和四萜(C40)仅由Ⅱ类TPS体催化合成。基于序列相关性和功能评估,植物TPS家族被划分为TPSa、TPSb、TPSc、TPSd、TPSe/f、TPSg、TPSh等7个分支。Ⅰ类TPS包括TPS-a、TPS-b、TPS-d、TPS-e/f,而Ⅱ类TPS仅包含TPS-c[25]。
由图2可知,三萜是以6个异戊二烯单元为碳骨架的C30化合物,源自MVA途径的2个法尼基焦磷酸(isoprenoids farnesyl diphosphate,FPP)分子在角鲨烯合成酶(squalene synthase,SQS)催化的反应中“头对头”融合,生成线性C30三萜前体角鲨烯。随后,由角鲨烯通过角鲨烯环氧化物酶(squalene epoxidase,SQE)从角鲨烯形成2,3-氧化鲨烯,其在氧化鲨烯环化酶(oxidosqualene cyclases,OSC)、三萜合酶(tTPS)作用下环化为四环或五环萜类骨架结构[26]。如,拟南芥基因组包含13个编码OSC的基因,水稻基因组有12个OSC基因,可产生不同的三萜骨架[27]。随后,简单三萜骨架通常被CYP450酶(cytochrome P450)修饰(如,引入羟基、酮、醛、羧基或环氧基)以形成更多样的分子,其进一步可被尿苷二磷酸(UDP)-葡萄糖基转移酶(UDP-glucuronosyltransferases,UGT)作用以形成三萜皂苷[27]。
3 植物萜类和皂苷种类多样性的来源
虽然植物中的三萜种类繁多,但其对应的三萜骨架仅有100多种,OSC催化这一过程[28]。随后,CYP450催化了三萜骨架的多种官能团修饰,如羟基、羰基、羧基和环氧基等,这是导致三萜结构多样性的第二来源[27]。最后,通过UGT将三萜苷元糖基化为三萜皂苷,是导致三萜皂苷结构多样性的第3个因素[27]。综合而言,OSC、CYP450和UGT共同决定着三萜皂苷的结构多样性。
萜类合成途径中,2,3-环氧角鲨烯在氧化鲨烯环化酶(OSC)催化下环化合成了多种三萜骨架。高等植物的基因组包含9~16个OSC基因,如拟南芥基因组中就含有13个OSC基因,分别控制了13种三萜骨架的产生[29]。CYP450是植物中最大的基因家族,家族成员数量可达整个基因组1%以上。到目前为止,CYP51家族(成员为CYP51H)、CYP71家族(成员为CYP71A/D、CYP81Q、CYP93E和CYP705A)、CYP72家族(成员为CYP72A)和CYP85[JP+1]家族(成员分别为CYP87D、CYP88D/L、CYP708A和CYP716A/C/E/S/U/Y)与三萜结构修饰相关[30]。糖基化是三萜皂苷生物合成的最后一步,通过UGT将一个或多个亲水性糖部分与疏水性苷元连接。三萜皂苷糖基化模式通常在C-3和/或 C-28 位连接糖链。植物中UGT的数量巨大,解码参与目标三萜皂苷生物合成的特定UGT非常困难。到目前为止,仅有23个UGT参与了三萜皂苷的生物合成。它们被分为8个家族,即UGT71、UGT72、UGT75、UGT79、UGT82、UGT93、UGT94和UGT709[31]。
4 植物萜类代谢中的代谢合成基因在染色体中的簇状分布
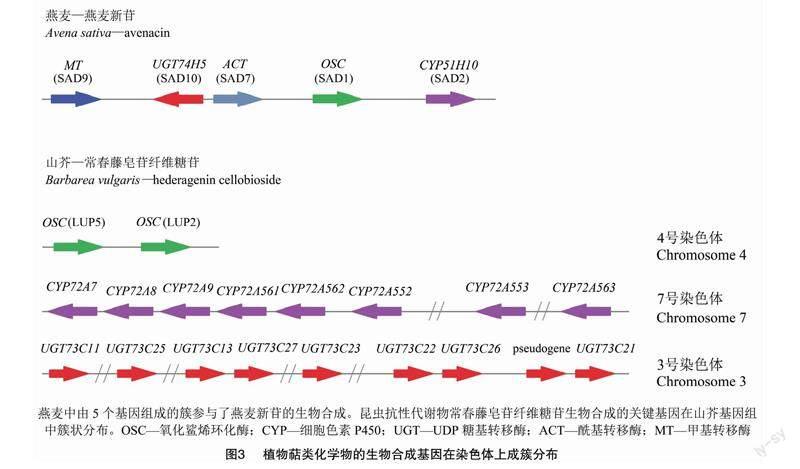
植物次生代谢中生物合成基因在基因组上呈基因簇分布是植物代谢研究中的重要发现,它不仅加快了生物合成途徑的阐明过程,而且为目标代谢产物的代谢工程铺平了道路。[JP+1]研究表明,萜类和皂苷生物合成中也存在类似现象。燕麦是唯一已知的产生三萜皂苷的单子叶植物。由图3可知,燕麦属植物在植物根中积累燕麦新苷(avenacins),为植物提供了抵御土壤传播真菌的有效屏障。SAD1是一种β-香树素合成酶(β-amyrin synthase),催化燕麦新苷生物合成的第一步,并以基因簇的形式存在于燕麦基因组中,与编码燕麦新苷生物合成所需的调节酶的基因一起存在,包括SAD2、CYP51H10,及3个在燕麦新苷酰化步骤中共同作用的基因:SAD9(一种甲基转移酶基因)、SAD10(UGT74H5糖基转移酶基因)和SAD7(一种丝氨酸羧肽酶样酰基转移酶基因)[32]。在山芥抵抗跳蚤甲虫和小菜蛾的举例中,调节齐墩果酸纤维糖苷合成2个OSC(即LUP2和LUP5),8个CYP450串联重复序列和至少5个UGT73C的串联重复也是以基因簇的形式分别存在于山芥4号染色体、7号染色体和3号染色体上,体外和植物试验表明,LUP5优先在抗虫的G型山芥中表达,LUP5介导了抗性皂苷齐墩果酸纤维糖苷前体的积累[15]。在7号染色体的8个CYP72A中,仅有CYP72A552对应的酶类在C23位置氧化齐墩果酸,介导抗虫皂苷的形成[15]。UGT73C串联重复序列的所有成员都以常春藤苷元和齐墩果酸作为底物进行催化,进而形成多种皂苷[33]。
5 植物萜类和皂苷的转录调控
特异萜类的生物合成可能是植物组织和发育阶段特有的,也可能是对各种生物和非生物胁迫的应激反应。萜类化合物在植物体内的组织特异性和诱导合成主要是在转录水平上受到了转录因子(transcription factor,TF)的调节[34]。转录因子是DNA结合蛋白,可识别和结合靶基因启动子中的特定调控序列,即所谓的顺式元件,从而调节转录表达水平[35]。根据其DNA结合域可将转录因子分为不同的家族,在植物基因组中至少有64个转录因子家族[36]。通过操纵单个转录因子的表达,有可能影响几个协同调节的生物合成基因的表达,从而增加代谢产物的产量[37]。目前,研究人员已经阐明WRKY转录因子、MYB转录因子、bHLH转录因子、AP2/ERF转录因子、JRE转录因子、bZIP转录因子、和SPL转录因子在特殊萜类生物合成中发挥的调节作用。研究发现 WRKY转录因子参与倍半萜类 (如青蒿中的青蒿素、棉花中的棉酚、烟草中的辣椒二醇)、二萜类化合物(如水稻中稻壳酮 A、红豆杉中的紫杉醇、丹参中的丹参酮)及三萜类化合物(如西洋参中的人参皂苷和睡莲中的睡茄内酯)的生物合成调控[38-47]。通常认为MYB 转录因子可以调节苯丙类化合物的生物合成,但也有少量报道表明,萜类化合物和苯丙类生物合成途径均受MYB 转录因子调节。火炬松的PtMYB4和葡萄的VvMYB5b MYB转录因子同时影响萜类化合物和苯丙类化合物的积累。丹参中的SmMYB36转录因子能够抑制酚酸生物合成并促进萜类物质丹参酮生物合成[48]。近期研究发现,bHLH类转录因子TSAR1和TSAR2作为合成激活调节器,调节着苜蓿中三萜皂苷类物质的生物合成[49]。已有研究证实,青蒿中的AaERF1和AaERF2转录因子调控了倍半萜类生物合成[50],丹参中SmERF128调控了二萜类化合物丹参酮生物合成过程[51]。柑橘中AP2/ERF 转录因子(CitERF71)最近被证明可以调节TPS16的表达,从而控制柑橘类水果中E-桂醇的产生[52]。在青蒿中,bZIP转录因子HY5与TPS基因QH6的启动子相互作用,调节其表达水平[53]。青蒿中的AaSPL2转录因子介导青蒿素醛-11还原酶(DBR2)的转录激活,从而提高青蒿素含量[54]。
6 植物萜类或皂苷的生物合成平台
除了在植物与环境相互影响中起关键作用外,皂苷类化合物还因其广泛的商业和药用用途而具有巨大价值。但其在植物组织中通常含量很低,提取分离困难,结构复杂难以人工合成[55],因此在天然宿主植物或异源植物/微生物平台中设计靶向皂苷化合物的途径,不仅能够提高目标皂苷的产量,还能有助于了解皂苷的生物合成调控。
大肠杆菌和酵母菌一直是萜类和皂苷生产的首选平台,具有生长速度快、原料廉价、易于遗传和代谢控制等优点。目前,大肠杆菌已被广泛用于生产萜类和皂苷化合物,包括异戊二烯单萜类(如芳樟醇)、倍半萜类(如β-法尼烯)、二萜类(如紫杉二烯)和四萜类(如番茄红素)[56-57]等。尽管如此,由于植物CYP450的膜定位特性,大肠杆菌中进行萜类和皂苷生产仍具有巨大挑战。相反,所有萜类化合物均在酵母有过成功的生物合成范例,包括单萜、倍半萜、二萜、三萜和四萜。青蒿素酸是抗疟药物青蒿素的直接前体,其生产是酵母菌中合成萜类最著名的范例,目前,酵母中青蒿素酸的产量已达到25 g/L[58-60]。酵母是一种真核生物,在构建由植物来源的CYP450 组成的复杂萜类途径方面,酵母比大肠杆菌具有优势[59]。此外,酵母已成为一个非常有用的平台,用于阐明涉及植物CYP450酶的不同萜类化合物途径。酵母系统已成功用于破解檀香中倍半萜类檀香醇、迷迭香中的二萜类鼠尾草酸和人参中的三萜类人参皂苷的合成调控途径[61-64]。
7 植物皂苷的毒性与自毒性避免机制
含有三萜皂苷的寄主植物多具有趋避作用或威胁摄食的功能,能够直接影响植食性害虫的繁殖和生长[65]。三萜皂苷对寄生昆虫有直接毒性,能抑制其消化功能,通过抑制进食和扰乱昆虫的肠道活动来提高死亡率[66]。三萜皂苷能与昆虫肠道蛋白酶等消化酶形成复合物,从而影响肠道消化过程;由于具有膜渗透性,三萜皂苷能够破坏昆虫肠黏膜细胞的结构;昆虫需要各种蜕皮甾体进行蜕皮,这些皂苷分子能够与胆固醇复合物结合,胆固醇复合物会导致细胞毒性和昆虫蜕皮失败[67]。
由于三萜皂苷的双亲性分子的特性,皂苷类物质可能会对植物自身产生毒害。植物也进化出通过保持代谢物特定三維空间结构和化学修饰的方式避免自身毒害。山芥(Barbarea vulgaris)中皂苷的生物学活性的发挥能够很好地诠释立体空间结构对化合物分子生物学功能的影响。CYP72/A552催化齐墩果酸在C23位的羟基化,导致C3位置葡糖苷相对于苷元平面旋转约90°,从而导致高毒性常春藤皂苷(hederagenin)的生成,而其类似物丝石竹酸皂苷(gypsogenic acid saponin)和齐墩果酸皂苷(oleanolic acid saponin)中,葡萄糖与齐墩果酸位于同一平面,导致丝石竹酸皂苷和齐墩果酸皂苷对小菜蛾幼虫的毒性远低于常春藤皂苷[15]。皂苷的化学修饰是影响其自毒性的另一重要因素。燕麦素是由燕麦根产生的抗菌三萜皂苷。sad3葡萄糖基转移酶的突变体积累了部分糖基化的燕麦素A-1,从而导致根生长受阻、根表皮膜运输缺陷和根毛缺乏,而野生型材料中SAD3催化燕麦素A-1完全糖基化后则不会出现自毒性现象[68],说明三萜皂苷的化学修饰能够显著调控其自毒性。
8 展望
次级代谢产物与生物胁迫耐受性有关,尤其是三萜皂苷,在减轻植食性昆虫危害方面发挥着关键作用。植物和昆虫的相互作用是一个不断互相进化适应的过程,这一过程导致了植物中为应对昆虫危害而生的皂苷类化合物的种类多样性。如何彻底了解它们的动态相互作用,以及如何在生物技术中适当利用它们,是未来作物抗虫机制研究和利用需要解决的重要问题。
氧化鲨烯环化酶(OSC)、细胞色素CYP450和糖基转移酶UGT等多基因家族是植物三萜皂苷生物多样性的关键控制基因。植物基因组中OSC基因的数量有限,使得基于同源性的基因发现方法成为可能。与OSC的情况相反,CYP450和UGT的基因数量众多,鉴定参与特定途径的CYP450和UGT基因时,既面临候选基因属于多基因家族的挑战,也面临着选择合理数量的候选基因进行表型研究的挑战。研究候选基因的选择通常涉及基因表达模式与皂苷生物合成的其他基因或与不同植物组织中皂苷积累的相关性的分析。此外,OSC、CYP450和UGT在染色体上簇状排列也是一个非常有意义的研究发现。这些研究发现为未来植物抗性相关皂苷通路研究提供了良好的借鉴。
参考文献:
[1]FAO. Global agriculture towards 2050[M]. Rome,Italy:FAO,2009.
[2]Aktar M W,Sengupta D,Chowdhury A. Impact of pesticides use in agriculture:their benefits and hazards[J]. Interdisciplinary Toxicology,2009,2(1):1-12.
[3]Zaynab M,Sharif Y,Abbas S,et al. Saponin toxicity as key player in plant defense against pathogens[J]. Toxicon,2021,193:21-27.
[4]Rossiter S E,Fletcher M H,Wuest W M. Natural products as platforms to overcome antibiotic resistance[J]. Chemical Reviews,2017,117(19):12415-12474.
[5]Kregiel D,Berlowska J,Witonska I,et al. Saponin-based,biological-active surfactants from plants[M]//Najjar R. Application and characterization of surfactants. IntechOpen,2017.
[6]Osbourn A,Goss R J M,Field R A. The saponins:polar isoprenoids with important and diverse biological activities[J]. Natural Product Reports,2011,28(7):1261-1268.
[7]Boulogne I,Petit P,Ozier-Lafontaine H,et al. Insecticidal and antifungal chemicals produced by plants:a review[J]. Environmental Chemistry Letters,2012,10(4):325-347.
[8]Hemmerlin A,Harwood J L,Bach T J. A raison dêtre for two distinct pathways in the early steps of plant isoprenoid biosynthesis?[J]. Progress in Lipid Research,2012,51(2):95-148.
[9]Balkema-Boomstra A G,Zijlstra S,Verstappen F W A,et al. Role of cucurbitacin C in resistance to spider mite (Tetranychus urticae) in cucumber (Cucumis sativus L.)[J]. Journal of Chemical Ecology,2003,29(1):225-235.
[10]de Geyter E,Lambert E,Geelen D,et al. Novel advances with plant saponins as natural insecticides to control pest insects[J]. Pest Technology,2007,1(2):96-105.
[11]Waligóra D.Activity of the saponin extract from the bark of Quillaja saponaria Molina,against Colorado potato beetle (Leptinotarsa decemlineata Say)[J]. Journal of Plant Protection Research,2006,46:199-206.
[12]Sobolewska D,Michalska K,Podolak I,et al. Steroidal saponins from the genus Allium[J]. Phytochemistry Reviews,2016,15(1):1-35.
[13]Kuzina V,Ekstrm C T,Andersen S B,et al. Identification of defense compounds in Barbarea vulgaris against the herbivore Phyllotreta nemorum by an ecometabolomic approach[J]. Plant Physiology,2009,151(4):1977-1990.
[14]Kuzina V,Nielsen J K,Augustin J M,et al. Barbarea vulgaris linkage map and quantitative trait loci for saponins,glucosinolates,hairiness and resistance to the herbivore Phyllotreta nemorum[J]. Phytochemistry,2011,72(2/3):188-198.
[15]Liu Q,Khakimov B,Cárdenas P D,et al. The cytochrome P450 CYP72A552 is key to production of hederagenin-based saponins that mediate plant defense against herbivores[J]. New Phytologist,2019,222(3):1599-1609.
[16]de Geyter E,Geelen D,Smagghe G. First results on the insecticidal action of saponins[J]. Communications in Agricultural and Applied Biological Sciences,2007,72(3):645-648.
[17]Ikbal C,Monia B H K,Mounir T,et al. Pesticidal potentialities of Cestrum parqui saponins[J]. International Journal of Agricultural Research,2007,2(3):275-281.
[18]Lin S,Chen Y X,Bai Y,et al. Effect of tea saponin-treated host plants on activities of antioxidant enzymes in larvae of the diamondback moth Plutella xylostella (Lepidoptera:Plutellidae)[J]. Environmental Entomology,2018,47(3):749-754.
[19]Zeng C,Wu L B,Zhao Y,et al. Tea saponin reduces the damage of Ectropis obliqua to tea crops,and exerts reduced effects on the spiders Ebrechtella tricuspidata and Evarcha albaria compared to chemical insecticidess[J]. PeerJ,2018,6:e4534.
[20]Tholl D.Biosynthesis and biological functions of terpenoids in plants[J]. Advances in Biochemical Engineering/Biotechnology,2015,148:63-106.
[21]Leivar P,González V M,Castel S,et al. Subcellular localization of Arabidopsis 3-hydroxy-3-methylglutaryl-coenzyme A reductase[J]. Plant Physiology,2005,137(1):57-69.
[22]Rohdich F,Zepeck F,Adam P,et al. The deoxyxylulose phosphate pathway of isoprenoid biosynthesis:studies on the mechanisms of the reactions catalyzed by IspG and IspH protein[J]. Proceedings of the National Academy of Sciences of the United States of America,2003,100(4):1586-1591.
[23]Vranová E,Coman D,Gruissem W. Network analysis of the MVA and MEP pathways for isoprenoid synthesis[J]. Annual Review of Plant Biology,2013,64:665-700.
[24]Chen F,Tholl D,Bohlmann J,et al. The family of terpene synthases in plants:a mid-size family of genes for specialized metabolism that is highly diversified throughout the Kingdom[J]. The Plant Journal,2011,66(1):212-229.
[25]Fujihashi M,Sato T,Tanaka Y,et al. Crystal structure and functional analysis of large-terpene synthases belonging to a newly found subclass[J]. Chemical Science,2018,9(15):3754-3758.
[26]Phillips D R,Rasbery J M,Bartel B,et al. Biosynthetic diversity in plant triterpene cyclization[J]. Current Opinion in Plant Biology,2006,9(3):305-314.
[27]Thimmappa R,Geisler K,Louveau T,et al. Triterpene biosynthesis in plants[J]. Annual Review of Plant Biology,2014,65:225-257.
[28]Hill R A,Connolly J D. Triterpenoids[J]. Natural Product Reports,2017,34(1):90-122.
[29]Xue Z Y,Duan L X,Liu D,et al. Divergent evolution of oxidosqualene cyclases in plants[J]. The New Phytologist,2012,193(4):1022-1038.
[30]Ghosh S. Triterpene structural diversification by plant cytochrome P450 enzymes[J]. Frontiers in Plant Science,2017,8:1886.
[31]Rahimi S,Kim J,Mijakovic I,et al. Triterpenoid-biosynthetic UDP-glycosyltransferases from plants[J]. Biotechnology Advances,2019,37(7):107394.
[32]Mugford S T,Louveau T,Melton R,et al. Modularity of plant metabolic gene clusters:a trio of linked genes that are collectively required for acylation of triterpenes in oat[J]. The Plant Cell,2013,25(3):1078-1092.
[33]Erthmann P ,Agerbirk N,Bak S. A tandem array of UDP-glycosyltransferases from the UGT73C subfamily glycosylate sapogenins,forming a spectrum of mono-and bisdesmosidic saponins[J]. Plant Molecular Biology,2018,97(1):37-55.
[34]Nagegowda D A. Plant volatile terpenoid metabolism:biosynthetic genes,transcriptional regulation and subcellular compartmentation[J]. FEBS Letters,2010,584(14):2965-2973.
[35]Wray G A,Hahn M W,Abouheif E,et al. The evolution of transcriptional regulation in eukaryotes[J]. Molecular Biology and Evolution,2003,20(9):1377-1419.
[36]Rushton P J,Bokowiec M T,Han S C,et al. Tobacco transcription factors:novel insights into transcriptional regulation in the Solanaceae[J]. Plant Physiology,2008,147(1):280-295.
[37]Grotewold E. Transcription factors for predictive plant metabolic engineering:are we there yet?[J]. Current Opinion in Biotechnology,2008,19(2):138-144.
[38]Xu Y H,Wang J W,Wang S,et al. Characterization of GaWRKY1,a cotton transcription factor that regulates the sesquiterpene synthase gene (+)-delta-cadinene synthase-A[J]. Plant Physiology,2004,135(1):507-515.
[39]Ishihama N,Yamada R,Yoshioka M,et al. Phosphorylation of the Nicotiana benthamiana WRKY8 transcription factor by MAPK functions in the defense response[J]. The Plant Cell,2011,23(3):1153-1170.
[40]Li S,Zhang P,Zhang M,et al. Functional analysis of a WRKY transcription factor involved in transcriptional activation of the DBAT gene in Taxus chinensis[J]. Plant Biology,2013,15(1):19-26.
[41]Sun Y Z,Niu Y Y,Xu J,et al. Discovery of WRKY transcription factors through transcriptome analysis and characterization of a novel methyl jasmonate-inducible PqWRKY1 gene from Panax quinquefolius[J]. Plant Cell,Tissue and Organ Culture (PCTOC),2013,114(2):269-277.
[42]Spyropoulou E A,Haring M A,Schuurink R C. RNA sequencing on Solanum lycopersicum trichomes identifies transcription factors that activate terpene synthase promoters[J]. BMC Genomics,2014,15(1):402.
[43]Akagi A,Fukushima S,Okada K,et al. WRKY45-dependent priming of diterpenoid phytoalexin biosynthesis in rice and the role of cytokinin in triggering the reaction[J]. Plant Molecular Biology,2014,86(1/2):171-183.
[44]Chen M H,Yan T X,Shen Q,et al. GLANDULAR TRICHOME-SPECIFIC WRKY 1 promotes artemisinin biosynthesis in Artemisia annua[J]. New Phytologist,2017,214(1):304-316.
[45]Cao W Z,Wang Y,Shi M,et al. Transcription factor SmWRKY1 positively promotes the biosynthesis of tanshinones in Salvia miltiorrhiza[J]. Frontiers in Plant Science,2018,9:554.
[46]Deng C P,Hao X L,Shi M,et al. Tanshinone production could be increased by the expression of SmWRKY2 in Salvia miltiorrhiza hairy roots[J]. Plant Science,2019,284:1-8.
[47]Singh A K,Kumar S R,Dwivedi V,et al. A WRKY transcription factor from Withania somnifera regulates triterpenoid withanolide accumulation and biotic stress tolerance through modulation of phytosterol and defense pathways[J]. New Phytologist,2017,215(3):1115-1131.
[48]Ding K,Pei T L,Bai Z Q,et al. SmMYB36,a novel R2R3-MYB transcription factor,enhances tanshinone accumulation and decreases phenolic acid content in Salvia miltiorrhiza hairy roots[J]. Scientific Reports,2017,7:5104.
[49]Mertens J,Pollier J,Vanden Bossche R,et al. The bHLH transcription factors TSAR1 and TSAR2 regulate triterpene saponin biosynthesis in Medicago truncatula[J]. Plant Physiology,2016,170(1):194-210.
[50]Yu Z X,Li J X,Yang C Q,et al. The jasmonate-responsive AP2/ERF transcription factors AaERF1 and AaERF2 positively regulate artemisinin biosynthesis in Artemisia annua L.[J]. Molecular Plant,2012,5(2):353-365.
[51]Zhang Y,Ji A J,Xu Z C,et al. The AP2/ERF transcription factor SmERF128 positively regulates diterpenoid biosynthesis in Salvia miltiorrhiza[J]. Plant Molecular Biology,2019,100(1/2):83-93.
[52]Li X,Xu Y Y,Shen S L,et al. Transcription factor CitERF71 activates the terpene synthase gene CitTPS16 involved in the synthesis of E-geraniol in sweet orange fruit[J]. Journal of Experimental Botany,2017,68(17):4929-4938.
[53]Zhou F,Sun T H,Zhao L,et al. The bZIP transcription factor HY5 interacts with the promoter of the monoterpene synthase gene QH6 in modulating its rhythmic expression[J]. Frontiers in Plant Science,2015,6:304.
[54]Lyu Z Y,Wang Y,Liu Y,et al. The SPB-box transcription factor AaSPL2 positively regulates artemisinin biosynthesis in Artemisia annua L.[J]. Frontiers in Plant Science,2019,10:409.
[55]Reed J,Osbourn A. Engineering terpenoid production through transient expression in Nicotiana benthamiana[J]. Plant Cell Reports,2018,37(10):1431-1441.
[56]Ward V C A,Chatzivasileiou A O,Stephanopoulos G. Metabolic engineering of Escherichia coli for the production of isoprenoids[J]. FEMS Microbiology Letters,2018,365(10):fny079.
[57]Sethia P,Ahuja M,Rangaswamy V. Metabolic engineering of microorganisms to produce isoprene[J]. Journal of Microbial & Biochemical Technology,2019,11(4):73-81.
[58]Ro D K,Ouellet M,Paradise E M,et al. Induction of multiple pleiotropic drug resistance genes in yeast engineered to produce an increased level of anti-malarial drug precursor,artemisinic acid[J]. BMC Biotechnology,2008,8:83.
[59]Westfall P J,Pitera D J,Lenihan J R,et al. Production of amorphadiene in yeast,and its conversion to dihydroartemisinic acid,precursor to the antimalarial agent artemisinin[J]. Proceedings of the National Academy of Sciences of the United States of America,2012,109(3):E111-E118.
[60]Paddon C J,Westfall P J,Pitera D J,et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature,2013,496(7446):528-532.
[61]Celedon J M,Chiang A,Yuen M M S,et al. Heartwood-specific transcriptome and metabolite signatures of tropical sandalwood (Santalum album) reveal the final step of (Z)-santalol fragrance biosynthesis[J]. The Plant Journal:for Cell and Molecular Biology,2016,86(4):289-299.
[62]Ignea C,Athanasakoglou A,Ioannou E,et al. Carnosic acid biosynthesis elucidated by a synthetic biology platform[J]. Proceedings of the National Academy of Sciences of the United States of America,2016,113(13):3681-3686.
[63]Wang P P,Wei W,Ye W,et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency[J]. Cell Discovery,2019,5:5.
[64]Han J Y,Kim M J,Ban Y W,et al. The involvement of β-amyrin 28-oxidase (CYP716A52v2) in oleanane-type ginsenoside biosynthesis in Panax ginseng[J]. Plant and Cell Physiology,2013,54(12):2034-2046.
[65]Singh B,Kaur A. Control of insect pests in crop plants and stored food grains using plant saponins:a review[J]. LWT,2018,87:93-101.
[66]Adel M M,Sehnal F,Jurzysta M. Effects of alfalfa saponins on the moth Spodoptera littoralis[J]. Journal of Chemical Ecology,2000,26(4):1065-1078.
[67]Taylor W G,Fields P G,Sutherland D H. Insecticidal components from field pea extracts:soyasaponins and lysolecithins[J]. Journal of Agricultural and Food Chemistry,2004,52(25):7484-7490.
[68]Mylona P,Owatworakit A,Papadopoulou K,et al. Sad3 and sad4 are required for saponin biosynthesis and root development in oat[J]. The Plant Cell,2008,20(1):201-212.
收稿日期:2022-12-10
基金項目:国家自然科学基金面上项目(编号:32071800);国家桃产业技术体系建设专项(编号:CARS-30-2-01);中国农业科学院科技创新工程项目(编号:CAAS-ASTIP-2023-ZFRI)。
作者简介:潘 磊(1984—),男,河北保定人,博士,副研究员,主要从事果树分子生物学研究。E-mail:panley@126.com。
通信作者:王志强,博士,研究员,主要从事果树遗传育种和栽培研究,E-mail:wangzhiqiang@caas.cn;牛 良,博士,研究员,主要从事果树遗传育种及相关研究,E-mail:niuliang@caas.cn。
