辣木叶多酚提取及抗氧化能力研究
2023-12-02李天娇程碧君张芳玮张峻旗董禹辰
李天娇,程碧君,张芳玮,张峻旗,董禹辰
(吉林农业科技学院食品工程学院,吉林吉林 132101)
辣木,广泛分布于热带地区,在广东、海南等地区有种植区。种子可以提取高级润滑油,辣木叶子可以作为汤的调味料,味道鲜美。新采摘的辣木叶还可以作为野菜食用[1]。辣木有许多药用价值,如用于治疗偏头痛、头晕、呼吸不畅、上火、尿黄、胃胀气、食欲不振、胃肠区痉挛,以及各种癌症[2-3]。辣木叶富含矿质元素、维生素、糖苷和多酚类化合物等活性物质。辣木叶具有良好的抗氧化、抑菌、降低血压、血脂和血糖,并改善机体的内脏器官、抑制人体内的DNA 分子损伤、良好的调节胃肠道微生物等多种生物活性[4-5]。选择辣木叶为研究对象对辣木叶多酚进行提取。经过试验获得了最佳工艺条件,采用DPPH 自由基清除、羟自由基清除试验研究辣木叶多酚抗氧化性能。探索辣木叶多酚的提取方法,并研究辣木叶多酚的抗氧化能力,对辣木叶多酚的开发利用提供借鉴。
1 材料与方法
1.1 材料与试剂
辣木叶,市售;没食子酸、福林酚、DPPH、邻苯三酚等,天津市致远化学试剂有限公司提供。
1.2 仪器与设备
AL204 型电子天平,梅特勒- 托利公司产品;ST-02A 型多功能粉碎机,上海树立仪器仪表有限公司产品;DHG-9240A 型电热恒温鼓风干燥箱,上海精宏实验设备有限公司产品;UV-8000A 型可见分光光度计,尤尼柯仪器有限公司产品。
1.3 试验方法
1.3.1 辣木叶多酚的提取
将新买的新鲜辣木叶子洗净,除去表面的异物,放在托盘中,用保鲜膜包起来,在表面上打几个小孔,保持通风。最后,放入干燥箱中,干燥至恒定质量,取出干燥的辣木叶子,用破碎机粉碎,过筛(40 目),放入密封袋中,放在阴凉干燥地方备用。称取辣木叶粉1.0 g,按不同的料液比加入不同体积分数乙醇。放入试管中,用玻璃棒搅拌均匀,在恒温水浴中振荡提取。然后放入离心机中,以转速4 000 r/min离心10 min。上清液放入50 mL 容量瓶中为后续测试做准备[6]。
1.3.2 制作标准曲线
没食子酸标准溶液的质量浓度为0.1 mg/mL,取出6 个15 mL 比色管,6 个比色管依次加入0,0.2,0.4,0.6,0.8,1.0 mL 没食子酸溶液,各管补加蒸馏水至1 mL,然后在每个比色管中加入1.5 mL 福林酚试剂,加入3 mL 的质量浓度为75 g/mL 碳酸钠试剂,最后加入蒸馏水至体积为10 mL,静置2 h,在波长752 nm 处测定其吸光度,制作标准曲线,以1 号管测得的吸光度为空白,以没食子酸标准品质量浓度为横坐标,吸光度为纵坐标,最后得到多酚标准曲线回归方程Y[7]。
1.3.3 多酚得率计算
辣木叶多酚产量按照以下公式计算[8]:
式中:C——提取液中多酚的质量浓度,mg/mL;
V——提取液的体积,mL;
M——称取的辣木叶粉的质量,mg。
1.3.4 单因素试验和正交试验
分别考查乙醇体积分数、料液比、浸提时间、浸提温度对辣木叶多酚得率的影响。根据单因素结果,设计四因素三水平正交试验,根据辣木叶片多酚的得率,确定最佳提取条件。
辣木叶多酚提取正交试验设计见表1。

表1 辣木叶多酚提取正交试验设计
1.3.5 体外抗氧化试验
(1) DPPH 自由基清除试验。准确配制DPPH 浓度为0.2 mo1/L,辣木叶多酚溶液1 mL 加入到干净的试管中,加入3 mL DPPH 溶液,混合均匀,放在黑暗中静置30 min,在波长517 nm 处测得吸光度为A1。另一试管中加入3 mL 无水乙醇溶液,并将1 mL不同质量浓度的辣木叶多酚溶液加入试管中,混合均匀后,在黑暗中静置30 min,在波长517 nm 处测定吸光度为A2。另取试管放入3 mL DPPH 溶液和1 mL无水乙醇溶液,混合后,将其置于黑暗中30 min,在波长517 nm 处的吸光度为A0,以相同浓度的维C 作为对照试验[9]。
(2) 羟基自由基清除试验。量取1 mL 不同质量浓度的辣木叶多酚溶液,分别加入5 个试管中,依次加入浓度为9 mmol/L 的FeSO4溶液1 mL 和质量分数为8.8%的H2O2溶液1 mL,浓度为9 mmol/L 的水杨酸溶液1 mL,振荡至完全混合,然后在37 ℃的水浴中放置30 min,在波长510 nm 处测量吸光度为A1,另外取5 个试管用蒸馏水代替H2O2,其他条件不变,吸光度为A2。取另一试管用蒸馏水代替辣木叶多酚溶液,其他条件不变,测定吸光度为A0,以相同浓度的维C 代替作为对照试验[10]。
1.4 统计分析
试验结果采用平均值±标准差(X±s) 表示,使用SPSS 17.0 统计软件进行方差分析,以p<0.05差异显著。
2 结果与分析
2.1 制作标准曲线
线性回归方程:Y=9.628 6X-0.004 8,R2=0.998 5。
没食子酸标准曲线见图1。
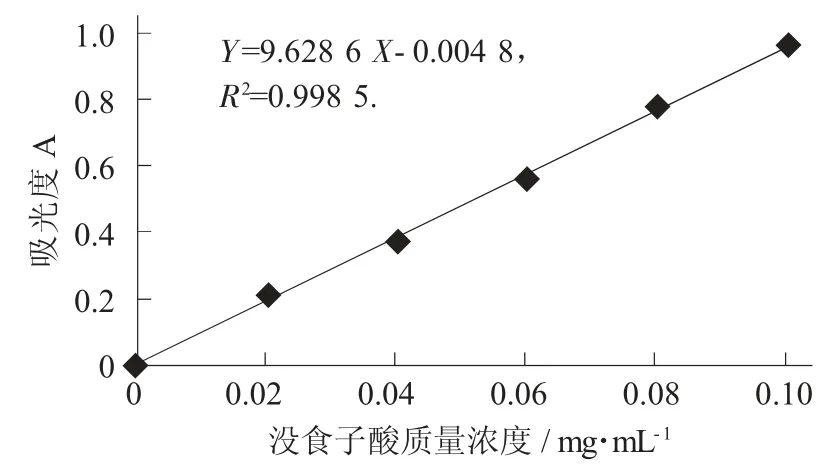
图1 没食子酸标准曲线
2.2 辣木叶多酚提取结果
2.2.1 乙醇体积分数对辣木叶多酚得率的影响
乙醇体积分数对辣木叶多酚得率的影响见图2。
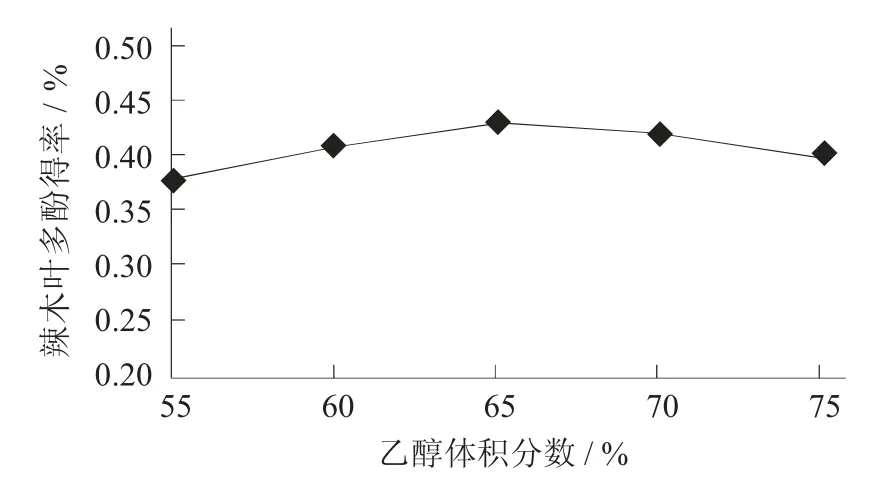
图2 乙醇体积分数对辣木叶多酚得率的影响
由图2 可知,当乙醇体积分数为55%时,辣木叶片中的多酚被提取。当乙醇体积分数小于65%时,可以连续提取辣木叶片中的多酚,当乙醇体积分数大于65%时,从辣木叶片中提取多酚的量减少,而不是先前的增加。可能是由于乙醇体积分数增加,从辣木叶中提取其他物质,类似脂类或醇溶性物质,与多酚竞争溶解,导致多酚溶解的最终原因[11]。
2.2.2 料液比对辣木叶多酚得率的影响
料液比对辣木叶多酚得率的影响见图3。
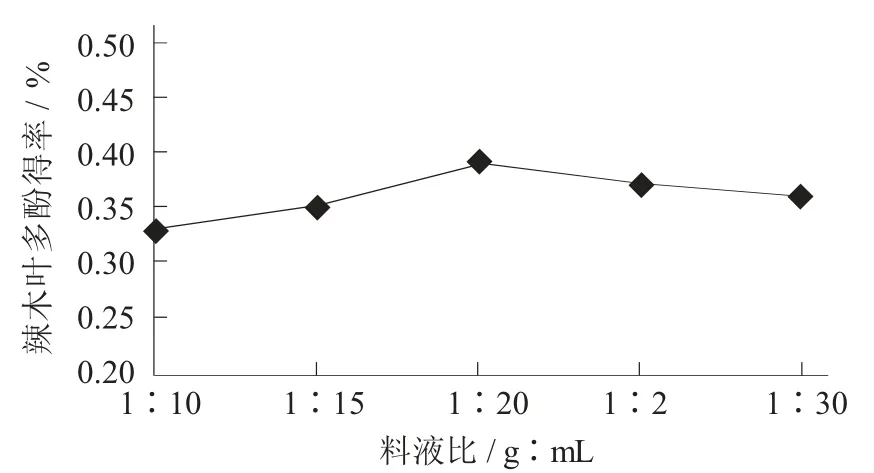
图3 料液比对辣木叶多酚得率的影响
由图3 可知,当料液比为1∶20(g∶mL) 时,辣木叶中多酚的得率最大,料液比为1∶10~1∶15(g∶mL) 时,辣木叶片中的多酚可以连续提取,当料液比1∶20(g∶mL) 时,辣木叶片中多酚的得率会下降,可能是由于料液比增加,乙醇体积分数增加,更多的乙醇可溶性物质被提取出来,会减少多酚溶于乙醇的量[12]。
2.2.3 提取温度对辣木叶多酚得率的影响
提取温度对辣木叶多酚得率的影响见图4。
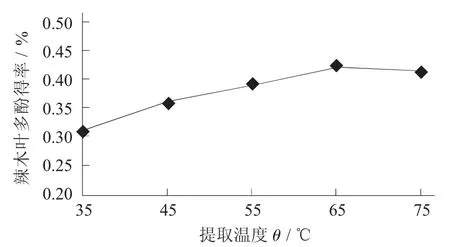
图4 提取温度对辣木叶多酚得率的影响
由图4 可知,辣木叶片中的多酚在35~65 ℃的提取温度下可以连续提取,在65~75 ℃时,辣木叶片中的多酚得率减少。可能是由于辣木叶中物质的破坏或辣木叶中多酚的破坏,导致辣木叶中多酚的得率降低[13]。
2.2.4 提取时间对辣木叶多酚得率的影响
提取时间对辣木叶多酚得率的影响见图5。
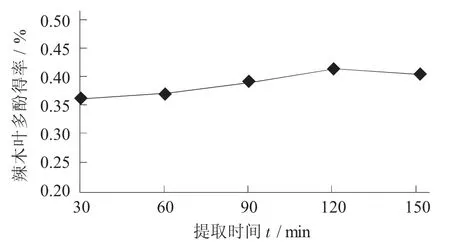
图5 提取时间对辣木叶多酚得率的影响
由图5 可知,提取时间为30~120 min 时,辣木叶片中的多酚可以连续提取,在120~150 min 时,辣木叶片中的多酚得率减少。可能是由于提取时间太长而无法破坏辣木叶片中的物质或辣木叶片中的多酚,导致从辣木叶片中提取多酚得率降低[14]。
2.2.5 辣木叶多酚提取正交试验结果
辣木叶多酚提取正交试验结果见表2。
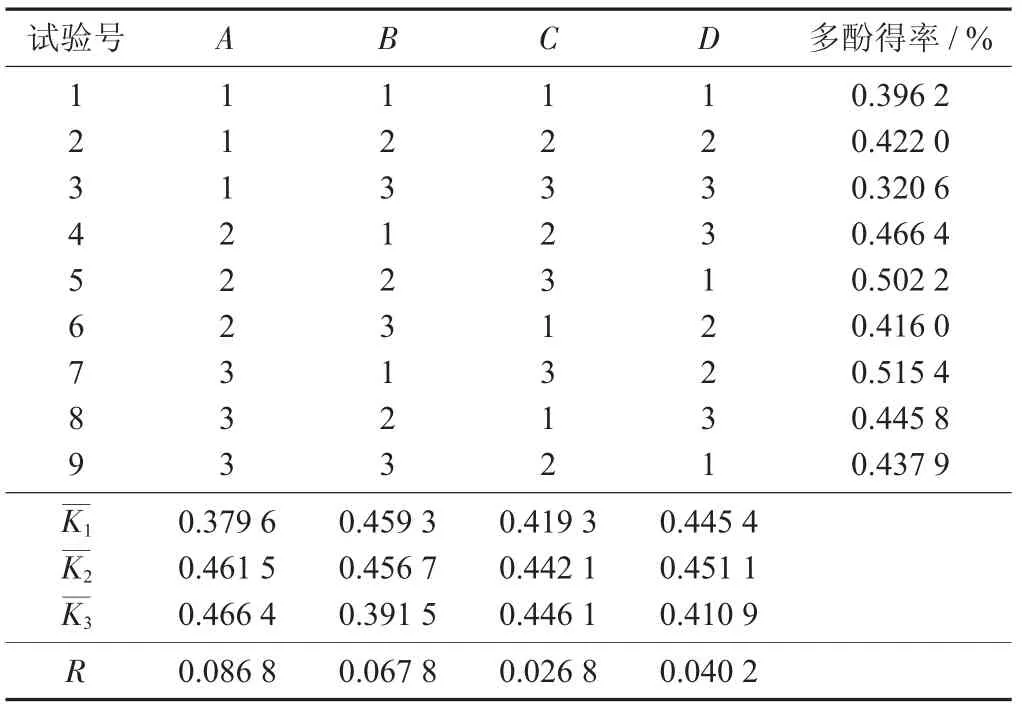
表2 辣木叶多酚提取正交试验结果
由表2 可知,影响辣木叶片多酚得率的因素为A>B>D>C,说明最佳提取条件为A3B1C3D2,即最佳条件为乙醇体积分数70%,料液比1∶15(g∶mL),提取时间120 min,提取温度65 ℃。根据这种组合进行验证试验。此时得率为0.515 4%。
2.3 辣木叶多酚体外抗氧化试验
2.3.1 DPPH 自由基清除测定
DPPH 自由基清除测定见图6。
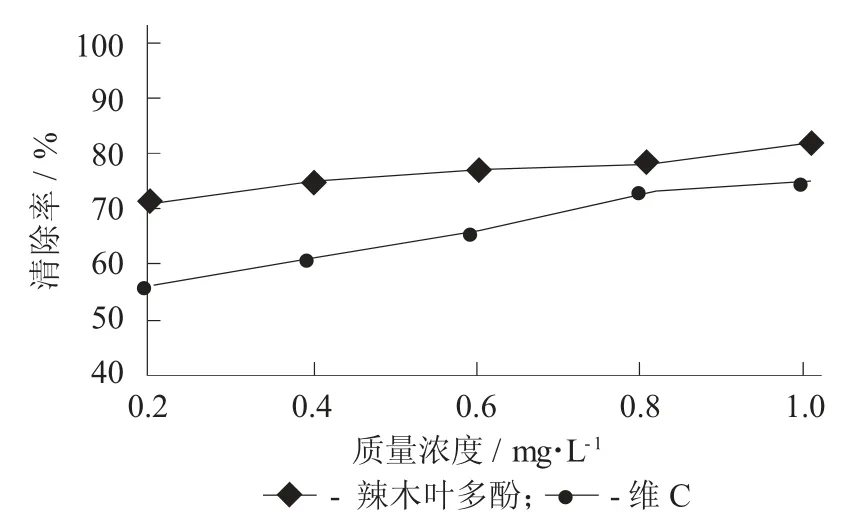
图6 DPPH 自由基清除测定
由图6 可知,在不同质量浓度的辣木叶多酚条件下,清除率呈现良好的上升状态,且无拐点出现。选择抗氧化剂维C 作为试验的对照品。在维C的质量浓度逐渐提高,清除率呈上升状态,说明维C具有一定的清除DPPH 的能力,但辣木叶多酚清除DPPH 的效果优于维C。因此可以看出,辣木叶多酚溶液具有很强的清除DPPH 自由基的能力。
2.3.2 羟基自由基清除测定
羟基自由基清除测定见图7。
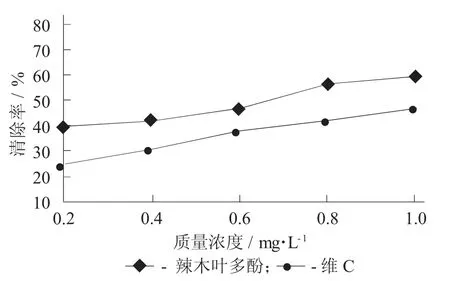
图7 羟基自由基清除测定
由图7 可知,在不同质量浓度的辣木叶多酚条件下,清除率呈良好的上升状态。维C的质量浓度逐渐提高,清除率呈上升状态,表明维C对羟基自由基具有一定的清除能力,但维C对羟基自由基的清除效果不如辣木叶多酚。
3 结论
选用辣木叶片为原料,采用乙醇提取辣木叶片中的多酚。试验表明,乙醇提取辣木叶多酚的最佳工艺条件为乙醇体积分数70%,料液比1∶15(g∶mL),提取时间120 min,提取温度65 ℃。在此条件下,多酚的得率可达0.515 4%。经过DPPH 自由基和羟自由基清除抗氧化能力试验表明,辣木叶片多酚具有较强的抗氧化能力,为辣木叶片多酚的体外抗氧化试验提供了应用指导,为抗氧化产品的开发提供了技术依据,为合理开发辣木叶资源提供了有效途径。
