经鼻胰岛素对高原小鼠记忆损伤的保护作用
2023-12-01陈思雨冷玉洁袁利邦西南医科大学临床医学院四川泸州646000解放军西部战区总医院麻醉科基础医学实验室四川成都6008
陈思雨,冷玉洁,张 明,林 露,袁利邦,巩 固 (西南医科大学临床医学院,四川 泸州 646000;解放军西部战区总医院:麻醉科,基础医学实验室,四川 成都 6008)
高海拔地区的低压低氧环境会严重影响人们的身体健康。大脑对缺氧极其敏感,暴露于低压低氧环境会造成脑代谢功能障碍等神经系统结构完整性破坏和功能损伤。海马体对于环境的空间表征和记忆特定事件的能力(即“情景记忆”)至关重要[1]。大脑中海马对缺氧最为敏感[2],海马受损后人的学习、记忆能力等认知功能会受到严重损害。LEFFERTS等[3]发现,高海拔可诱导受试者认知功能显著下降。有研究表明高原认知障碍可能与氧化应激[4-5]、神经元损伤凋亡[6]、神经递质释放[7]等有关。但是目前尚缺乏对于高原所致认知障碍的广泛有效且安全的防治措施,因此探寻防治高原认知障碍的药物策略具有重要意义。
近年来大量文献报道脑胰岛素在大脑中与认知密切相关。阿尔兹海默病(Alzheimer’s disease,AD)患者大脑对胰岛素作用的敏感性降低,一直被认为是发生神经变性和认知障碍的重要危险因素[8]。在AD动物模型中,胰岛素与中枢神经系统中的学习记忆、抗细胞凋亡、神经发生和突触可塑性之间存在密切关系[9-10]。但胰岛素是否有益于高原认知障碍尚未研究。经鼻给药是一种可以绕过血脑屏障直接把药物递送到中枢神经系统的无创给药方式[11],具有吸收起效快、无肝首过效应、使用方便等优势[12],同时减少不必要的全身副反应[13]。经鼻胰岛素的研究在认知方面已有较多研究,但其尚未应用于高原认知障碍。因此,本研究以经鼻给药方法,研究胰岛素是否能通过减轻氧化应激损伤、减少神经元凋亡以及提高突触传递功能改善高原认知,以期为高原认知保护提供新的思路。
1 材料与方法
1.1 材料
雌性C57BL/6小鼠(6~8周,17~20 g)80只由成都药康生物科技有限公司提供[实验动物许可证号:SCXK(川)2020-034]。小鼠随机分为常氧对照(CON)组、高原(HH)组、生理盐水(NS+HH)组、胰岛素预处理(I+HH)组、胰岛素治疗(HH+I)组,每组16只。CON组一直常规饲养于动物房(成都海拔约500 m),NS+HH组和I+HH组先经鼻给予生理盐水或胰岛素(甘舒霖人胰岛素注射液,3 mL∶300 U)7 d,HH+I组于第7日开始经鼻给胰岛素并和NS+HH组、I+HH组一同进入低压氧舱,HH+I组每日出舱继续行经鼻给药,直至出舱。所有小鼠均适应性喂养3 d后进行实验(图1)。

图1 实验流程图
1.2 方法
1.2.1 模拟高原低氧环境 采用低压氧舱(上海塔望智能科技有限公司)模拟海拔高度6 000 m高原环境,持续7 d,每日早上9∶00低压氧舱海拔降至当地海拔,取出小鼠进行给药处理。
1.2.2 经鼻给胰岛素 左手握持小鼠保持仰卧位,给药前小鼠预适应给药体位3 d,用10 μL移液枪进行经鼻给药,每给一滴药液后保持约10 s使其充分吸收,避免呛咳,左右鼻孔交替给药直至给完17.5 μL胰岛素(1.75 U)或生理盐水[14]。
1.2.3 Morris水迷宫 出低压氧舱后随机抓取各组小鼠10只送往行为学实验房间适应性喂养1 d,再行行为学实验。水迷宫水池直径1.2 m,平台直径7 cm,人为设定东西南北四个点为入水点并以此将水池分为四个象限。每个象限中点为另外四个入水点。水迷宫软件(成都泰盟软件有限公司)记录小鼠游泳路线等,小鼠爬上平台停留3 s后软件停止计时,记录下潜伏期。
1.2.3.1 定位航行实验 `前5 d为定位航行实验,平台固定在水下1 cm处。小鼠分别随机从四个入水点面向池壁入水,小鼠在60 s内找到平台并停留3 s,软件停止计时,记录为潜伏期时间。若在60 s内没有找到平台则记录潜伏期为60 s,用竹竿引导小鼠爬上平台停留学习15 s。每只小鼠每日实验4次,每次间隔不少于20 min。取小鼠4次实验的均值为当日实验结果。
1.2.3.2 空间探索实验 第6日为空间探索实验,移去平台。小鼠从离平台位置最远的入水点入水,以第1次穿过平台的时间为潜伏期。
1.2.4 样本采集 小鼠出舱后复氧1 d,3 g/L戊巴比妥钠腹腔注射麻醉后,摘眼球取血约0.7 mL,断颈处死后,冰上快速解剖出海马组织,深低温冰箱保存备用。所有血液4 500 r/min,离心10 min,收集血清保存于深低温冰箱备用。
每组4只小鼠麻醉后,行心脏灌注。灌注结束后取出脑组织浸泡在40 g/L多聚甲醛中4 ℃过夜,常规石蜡包埋,冠状位切片用于尼氏染色。
1.2.5 氧化应激指标检测 海马组织称质量后按1∶9体积加入生理盐水用组织破碎仪匀浆,匀浆用低温超速离心机4 ℃,3 500 r/min,离心10 min,取上清液备用。总蛋白定量试剂盒(南京建成生物工程研究所)测定样本组织蛋白浓度。过氧化氢(hydrogen peroxide,H2O2)测试盒、丙二醛(malondialdehyde,MDA)测试盒、超氧化物歧化酶(superoxide dismutase,SOD)测试盒(南京建成生物工程研究所)按说明书实验测量小鼠海马组织上述指标的含量。
1.2.6 Western blotting 蛋白匀浆制备蛋白样品。常规电泳(100 g/L分离胶)、转膜(PVDF膜)后,快速封闭液(碧云天,中国)封闭10 min,一抗4 ℃孵育过夜:兔抗synapsin 1(ab254349,1∶1 000)、兔抗B淋巴细胞瘤-2(B-cell lymphoma-2,Bcl-2,CST 3498S,1∶1 000)、兔抗cleaved caspase-3(CST 9664S,1∶1 000),TBST洗膜4次,每次5 min,室温孵育二抗(ZB-2301,1∶50 000)1 h,洗膜后ECL发光液(millipore,美国)显影曝光条带。图像用ImageJ分析量化。
1.2.7 尼氏染色 石蜡切片常规脱蜡至水,甲苯胺蓝染色,数字切片扫描仪扫描观察海马病理学变化。

2 结果
2.1 经鼻胰岛素对高原环境小鼠认知功能障碍的影响
2.1.1 定位航行实验 定位航行实验反映小鼠的空间学习能力。通过5 d的隐匿平台学习,各组小鼠逃避潜伏期均显著下降(图2A)。不同组间定位航行实验潜伏期有统计学意义(F=9.809,P<0.01)。与CON组相比,HH组小鼠(P<0.01)和NS+HH组(P<0.01)小鼠潜伏期明显延长,高原环境可诱导小鼠认知障碍。胰岛素治疗组能明显改善高原小鼠认知障碍(HH组vsHH+I组,P<0.01),胰岛素预处理组对高原小鼠认知改善无明显作用(I+HH组vsHH组,P>0.05)

A:定位航行实验学习曲线;B:空间探索实验潜伏期。n=10;aP<0.05,bP<0.01 vs CON组;dP<0.01 vs HH组。图2 行为学测试结果
2.1.2 空间探索实验 空间探索实验反映小鼠的空间记忆能力。移去平台后各组小鼠第1次找到平台的时间(潜伏期)差异具有统计学意义(F=8.553,P<0.01,图2B)。较CON组,HH组小鼠(P<0.01)和NS+HH组小鼠(P<0.01)的潜伏期显著增加,I+HH组小鼠(P<0.01)和HH+I组小鼠(P<0.01)的潜伏期显著下降。以上结果表明,经鼻胰岛素预处理和经鼻胰岛素治疗可以显著提高高原小鼠空间学习和记忆能力,改善高原所致小鼠的认知障碍。
2.2 经鼻胰岛素对高原环境下小鼠海马组织氧化应激指标的影响
H2O2试剂盒测量结果显示,HH组小鼠(P<0.05)和NS+HH组小鼠(P<0.05)海马组织H2O2含量增加。I+HH组含量较HH组降低(P<0.05),HH+I组含量较HH组显著降低(P<0.01),甚至低于CON组(图3A)。MDA试剂盒测量结果显示,HH组小鼠(P<0.05)和NS+HH组(P<0.05)小鼠海马组织MDA含量较CON组显著升高,胰岛素预处理和胰岛素治疗有缓解高原小鼠MDA含量的趋势,差异不具有统计学意义(图3B)。SOD试剂盒测量结果显示,HH组和NS+HH组小鼠SOD活力下降,I+HH组和HH+I组SOD活力较HH组升高,但差异均没有统计学意义(图3C)。以上结果表明,HH组小鼠较CON组氧化应激严重,抗氧化能力降低,经鼻胰岛素可以减轻高原小鼠的氧化损伤。

A:H2O2含量;B:MDA含量;C:SOD活力。n=6;aP<0.05 vs CON组;cP<0.05,dP<0.01 vs HH组。图3 海马组织氧化应激测量指标结果
2.3 尼氏染色观察小鼠海马CA1和CA3区神经细胞的改变
尼氏染色结果显示,与CON组相比,HH组和NS+HH组小鼠CA1区神经元尼氏小体部分溶解,染色变淡,I+HH组和HH+I组小鼠CA1区尼氏小体溶解情况较HH组明显改善;与CON组相比,HH组和NS+HH组小鼠CA3区有大量明显的核固缩现象,I+HH组和HH+I组小鼠CA3区核固缩现象较HH组显著减少(图4)。以上结果表明,高原小鼠神经细胞变性、死亡增多,经鼻胰岛素可以减少高原小鼠神经元死亡。
2.4 经鼻胰岛素对高原环境下小鼠海马组织凋亡相关蛋白表达的影响
蛋白印迹实验显示,小鼠Bcl-2的表达水平HH组(P<0.01)和NS+HH组(P<0.01)较CON组显著降低,I+HH组小鼠Bcl-2的表达水平较HH组明显升高(P<0.05),HH+I组较HH组显著升高(P<0.01),甚至高于CON组(图5A~B)。与CON组相比,HH组和NS+HH组小鼠cleaved caspase-3表达水平显著升高,I+HH组(P<0.05)和HH+I组(P<0.01)小鼠cleaved caspase-3表达水平显著下降(图5C~D)。以上结果表明,高原小鼠海马神经元凋亡严重,经鼻胰岛素可以显著减轻神经元凋亡情况。
2.5 经鼻胰岛素对高原环境下小鼠海马组织Syn-1蛋白表达的影响
蛋白印迹实验显示,HH组(P<0.05)和NS+HH组(P<0.01)Syn-1蛋白表达水平较CON组明显降低,I+HH组(P<0.01)和HH+I组(P<0.05)Syn-1表达量较高原组显著提高(图6A~B)。以上结果表明,经鼻胰岛素处理可恢复神经突触的可塑性。
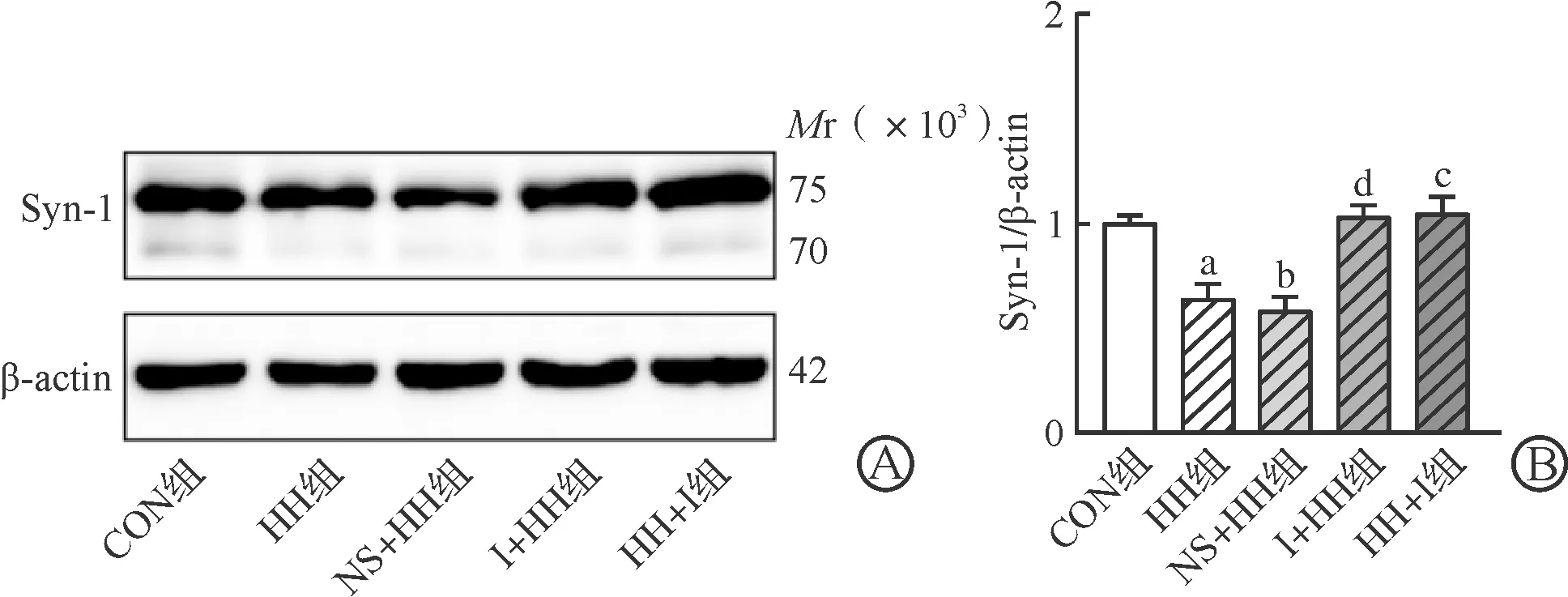
A:海马Syn-1蛋白条带图;B:海马Syn-1蛋白分析图。n=6;aP<0.05,bP<0.01 vs CON组;cP<0.05,dP<0.01 vs HH组。图6 小鼠突触蛋白表达情况
3 讨论
高原认知障碍是一种常见的高原脑病,随着越来越多的人迁移到高原,高原脑病和低氧导致的认知障碍引起了公众的关注[15]。本研究以雌性小鼠为对象,有研究表明对经鼻胰岛素的反应存在性别差异,女性对胰岛素刺激海马体依赖的记忆功能更敏感;使用低压氧舱制备高原低氧模型,结果显示HH组小鼠较CON组空间学习和记忆显著降低,表明高原低氧模型制备成功。NS+HH组与HH组间行为学数据没有差异,表明经鼻给药这一刺激对高原小鼠没有显著影响。实验证明胰岛素经鼻给药对高原小鼠认知功能有保护作用。且HH+I组空间学习能力明显优于I+HH组,甚至和CON组无异,可能胰岛素治疗较预给药更为有效。经鼻胰岛素在脑脊液中的半衰期是2 h,在艾滋病所致神经认知障碍模型小鼠中,经鼻给胰岛素可完全逆转模型小鼠的认知障碍,但是神经元水平的变化在给药结束24 h后消失[16],较短的半衰期可能是胰岛素治疗比胰岛素预给药效果更佳的原因。
低氧环境诱导脑代谢障碍,氧自由基生成增加,同时机体内抗氧化剂消耗增加,二者失衡导致机体氧化损伤甚至神经元凋亡。H2O2是活性氧中较为典型的氧自由基。活性氧会诱导脂质氧化产生MDA,导致神经元氧化损伤,对认知功能造成损害[17-18]。SOD是一种抗氧化剂,可以通过消除氧自由基达到脑保护作用。秦宁宁等[17,19]报道高原小鼠较常氧对照小鼠H2O2和MDA含量显著升高,谷胱甘肽和SOD活力显著下降,与本研究结果一致。经鼻胰岛素干预可逆转上述指标趋势,说明经鼻胰岛素可以通过减轻小鼠海马氧化应激损伤来保护高原认知能力。
氧化应激损伤可进一步导致神经元凋亡,受损凋亡的神经元内尼氏小体会减少或溶解。钟婷等[20]报道6 000 m海拔6 d后,高原小鼠海马CA1、CA3区域尼氏染色细胞着色浅,齿状回部位核固缩深染细胞增多,与本研究结果相似。经鼻胰岛素干预后上述现象显著改善。Bcl-2作为位于线粒体外膜上的抗凋亡蛋白,在神经元中通过维持线粒体的完整性来抑制神经元凋亡[21-22]。已有文献表明,抗凋亡蛋白Bcl-2可抑制细胞色素C的分泌,细胞色素C通过激活caspase-3形成cleaved caspase-3促进细胞凋亡[23-24]。本实验结果显示,高原小鼠Bcl-2表达显著下降,cleaved caspase-3表达显著升高,表明高原小鼠海马组织发生了大量的神经元凋亡,经鼻胰岛素干预逆转了凋亡相关蛋白的表达水平,说明经鼻胰岛素可能通过减轻海马神经元凋亡发挥高原脑保护作用。
受损的神经元突触传递功能严重障碍,突触传递功能主要依靠神经递质的转运和释放。Syn参与了突触囊泡周期的多个阶段,包括囊泡聚集、维持囊泡储备池、囊泡向活性区域传递和同步释放[25],对神经递质的释放发挥着重要作用。ZHANG等[26]研究发现持续性或间歇性低氧暴露后,大鼠海马神经元Syn-1表达水平降低,与本实验结果一致。张国梁等[27-28]发现提高Syn-1的表达可以通过提高突触可塑性来改善认知功能障碍。本实验研究结果显示,高原小鼠胰岛素经鼻给药后Syn-1表达量显著上升,提示改善海马神经突触功能可能是经鼻胰岛素改善高原认知障碍的机制之一。
综上所述,低压氧舱可以稳定诱导出高原认知障碍模型,经鼻胰岛素预处理和经鼻胰岛素治疗可能通过减轻海马氧化应激损伤、减少神经元凋亡和提高突触功能途径发挥高原认知功能保护作用。经鼻胰岛素有望成为高原认知障碍防治措施的手段之一,不过有待后期更多的临床实验验证和支持。
