伊布替尼血药浓度检测方法的建立及临床应用Δ
2023-12-01韩功伟赵营莉刘沁华安徽医科大学药学院合肥2002安徽医科大学第一附属医院药剂科合肥20022合肥市第二人民医院药学部合肥2002安徽医科大学第一附属医院血液科合肥20022
韩功伟 ,张 腾 ,赵营莉 ,刘沁华 ,夏 泉 ,2#(.安徽医科大学药学院,合肥 2002;2.安徽医科大学第一附属医院药剂科,合肥 20022;.合肥市第二人民医院药学部,合肥 2002;.安徽医科大学第一附属医院血液科,合肥 20022)
伊布替尼是首个不可逆的布鲁顿氏受体酪氨酸激酶(Bruton’s tyrosine kinase,BTK)抑制剂,可通过抑制B细胞受体信号来减少B 细胞的增殖、迁移和凋亡,从而发挥阻断B细胞白血病和淋巴瘤所需生长信号的作用。临床研究证实,该药可明显延长慢性淋巴细胞白血病(chronic lymphocytic leukemia,CLL)患者的生存时间[1―2]。2017年,伊布替尼获我国国家食品药品监督管理总局批准用于治疗CLL/小淋巴细胞性淋巴瘤(small lymphocytic lymphoma,SLL)、套细胞淋巴瘤(mantle-cell lymphoma,MCL)和华氏巨球蛋白血症(Waldenström’s macroglobulinemia,WM)等非霍奇金淋巴瘤[3]。随着伊布替尼在临床的广泛应用,该药引起的出血、房颤、腹泻、上呼吸道感染、疲劳等常见的轻微(Ⅰ~Ⅱ级)不良反应逐渐被发现,且房颤、出血还可能会导致Ⅲ级及以上严重不良反应的发生,其安全性越来越受到临床关注。
伊布替尼主要由细胞色素P450 代谢,在相同的服药剂量下,不同人群可能存在较大的浓度差异,且这种差异无法避免[4―5]。有研究认为,较高的伊布替尼药-时曲线下面积(area under curve,AUC)与药物不良反应的发生有关[6]。因此,该药的峰浓度可用于预测患者是否存在较高的药物毒性风险。虽然有研究报道了使用液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)技术检测伊布替尼的血药浓度[7],但该方法的设备价格高,操作复杂,很难在医疗机构普及。为此,本研究建立了检测人血浆中伊布替尼浓度的高效液相色谱(HPLC)法,并应用于临床,旨在为伊布替尼的个体化给药及药物毒性风险预测提供参考。
1 材料
1.1 主要仪器
本研究所用主要仪器包括1260 Infinity Ⅱ型HPLC仪[安捷伦科技(中国)有限公司],KDC-1044型低速离心机、HC-3018 型高速离心机(安徽中科中佳科学仪器有限公司),XW-80A型涡旋机(海门市其林贝尔仪器制造有限公司),MG-2200 型氮气吹干仪(东京EYELA公司)。
1.2 主要药品与试剂
伊布替尼对照品(批号S81126,纯度99%)购自上海源叶生物科技有限公司;泽布替尼对照品(内标,批号420076-202001,纯度99.5%)购自中国食品药品检定研究院;乙腈、甲醇均为色谱级,甲酸、磷酸二氢钾均为分析纯,水为注射用无菌用水。
1.3 血浆样本
空白血浆由未使用过伊布替尼或泽布替尼的健康志愿者提供。提供者均签署了知情同意书。
2 方法与结果
2.1 色谱条件
以Agilent 5 TC-C18(2)(250 mm×4.6 mm,5 μm)为色谱柱,乙腈-0.5%磷酸二氢钾溶液(43∶57,V/V)为流动相;流速为1 mL/min;检测波长为260 nm;柱温为40 ℃;进样量为20 μL;运行时间为25 min。
2.2 溶液的配制
2.2.1 对照品储备液与内标储备液
精密称取伊布替尼、内标对照品各10.00 mg,分别用甲醇溶解并定容至10 mL容量瓶中,制得质量浓度均为1 mg/mL的对照品储备液和内标储备液。
2.2.2 系列标准曲线溶液、质控溶液与内标工作液
取“2.2.1”项下对照品储备液40 μL,加入甲醇960 μL,制得质量浓度为40 μg/mL的伊布替尼工作溶液,再用甲醇稀释,得质量浓度分别为0.8、2.0、4.0、8.0、16、32、40 μg/mL 的系列标准曲线溶液(分别以0.8、2.0、16、32 μg/mL作为定量下限、低、中、高质量浓度的质控溶液)。取“2.2.1”项下内标储备液20 μL,加入甲醇980 μL,得质量浓度为20 μg/mL内标溶液;取该溶液400 μL,加入甲醇600 μL,得质量浓度为8 μg/mL的内标工作液。
2.3 样本前处理
取血浆样本780 μL,分别加入“2.2.2”项下质控溶液10 μL 和内标工作液10 μL,再加入水700 μL,混匀,得载样前样本;取该样本,经固相萃取柱(先加入甲醇1 mL,再加入水1 mL活化),依次用水1 mL、甲醇-水溶液(60∶40,V/V)1 mL淋洗,再用甲醇-甲酸溶液(98∶2,V/V)0.5 mL 洗脱2 次后,收集洗脱液,在40 ℃下以氮气流吹干,残渣用甲醇-甲酸溶液(98∶2,V/V)100 μL 复溶,以12 000 r/min离心10 min,取上清液进样检测。
2.4 方法学考察
2.4.1 专属性试验
取5 份不同来源的空白血浆,不加入质控溶液和内标工作液,其余按“2.3”项下方法处理后,再按“2.1”项下色谱条件进样检测,记录色谱图(图1A)。取空白血浆,加入“2.2.2”项下定量下限质量浓度质控溶液(0.8 μg/mL)及内标工作液,按“2.3”项下方法处理后,再按“2.1”项下色谱条件进样检测,记录色谱图(图1B)。取某患者用药(每日服用伊布替尼胶囊1次,每次420 mg,服药30 d)2 h 后血浆样本,加入内标工作液,按“2.3”项下方法处理后,再按“2.1”项下色谱条件进样检测,记录色谱图(图1C)。结果显示,伊布替尼与内标的保留时间分别约为22.7、11.6 min,空白血浆对目标成分和内标检测无干扰,表明本方法的专属性良好。
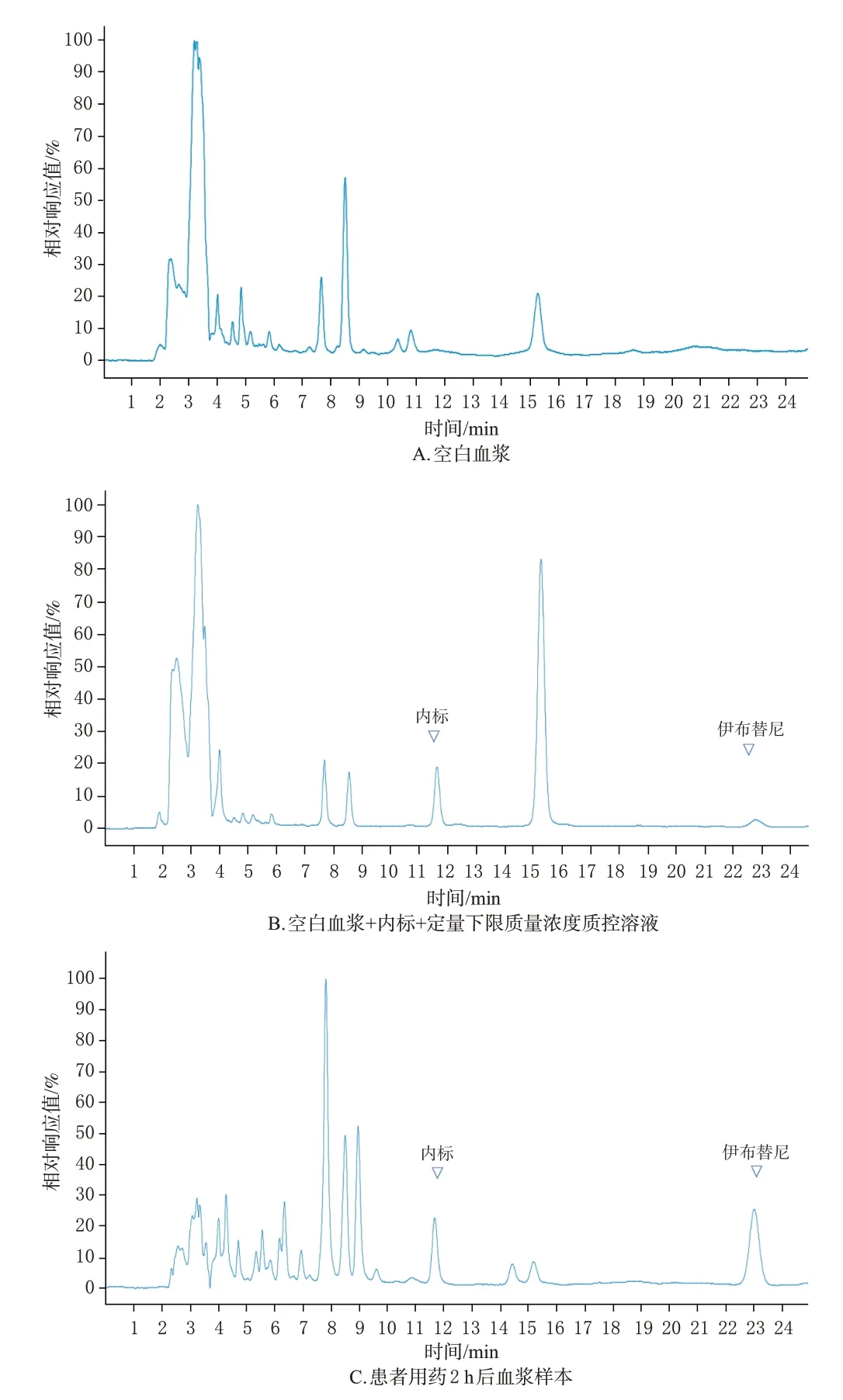
图1 伊布替尼定量分析的HPLC图
2.4.2 线性关系与定量下限考察
取“2.2.2”项下系列标准曲线溶液和内标工作液,按“2.3”项下方法处理,得质量浓度分别为10、25、50、100、200、400、500 ng/mL 的标准曲线溶液,再按“2.1”项下色谱条件进样检测。以伊布替尼质量浓度为横坐标(x)、伊布替尼峰面积与内标峰面积的比值为纵坐标(y),采用加权最小二乘法进行线性回归,得伊布替尼的回归方程为y=1.041 4x+0.137 9(R2=0.998 9),表明伊布替尼检测质量浓度在10~500 ng/mL范围内与峰面积比值的线性关系良好。其定量下限为10 ng/mL。
2.4.3 准确度与精密度试验
取“2.2.2”项下质控溶液和内标工作液,按“2.3”项下方法处理,得质量浓度分别为10、25、200、400 ng/mL 的溶液,再按“2.1”项下色谱条件进样检测,每样本平行测定10份,考察批内精密度;每样本平行测定5份,连续测定3 d,考察批间精密度。将实测质量浓度与理论质量浓度进行比较,以相对误差(relative error,RE)考察准确度。结果显示,批内、批间精密度试验的RSD 均不高于12.77%,RE 为-2.14%~6.51%,表明本方法的准确度、精密度良好。结果见表1。
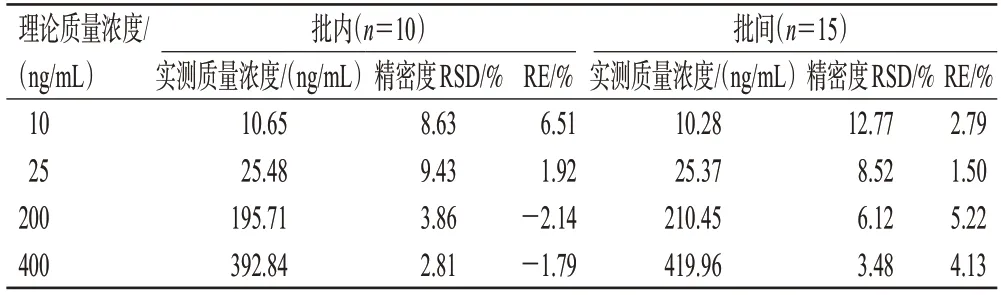
表1 准确度与精密度试验结果
2.4.4 提取回收率试验
取“2.2.2”项下低、高质量浓度的质控溶液(质量浓度分别为2.0、32 μg/mL)和内标工作溶液,按“2.3”项下方法处理后,再按“2.1”项下色谱条件进样检测,记录伊布替尼峰面积与内标峰面积的比值(A1)。取空白血浆,按“2.3”项下方法处理后,加入相应质量浓度的质控溶液和内标工作液(使最终质量浓度与前者一致),再按“2.1”项下色谱条件进样检测,记录伊布替尼峰面积与内标峰面积的比值(A2)。每样本平行测定5 次,按下式计算提取回收率:提取回收率=A1/A2×100%。结果显示,提取回收率分别为74.80%、97.70%,RSD 均小于2.90%(n=5)。
2.4.5 稳定性试验
取“2.2.2”项下低、高质量浓度的质控溶液(质量浓度分别为2.0、32 μg/mL)和内标工作溶液,按“2.3”项下方法处理后,再按“2.1”项下色谱条件进样检测,分别考察处理前样本在4 ℃下放置12 h,-20 ℃下分别保存30、60 d,处理后样本在自动进样器中放置12 h时的稳定性,每样本平行测定5份。结果显示,低质量浓度溶液稳定性试验的RSD 分别为2.81%、2.63%、2.48%、7.06%(n=5),高质量浓度溶液稳定性试验的RSD 分别为0.79%、5.06%、1.70%、3.87%(n=5),表明不同条件下各样本稳定性良好。
2.5 临床应用
2.5.1 纳入与排除标准
本研究的纳入标准为:(1)年龄18~80 岁;(2)经病理学检查明确诊断为CLL/SLL或MCL或WM;(3)具有完整的疗效评价资料和不良反应信息;(4)签署了知情同意书。
本研究的排除标准为:(1)中重度肝肾功能不全者;(2)妊娠期或哺乳期妇女;(3)依从性差者。
2.5.2 资料来源
选择2022年8月1日至2023年5月1日在安徽医科大学第一附属医院接受伊布替尼治疗的9例非霍奇金淋巴瘤患者(7例CLL,1例MCL,1例WM)。本研究方案经医院医学伦理委员会批准,伦理批件号:PJ2022-11-17。
2.5.3 用药方法
所有患者均连用伊布替尼胶囊(国药准字HJ20181066,美国Catalent CTS LLC,规格 140 mg)超过30 d,用药频率为每天1次,用药剂量根据病情分为每天280 mg 或420 mg,其中1 例患者为280 mg,8 例患者为420 mg。
2.5.4 检测方法与检测结果
从患者签署知情同意书日起连续用药至少30 d,采集患者第30 天用药后2 h 的静脉血[8],按“2.3”项下方法处理后,再按“2.1”项下色谱条件进样检测,记录峰面积并代入随行标准曲线计算伊布替尼的血药浓度。结果显示,1 例服用280 mg/d 患者的血药浓度为176.583 ng/mL,8 例服用420 mg/d 患者的血药浓度分别为15.341、15.746、21.275、26.764、37.325、117.170、169.451、279.628 ng/mL。结果见图2。
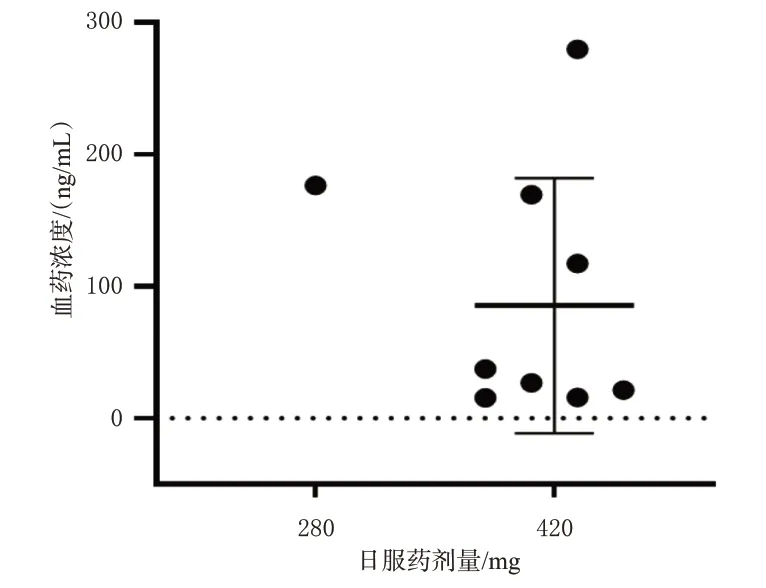
图2 9 例患者第30 天用药后2 h 的伊布替尼血药浓度分布
3 讨论
Ezzeldin 等[9]使用LC-MS/MS 技术检测了人血浆中伊布替尼的浓度,使用液-液萃取法进行样本前处理,线性范围为5~1 000 ng/mL。本研究在文献报道的基础上进行了调整,以不同比例的甲醇-水溶液作为固相萃取的淋洗液和洗脱液,能有效去除杂质,提高伊布替尼回收率,且试剂简单易得,方法简便快捷,故选择甲醇-水溶液作为样本前处理试剂。在选择流动相时,本研究使用乙腈-0.5%磷酸二氢钾溶液为流动相,当二者比例为40∶60~50∶50(V/V)时,所得色谱峰峰形良好;随后将乙腈以1%的比例梯度增加,当二者比例为43∶57(V/V)时,所得色谱峰峰形最优,故选择乙腈-0.5%磷酸二氢钾溶液(43∶57,V/V)为流动相。
有文献指出,非复发型CLL 患者服用伊布替尼420 mg/d 后,第1 天血药浓度为140.93 ng/mL,第8 天为82.80 ng/mL,且患者可耐受该药的不良反应[10]。本研究中,有1例患者因服用伊布替尼420 mg/d后出现心悸、房颤等不良反应,医师在评估临床疗效及不良反应后给予减量(280 mg/d)处理;经剂量调整后,患者服用280 mg/d的伊布替尼仍有效,其血药浓度为176.583 ng/mL;8例服用伊布替尼420 mg/d的患者中,血药浓度最低为15.341 ng/mL,而本方法的定量下限为10 ng/mL,表明本方法可以满足临床治疗药物监测的需求。本研究所得线性范围为10~500 ng/mL,患者可在25 min 内完成血浆浓度的检测,对设备要求不高,适宜常规医疗机构开展血药浓度检测。此外,因泽布替尼与伊布替尼有相近的理化性质且与伊布替尼同属BTK抑制剂,故选择泽布替尼为内标;同时,本研究建立的方法也可用于后续拓展检测泽布替尼的血药浓度。
非霍奇金淋巴瘤是一种惰性肿瘤,绝大部分的CLL、WM初诊患者和部分MCL患者无明显症状。有研究发现,虽然伊布替尼可延长患者的生存时间[11],但也会因药物的相互作用[如同时使用肝药酶抑制剂(酮康唑)]或者禁食而导致伊布替尼血药浓度发生变化,甚至可能加重伊布替尼引起的出血、房颤等不良反应[12]。伊布替尼主要通过细胞色素P450 代谢,由于患者代谢酶差异而可能导致个体间药物浓度不同[13]。本研究中,8例服用相同剂量伊布替尼患者的血药浓度为15.341~279.628 ng/mL,这提示该药的个体差异较大。有文献指出,伊布替尼的血药峰浓度大于70 ng/mL,对CLL 或MCL有治疗作用[14]。因此,通过检测伊布替尼的血药浓度及临床生化指标,可对其用药剂量进行及时调整,从而实现个体化给药。
综上所述,本研究所建立的HPLC 法简单、快捷,可用于伊布替尼血药浓度的测定。
