阿霉素载药栓塞微球的制备和性能表征*
2023-11-30马茗熙黄锦鑫
陈 鹏,马茗熙,黄锦鑫,熊 非,汪 豪**
1中国药科大学 中药学院,南京 210009;2东南大学 生物科学与医学工程学院,南京 210000
癌症已成为全球主要死因之一,原发性肝癌是第六大常见癌症和第三大致死性癌症[1]。对于中晚期肝癌,全身性治疗手段如化疗、放疗都存在较强的副作用,杀伤肿瘤细胞的同时对全身正常组织、器官和免疫系统造成了巨大损伤。由于肝癌组织的血供特性[2],经导管动脉栓塞术(transcatheter arterial embolization,TAE)临床可用于中晚期肝癌治疗,通过微导管将栓塞剂输送至肝动脉及分支动脉,堵塞血管,切断营养供给而杀死癌细胞[3,4]。经导管动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)在TAE 的基础上,将化疗药物与栓塞剂结合使用,二者的双重作用可使肿瘤组织在短时间内坏死萎缩,而对正常组织或器官造成的影响较小[5]。
与传统TACE 相比,载药微球TACE[drug-eluting bead(DEB)-TACE] 可实现标准化的药物缓控释,全身毒副作用较小[6],具有更好的临床应用前景。目前,市面上的DEB 多以不可降解的聚乙烯醇等材料合成[7],如DC Bead、HepaSphere 和国产的CalliSphere 等[5,8]。但此类微球的永久性栓塞不仅阻碍了后续治疗[7],且存在药物无法完全释放等缺陷[9]。
壳聚糖、海藻酸钠等天然高分子材料因其生物可降解性而被广泛用于制备可降解栓塞微球[10]。透明质酸(hyaluronic acid,HA)是一种阴离子线性杂多糖,单糖组成为D-葡萄糖醛酸和N-乙酰氨基-D-葡萄糖单体[11]。HA 广泛存在于人体器官和组织,具有良好的生物相容性、生物降解性、无免疫原性等特点,在皮肤再生、药物递送、组织工程等领域应用较广[12]。HA 分子中的羧基可通过离子吸附负载带正电荷的药物,实现微球材料的载药性能[13]。
本研究以HA 为主要基质,制备并表征了一种可降解、可载药的栓塞微球,预期用于TACE,为临床提供一种可生物降解的化疗栓塞微球新方案。
1 仪器与试药
1.1 仪器
RW20 Digital 机械搅拌器,RCT basic 磁力搅拌器(德国艾卡公司);CP214 电子分析天平(上海奥豪斯仪器有限公司);E200 光学显微镜(日本尼康公司);Ultra Plus 扫描电子显微镜(德国蔡司公司);TENSOR27 红外光谱仪,UV-3600 紫外-分光光度计(日本岛津公司);THZ-100B 恒温培养摇床(上海一恒科学仪器有限公司);AXS D8 X-射线衍射仪(德国布鲁克公司)。
1.2 试药
1,4-丁二醇二缩水甘油醚(BDDE,阿拉丁生化科技有限公司);透明质酸(MW=20~40 kDa,麦克林生化科技有限公司);液体石蜡(化学纯,上海凌峰化学试剂有限公司);司盘80(化学纯,南京化学股份有限公司);阿霉素(Dox,南京奥多福尼生物有限公司);戊二醛(50 wt%,上海梯希爱化成工业有限公司);生理盐水(安徽双鹤药业);无水乙醇等试剂均为分析纯,购于上海泰坦有限公司。
2 方 法
2.1 微球制备
改性透明质酸微球(BDDE-modified hyaluronic acid microspheres,BHAMs):用移液枪吸取BDDE 46 μL 注入圆底烧瓶,加入0.2 mol·L-1氢氧化钠溶液10 mL 活化,随后加入HA 1.0 g,50℃加热反应2 h合成交联HA。在文献[14,15]和预实验的基础上,采用改进的W/O 乳化交联法制备微球。将上述交联HA置于20 mL 纯水中,加热溶解,制备成水相。将水相加入80 mL 含司盘80 的液体石蜡中,机械搅拌乳化40 min,形成油包水乳液。冷却至室温,加入少量的戊二醛继续固化。用无水乙醇洗涤,真空干燥12h,即得HA 微球(HAMs)。同时制备非交联的HAMs。
阿霉素载药透明质酸微球(doxorubicin-loaded BHAMs,DHAMs):取BHAMs 45 mg 置于1.5 mL 离心管内,加入1 mL 浓度为10 mg·mL-1的阿霉素溶液,室温下摇匀,静置12 h 即得。
2.2 形态观察
取少量BHAMs 置于光学显微镜下,观察微球的形态特征和分散性,是否有粘连、破损和其他杂质;微球样品溅射镀金处理以获得导电性,随后置于扫描电子显微镜下评估其微观形貌[16]。
2.3 粒径测定
取少量BHAMs,放置在载玻片上摊平,使用装配有目镜测微尺的光学显微镜随机测量200 个微球的直径,以频率直方图描述尺寸分布[7],采用粒径分布系数表征微球分散特性。
式中,D90、D10和D50分别为微球粒径分布图中频率百分数90%、10%和50%处对应的粒径值。分布系数值越小,微球粒径分布越窄,单分散性越好。
2.4 溶胀率
取BHAMs 浸泡在适量生理盐水中,静置,分别于0.25、0.5、1、2、3、5、7、14、21、36 h 后取出,用注射器尽量吸除生理盐水。随后,溶胀微球置于光学显微镜下,使用目镜测微尺随机测量200 个微球的直径,按如下公式计算溶胀率。
2.5 体外降解
精确称取HAMs 和BHAMs 微球各100mg,置于25 mL 具塞试管,加入pH 7.4 磷酸盐缓冲液10 mL。随后将具塞试管密封后放置在恒温摇床上(37℃,100 r·min-1)。分别于1、3、5、7、14、21、42 和60 d 取出样品,抽滤,转移至扁形称量瓶,50℃真空干燥5 h。干燥后称重,并计算微球降解率。两种微球各平行测定3 个样品。
2.6 载药性能表征
2.6.1 阿霉素标准曲线的建立 精确称取阿霉素10 mg,加入生理盐水配制成10 mg·mL-1的阿霉素对照品储备液。取阿霉素对照品储备液,加生理盐水稀释,分别得到250、125、62.5、31.25、15.625、7.812 5 μg·mL-1的阿霉素对照品溶液。用紫外-可见分光光度计测定490 nm 处吸光度。以阿霉素的浓度为X 轴,吸光度为Y 轴绘制标准曲线。
2.6.2 载药量和包封率测定 按照上述DHAMs 制备方法,载药完成后,将各离心管置于低速离心机,离心5 min(1500 r·min-1),分离上清液并用少量生理盐水洗涤微球,直至洗涤液无色透明,合并上清液和洗涤液至10 mL 容量瓶,加生理盐水定容,摇匀,采用紫外-可见分光光度计测吸光度。用上述标准曲线方程计算溶液中阿霉素的量,按如下公式计算载药量和包封率。
2.6.3 FTIR 分析 采用溴化钾压片法测定各样品的红外光谱。分别取1 mg 左右的BHAMs、DHAMs、Dox 及Dox 和BHAMs 物理混合物,用溴化钾压成薄片后放在测试平台,扫描范围4000~400 cm-1。
2.6.4 PXRD 分析分别取BHAMs、DHAMs、Dox及Dox 和BHAMs 物理混合物进行PXRD 分析。测试条件:Cu 靶,Kα1 射线(λ=1.5406Å),电压40 kV,电流40 mA;发射狭缝1/8°,防散射狭缝1/4°;防散射狭缝7.5 mm,2θ 范围:3°~40°,步长0.02°。
2.6.5 阿霉素的体外释放 取3 份载药微球(干燥重量45 mg),分别放入锥形瓶中,加入生理盐水20 mL,将锥形瓶放置在恒温摇床(37℃,100 r·min-1)。分别于0.25、0.5、1、2、4、8、10、12、24、36、48、60、72 h 吸取上清液1 mL,并加入等量新鲜的生理盐水。采用紫外-分光光度计测定每个时间点上清液阿霉素浓度,按如下公式计算阿霉素累积释放率。
式中,Cn为n 次采样后释放介质中的Dox 浓度,Ci为第1 次至(n-1)次采样的Dox 浓度,V0为药物释放介质的初始体积(20 mL),V 为采样体积(1mL),W 为微球中的Dox 质量。
3 结果
3.1 微球形态和粒径
通过乳化交联法成功制备BHAMs。光学显微镜下,干燥微球呈棕黄色,形态圆整,分散性较好,视野内基本无破损或粘连。经水溶胀后,微球为表面光滑、半透明状的规则球形(图1)。扫描电镜显示出微球的光滑表面结构(图2)。

图1 BHAMs的干燥微球(A)及溶胀微球(B)光学显微镜图(×40)

图2 BHAMs 的扫描电子显微镜图
图3 所示,微球的粒径分布图近似正态分布,说明粒径较均匀。空白微球的平均粒径为(111.83±12.21)μm,粒径分布系数为0.49,尺寸分布较窄。本批次微球用于之后的各项实验。
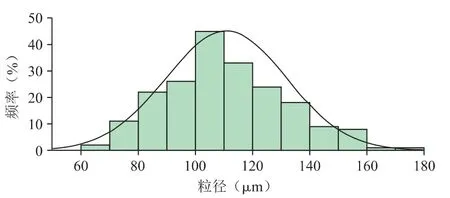
图3 BHAMs 的粒径分布图
3.2 溶胀率
室温下测试了BHAMs 的动态溶胀,得到微球36 h 内的溶胀变化图(图4)。从图中可以看出,BHAMs 达到完全溶胀的时间较长,且溶胀率随时间呈阶梯状增加,21 h 之后基本不再变化。HAMs 初始溶胀率(0.25 h)为152.61%,21 h 溶胀率达到199.04%,36 h 时最终溶胀率为201.81%。
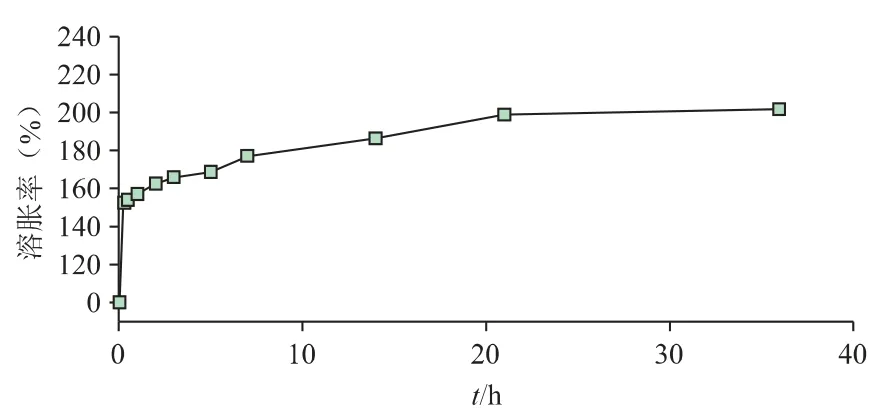
图4 BHAMs 的动态溶胀曲线图
3.3 体外降解
在37℃下,测定HAMs 和BHAMs 56 d 内的降解率,得到两种微球的体外降解曲线。从图5 可看出,HAMs 可在21 d 左右完全降解,而BHAMs 可随降解时间的增加而缓慢降解。7 d 后BHAMs 的降解率为20.47%,随后保持缓慢速率继续降解,56 d 后仍有65.69%剩余。以上结果表明BDDE 的交联增加了HA 的抗降解能力。

图5 BHAMs 和HAMs 的体外降解图(n=3)
3.4 载药量和包封率
阿霉素的的标准曲线线性拟合方程为Y=0.009 6X+0.081 5(r2=0.999 9)。平行测定3 组样品,最终得微球的平均载药量和包封率分别为(22.09%±0.05%)和(99.41%±0.21%)。由结果可知,45 mg 左右的微球可载药10 mg,基本满足了栓塞微球对载药量的要求(一次性栓塞5~45 mg)[9]。
3.5 FT-IR 分析
图6 比较了BHAMs、DHAMs、Dox 及Dox 和BHAMs 物理混合物的FT-IR 图。HAMs 峰形较为明显的为透明质酸羧酸根C=O 伸缩振动(1610 cm-1和1415 cm-1)[17]。对比DHAMs 和两者物理混合物的图谱,DHAMs 中Dox 的-NH3+伸缩振动与HA 羧酸根C=O 伸缩振动缺失,提示Dox 质子化的氨基与HA 羧酸根之间存在离子络合,证实了微球通过离子吸附负载Dox。另一方面,DHAMs 和Dox 的羧基和羟基基团特征峰的消失提示微球和药物之间存在氢键作用力。

图6 BHAMs、DHAMs、Dox 及Dox 和BHAMs 物理混合物FT-IR 图
3.6 PXRD 分析
Dox 主要的2θ 衍射峰为13.04°、14.80°、16.67°、17.59°、18.36°、19.32°、20.63°、21.94°等,提示原料药Dox 以特定的晶体形态存在;Dox 和BHAMs 物理混合物的PXRD 图谱中,Dox 的特征衍射峰基本存在;BHAMs 和DHAMs 的PXRD 图中未见特征衍射峰,而是一些无序结构的驼形峰,提示DHAMs 中的药物存在形式为无定形态(图7)[18]。
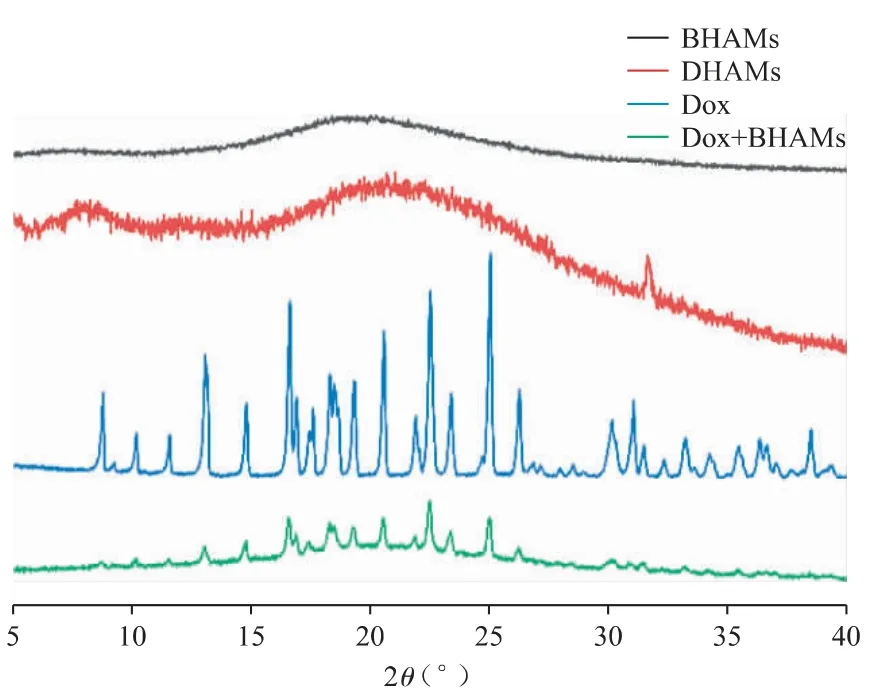
图7 BHAMs、DHAMs、Dox 及Dox 和BHAMs 物理混合物的PXRD 图
3.7 阿霉素体外释放率
DHAMs 体外药物累积释放曲线如图8 所示。第一阶段(0~2h)是药物的突释,2h 释放量为(39.96%±6.39%),这一部分药物吸附在微球的最表面,由浓度差导致释放。第二阶段为缓慢释放(2~72 h),此时微球对阿霉素的吸附作用和扩散作用逐渐达到动态平衡,72 h 释药量为(51.40%±5.89%)。剩余药物可在微球降解过程中持续释放。
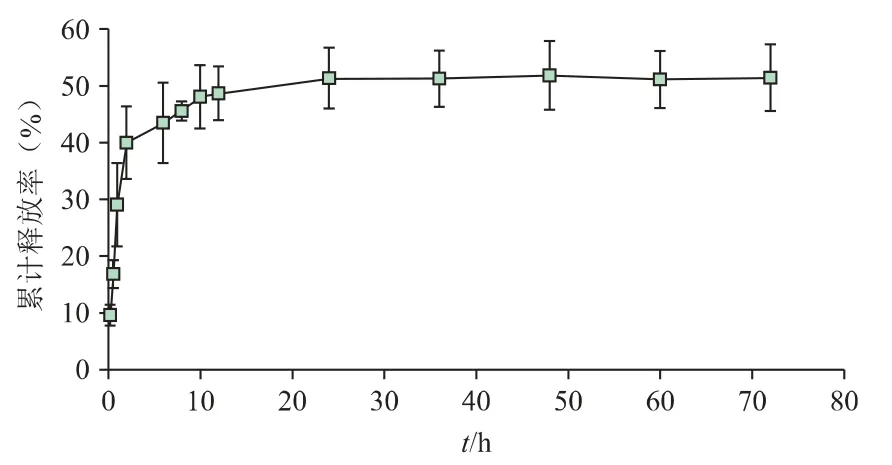
图8 DHAMs 中Dox 体外释放曲线(n=3)
4 讨论
本研究使用BDDE 交联HA 制备的微球成球性良好,各项性能包括粒径范围、载药量和包封率等均满足TACE 的需求。透明质酸微球主要通过羧酸根离子吸附带正电荷的药物。FT-IR 和PXRD 分析可知,阿霉素主要以无定形态通过离子键和氢键作用力吸附于微球表面,药物不与微球表面发生化学反应。体外释药实验结果表明,阿霉素可在短时间内释药,同时由于HA 本身的生物可降解性,剩余药物可在微球降解后缓慢持续释放。综上所述,透明质酸微球有较好的载阿霉素性能,理化性能良好,具有良好的动脉化疗栓塞应用前景。
