基于神经活性配体受体交互作用探讨党参-茯苓配伍改善痴呆小鼠学习记忆能力的作用机制
2023-11-30魏江平赵子瑄曾静陈丽云花雷阳勇张小梅国家中医药管理局中药化学三级实验室重庆市中药研究院重庆400065重庆医科大学重庆40006川渝共建慢病中药新药泸州市重点实验室四川泸州646000
魏江平,赵子瑄,曾静,陈丽云,花雷,阳勇,3,张小梅,3(.国家中医药管理局中药化学三级实验室,重庆市中药研究院,重庆 400065;2.重庆医科大学,重庆 40006;3.川渝共建慢病中药新药泸州市重点实验室,四川 泸州 646000)
衰老是痴呆症如阿尔茨海默病(Alzheimer’s disease,AD)的首要风险因素[1]。《黄帝内经》[2]中述“女子五七,阳明脉衰”,表明人体衰老始于阳明脉,因脾胃相表里,故常常胃病及脾、脾病及胃。
绝大部分痴呆症患者的中医病证与脾相关,如痰郁结证、痰浊阻窍证等[3]。擅于豁痰化湿的石菖蒲、补中益气的黄芪、健脾除湿的茯苓、补脾益气的党参和健脾燥湿的白术等都是治疗痴呆症的常用中药[4]。许多调理脾运的名方如还少丹[5-6]等也具有明确的抗痴呆作用。著名医家陈士铎将从脾论治痴呆症高度概括为“治呆无奇法,治痰即治呆”,因脾为生痰之源,故调理脾运康健是治疗痴呆症的一项重要策略。
党参是补益脾胃的常用中药,《本草正义》[7]记载“党参力能补脾养胃……宜乎五脏交受其养,而无往不宜也”,高度评价其功效与人参相似而药性更宜于补养五脏。茯苓为利水渗湿要药,《本草正》[8]曰“能利窍去湿,利窍则开心益智;去湿则逐水燥脾,补中健胃”,是临床应用和实验研究治疗痴呆的最常用药物之一[4]。《中药部颁标准》[9]中收录含党参的386个中成药,有51.3%都与茯苓配伍,其中有34个用于治疗失眠健忘、怔忡健忘、惊悸健忘以及记忆力减退等病证,说明党参-茯苓配伍可能是调理脾运而治疗痴呆症的核心药对。
D-半乳糖诱导的亚急性衰老动物可表现出神经、免疫(脾脏)及多器官功能退化,涉及能量代谢、氧化应激、免疫炎症等多种生物学机制[10],是用于衰老和痴呆症的动物模型[11-13]之一。
本研究拟以D-半乳糖诱导的痴呆模型小鼠为研究载体,结合网络药理学分析和实验验证考察党参-茯苓配伍抗痴呆的作用及潜在机制。
1 材料与方法
1.1 实验动物50 只SPF 级雄性昆明种小鼠,6 周龄,体质量(20 ± 2)g,由湖南斯莱克景达实验动物有限公司提供,生产许可证号:SCXK(湘)2019-0004,动物合格证号为:430727220100313743。实验动物饲养于重庆市中药研究院实验动物研究所,实验场所温度21~25 ℃,湿度60%~70%,使用许可证号:SYXK(渝)2022-0006,所有动物均可自由摄取符合实验动物要求的饲料和饮水。本研究动物实验内容由重庆市中药研究院实验动物福利伦理审查委员会审查批准,批准号:YHS2021-03。
1.2 药物及试剂党参和茯苓均购于重庆上药慧远药业有限公司,批号依次为:201201、201101,二者分别经重庆市中药研究院中药生药研究所瞿显友研究员鉴定为桔梗科植物党参Codonopsispilosula(Franch.)Nannf.的干燥根和多孔菌科真菌茯苓Poria cocos(Schw.)Wolf的干燥菌核。取党参和茯苓饮片各100 g,依次加水8、6、4 倍,加热提取3 次,每次0.5 h,滤过,合并滤液,浓缩至250 mL(0.8 g·mL-1),冷藏备用。Biosharp D-半乳糖,广州硕谱生物科技有限公司,批号:21161745;盐酸多奈哌齐片,日本卫材(中国)药业有限公司,批号:2105147;抗-IBA1 抗体、抗- GFAP 抗体和抗-synaptophysin 抗体,英国Abcam 公司,批号分别为:GR3335980-19、GR3405106-1和GR334010107-11;抗-GluR2抗体、抗-GR 抗体、抗-CHRM1 抗体、抗-CHRNB2 抗体、抗-5-HT1A 抗体、DAPI 和抗荧光淬灭封片剂,武汉赛维尔生物科技有限公司,批号依次为:AC230301014、AC230301026、AC230301045、AC230 301050、 AC230301044、 CR2301022、 CR2301023。白术内酯Ⅲ(标准品),成都普思生物科技股份有限公司,批号:PS010512;猪苓酸C(标准品),成都德思特生物技术有限公司,批号:DST200114-043;TNF-α和IL-10 ELISA试剂盒,杭州联科生物技术有限公司,批号分别为:A38220115、A31010322;谷氨酸测试盒,南京建成生物工程研究所,批号:20220715;其余试剂均为国产分析纯。
1.3 主要仪器MP30KC 电子天平,上海舜字恒平科学仪器有限公司;BSA224S电子天平(万分之一),赛多利斯科学仪器(北京)有限公司;UPR-Ⅱ-20L超纯水机,四川优普超纯科技有限公司;Heraeus Pico 17离心机,美国Thermo Electron公司;SPD-M20A高效液相色谱仪,日本岛津公司;Morris 水迷宫分析系统,荷兰Noldus公司;JB-P5包埋机,武汉俊杰电子有限公司;RM2016病理切片机,上海徕卡仪器有限公司;E100 显微镜和Nikon DS-U3 成像系统,日本尼康公司。
1.4 网络药理学分析在中医百科全书(ETCM,http://www.tcmip.cn/ETCM/)和中药系统药理学分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)中进行党参和茯苓的成分检索,前者以药物相似性分级Moderate 和Good 为标准,而后者以口服生物利用度(OB)>30%、类药性(DL)>0.18 为标准筛选党参和茯苓的活性成分及其靶点,并用Cytoscape 软件构建成分-靶点网络图。在DisGeNET 平台(https://www.disgenet.org/)中查找AD的相关靶点(EI=1),然后获取党参-茯苓成分靶点和AD靶点交集,并运用STRING数据库(https://cn.string-db.org/)对其进行KEGG 通路富集分析(最低要求互动得分为0.900)。
1.5 质量控制取“1.2”项下中党参-茯苓浓缩液5 mL以12 000×g离心5 min,经0.22 μm有机微孔滤膜过滤,备用。精密称量适量猪苓酸C和白术内酯Ⅲ标准品,分别加适量甲醇配成1 mg·mL-1和2 mg·mL-1的标准溶液。采用Diamonsil Plus C18色谱柱(4.6 mm×250 mm,5 μm),流动相乙腈-0.05 %磷酸,梯度洗脱,体积流量1 mL·min-1,柱温30 ℃,检测波长为220、240 nm,测定党参-茯苓水煎液中猪苓酸C 和白术内酯Ⅲ的含量分别为77.22 、0.96 μg·g-1。
1.6 用药剂量《中华人民共和国药典》[14]中党参人日用量为9~30 g 生药,茯苓为9~15 g 生药,本研究以两者在《中药部颁标准》[9]最常用的1∶1 配伍,各取15 g,即人日用量总计30 g。根据“人和小鼠间按体表面积折算等效剂量比值表”换算得小鼠党参-黄芪的人日用临床等效剂量为4.5 g·kg-1,扩大1 倍即9 g·kg-1设为高剂量;得小鼠盐酸多奈哌齐的人日用临床等效剂量为1.5 mg·kg-1。
1.7 分组与给药将50 只雄性昆明种小鼠按体质量随机分为空白组、模型组、盐酸多奈哌齐组(1.5 mg·kg-1)及党参-茯苓高(9 g·kg-1)、低(4.5 g·kg-1)剂量组,每组10 只。根据各小鼠体质量每天灌胃给予对应药物1 次,空白组和模型组小鼠给予等体积纯净水(10 mL·kg-1),连续灌胃30 d。同时,对每只小鼠颈背部皮下注射D-半乳糖(200 mg·kg-1)复制痴呆小鼠模型[15],空白组小鼠则在颈背部注射等体积生理盐水,注射体积10 mL·kg-1,连续30 d。
1.8 Morris 水迷宫给药第25 天至第30 天采用Morris 水迷宫实验对各组小鼠进行行为学检测[16]。隐藏平台实验将所有小鼠分别从面朝池壁的同一定点依次放入池中,记录各小鼠2 min内的逃避潜伏期为考察指标。隐藏平台实验结束后撤去平台,将所有小鼠分别从上述同一定点依次放入池中,以各组动物平台象限停留时间、穿越平台象限和平台次数为空间探索实验评价指标。
1.9 海马区HE 染色水迷宫实验后脱颈椎处死小鼠,冰上分取左半脑置于4%的多聚甲醛中固定,剩余部分锡箔纸包裹,置液氮中保存。固定组织包埋后进行常规石蜡切片,HE染色处理后置于显微镜下观察海马区的病理形态学改变,并进行损伤的神经细胞评分[17]。
1.10 免疫荧光检测Synaptophysin、IBA1、GFAP、GluR2、GR、CHRM1、CHRNB2 和5-HT1A 的表达将包埋好的脑组织切成5 μm 薄片后进行脱蜡处理,采用PBS 清洗后再将切片浸入5% Triton-X-100 室温通透10 min,然后滴加10%山羊血清封闭30 min。滴加一抗孵育过夜(4 ℃),PBS 洗3 次然后滴加生物素化二抗,37 ℃孵育30 min 然后滴加DAPI 室温孵育10 min;PBS清洗后使用抗荧光衰减封片剂封片。采用ImageJ 图像分析系统测定所采集全部图像的阳性面积或平均荧光强度。
1.11 谷氨酸、TNF-α 和IL-10 含量检测根据各试剂盒说明书要求取液氮保存的脑组织样本制备检测样本,然后按照说明书要求依次测定谷氨酸、TNF-α和IL-10的含量。
1.12 统计学处理方法计量资料采用均值±标准差(±s)表示,其中Morris水迷宫的逃避潜伏期采用双因素(Two-way ANOVA)方差分析;其余计量资料采用单因素(One-way ANOVA)方差分析,方差齐则采用Tukey多重比较分析,方差不齐则采用Tamhane T2多重比较分析。P<0.05表示差异有统计学意义。
2 结果
2.1 党参-茯苓配伍治疗AD 的网络药理学分析如图1 和表1所示,网络药理学分析获得党参-茯苓药对的有效成分67 个、靶点375 个。获得AD 疾病靶点3 052 个,将其与药物靶点交集得到党参-茯苓治疗AD 的共同靶点187 个,对其进行KEGG 富集分析得到111 条与AD 疾病相关信号通路,其中优势通路包括神经活性配体受体相互作用、cAMP 信号通路、钙信号通路等。

表1 党参-茯苓配伍治疗阿尔茨海默病(AD)的KEGG 信号通路分析(前10 位)Table 1 Analysis of KEGG signal pathway of Radix Codonopsis and Poria in the treatment of AD(top 10)
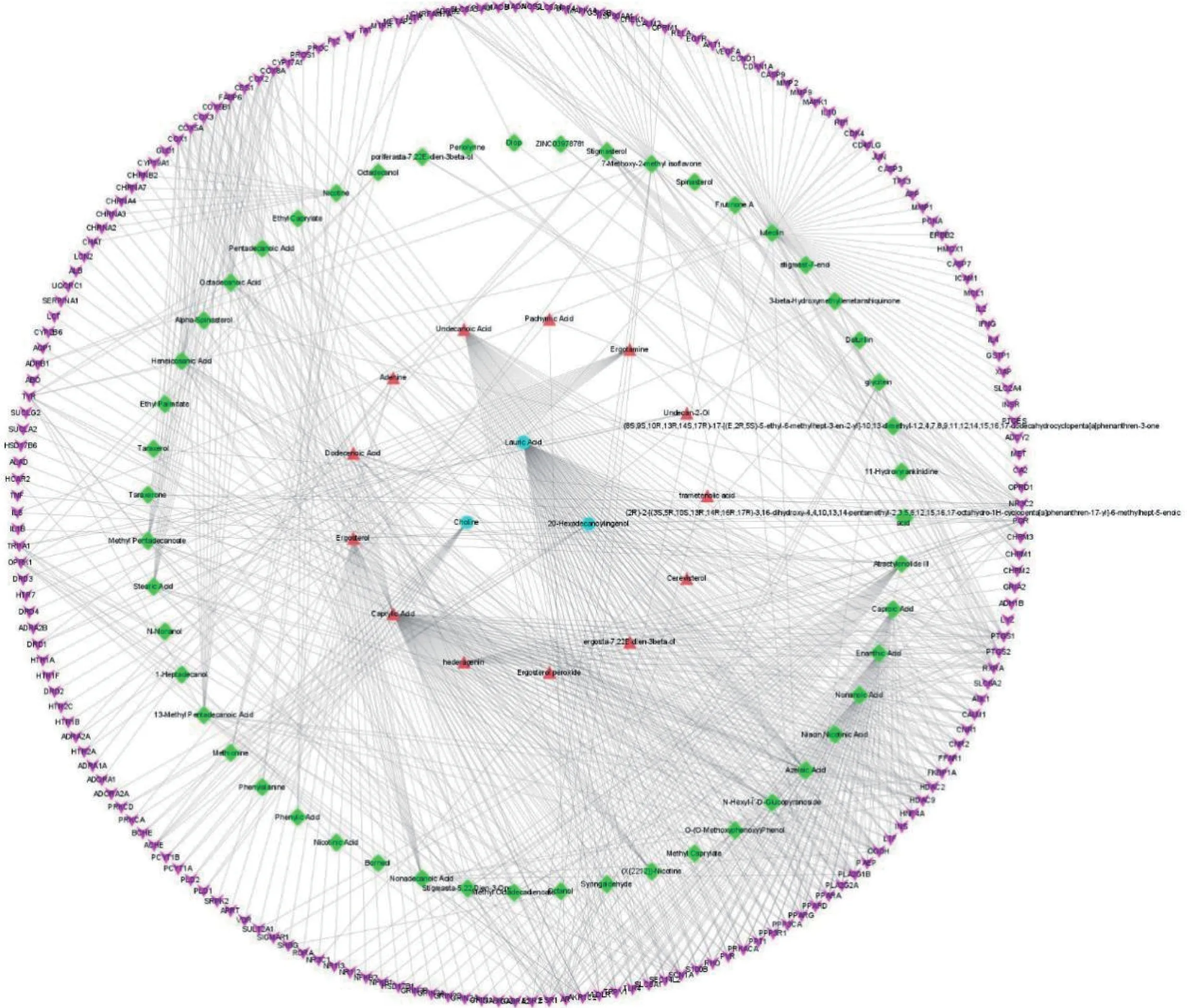
图1 党参-茯苓治疗阿尔茨海默病(AD)的成分-靶点网络图Figure 1 The network diagram of active components of Radix Codonopsis and Poria-AD targetz
2.2 党参-茯苓配伍对D-半乳糖诱导小鼠学习记忆的影响如表2、表3所示,在隐藏平台实验中,随着训练时间的增加,从第4天起除模型组外各组小鼠的逃避潜伏期均明显下降(P<0.05,P<0.01,P<0.001)。与空白组比较,模型组小鼠第5 天逃避潜伏期明显增加(P<0.01),说明造模成功;与模型组比较,党参-茯苓高(P<0.01)、低(P>0.05)剂量组小鼠的逃避潜伏期均缩短,但仅高剂量组的差异有统计学意义。在空间探索实验中,与空白组比较,模型组小鼠平台象限停留时间、穿越平台次数和游泳平均速度均下降,且前两者的差异有统计学意义(P<0.05);与模型组比较,党参-茯苓高、低剂量组小鼠的平台象限停留时间、穿越平台次数和游泳平均速度均升高,其中平台象限停留时间的差异有统计学意义(P<0.05)。以上数据提示党参-茯苓配伍能够提高D-半乳糖诱导的痴呆模型小鼠的学习记忆能力。
表2 党参-茯苓配伍对D-半乳糖诱导小鼠逃避潜伏期的影响(±s,n=10)Table 2 Effect of Radix Codonopsis and Poria on the escape latency of D-galactose induced mice(±s,n=10)
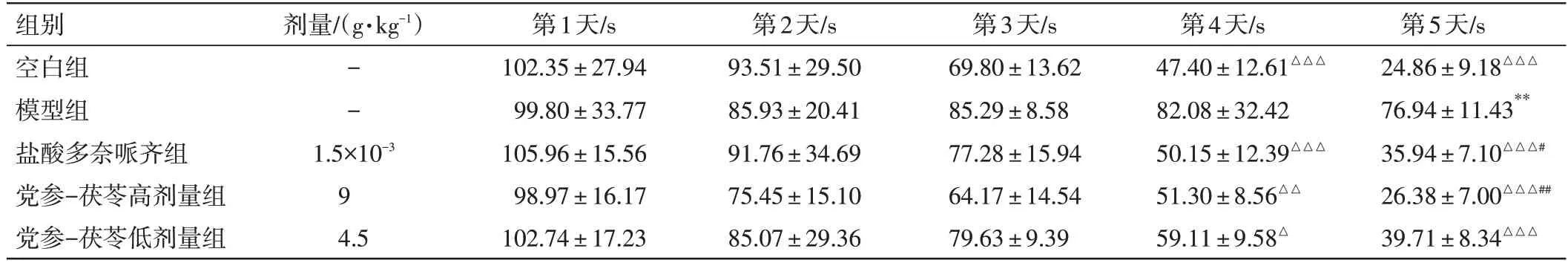
表2 党参-茯苓配伍对D-半乳糖诱导小鼠逃避潜伏期的影响(±s,n=10)Table 2 Effect of Radix Codonopsis and Poria on the escape latency of D-galactose induced mice(±s,n=10)
注:各组与自身第1天逃避潜伏期比较,△P<0.05,△△P<0.01,△△△P<0.001;与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
第5天/s 24.86±9.18△△△76.94±11.43**35.94±7.10△△△#26.38±7.00△△△##39.71±8.34△△△组别空白组模型组盐酸多奈哌齐组党参-茯苓高剂量组党参-茯苓低剂量组剂量/(g·kg-1)--1.5×10-3 9 4.5第1天/s 102.35±27.94 99.80±33.77 105.96±15.56 98.97±16.17 102.74±17.23第2天/s 93.51±29.50 85.93±20.41 91.76±34.69 75.45±15.10 85.07±29.36第3天/s 69.80±13.62 85.29±8.58 77.28±15.94 64.17±14.54 79.63±9.39第4天/s 47.40±12.61△△△82.08±32.42 50.15±12.39△△△51.30±8.56△△59.11±9.58△
表3 党参-茯苓配伍对D-半乳糖诱导小鼠空间探索能力的影响(±s,n=10)Table 3 Effect of Radix Codonopsis and Poria on spatial exploration ability of D-galactose induced mice(±s,n=10)
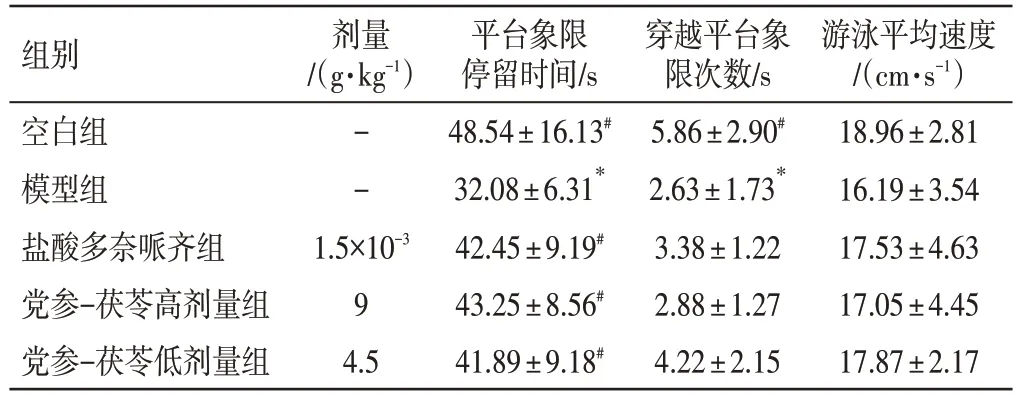
表3 党参-茯苓配伍对D-半乳糖诱导小鼠空间探索能力的影响(±s,n=10)Table 3 Effect of Radix Codonopsis and Poria on spatial exploration ability of D-galactose induced mice(±s,n=10)
注:与空白组比较,*P<0.05;与模型组比较,#P<0.05
游泳平均速度/(cm·s-1)18.96±2.81 16.19±3.54 17.53±4.63 17.05±4.45 17.87±2.17组别空白组模型组盐酸多奈哌齐组党参-茯苓高剂量组党参-茯苓低剂量组剂量/(g·kg-1)--1.5×10-3 9 4.5平台象限停留时间/s 48.54±16.13#32.08±6.31*42.45±9.19#43.25±8.56#41.89±9.18#穿越平台象限次数/s 5.86±2.90#2.63±1.73*3.38±1.22 2.88±1.27 4.22±2.15
2.3 党参-茯苓配伍对D-半乳糖诱导小鼠海马病理形态学的影响如图2和表4所示,空白组小鼠海马细胞排列整齐紧密,层次分明,细胞结构清晰可见。与空白组比较,模型组小鼠海马神经细胞散乱排列(红色箭头)、部分细胞缺失、细胞间间隙变大(蓝色箭头)并可见神经细胞细胞核固缩、变性或死亡(黄色箭头),受损神经细胞的评分明显升高,差异有统计学意义(P<0.01),提示造模成功。与模型组比较,党参-茯苓高、低剂量组小鼠海马神经细胞排列相对整齐、紧密,细胞结构清晰,偶可见个别神经细胞变性或死亡,受损神经细胞的评分均明显降低,差异有统计学意义(P<0.01)。以上结果表明党参-茯苓配伍可改善小鼠海马病理形态学改变。
表4 党参-茯苓配伍对D-半乳糖诱导的小鼠海马受损神经细胞评分的影响(±s,n=6)Table 4 Effect of Radix Codonopsis and Poria on scores of hippocampus damaged nerve cells injured neurons in D-galactose induced mice(±s,n=6)

表4 党参-茯苓配伍对D-半乳糖诱导的小鼠海马受损神经细胞评分的影响(±s,n=6)Table 4 Effect of Radix Codonopsis and Poria on scores of hippocampus damaged nerve cells injured neurons in D-galactose induced mice(±s,n=6)
注:与空白组比较,**P<0.01;与模型组比较,#P<0.05,##P<0.01
海马受损神经细胞评分/分0.58±0.19 1.60±0.37**1.07±0.17#0.75±0.25##0.92±0.19##组别空白组模型组盐酸多奈哌齐组党参-茯苓高剂量组党参-茯苓低剂量组剂量/(g·kg-1)--1.5×10-3 9 4.5
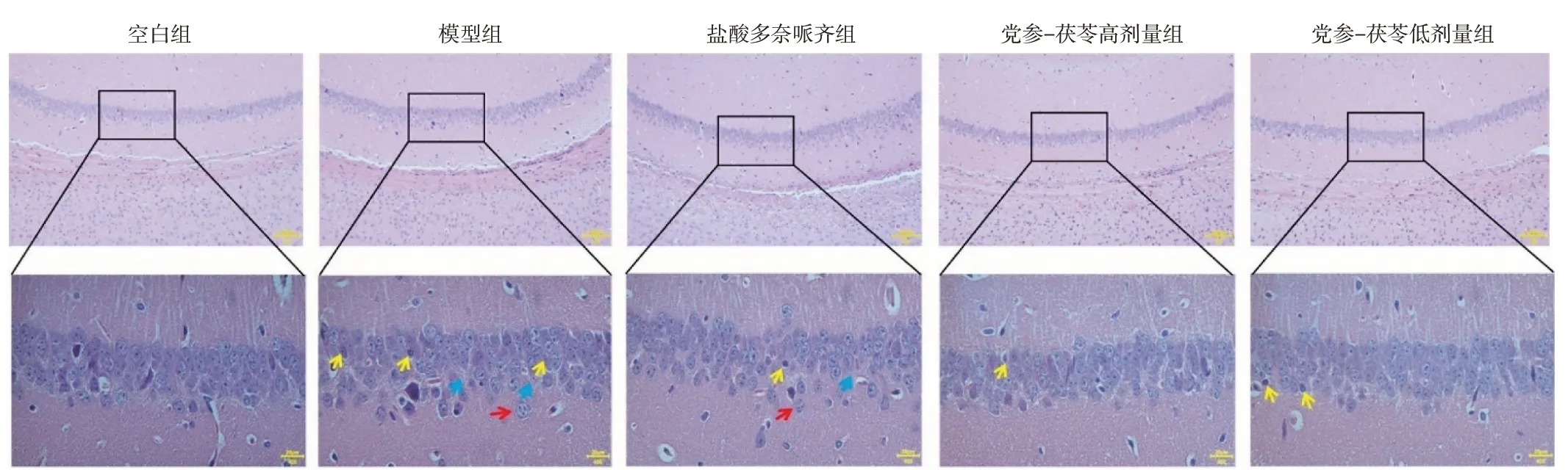
图2 党参-茯苓配伍对D-半乳糖诱导小鼠海马病理形态学的影响(HE 染色,×100,×400)Figure 2 Effect of Radix Codonopsis and Poria on pathomorphology of hippocampus in D-galactose induced mice(HE staining,×100,×400)
2.4 党参-茯苓配伍对D-半乳糖诱导的小鼠海马Synaptophysin、IBA1 和GFAP 表达的影响如图3和表5所示,与空白组比较,模型组小鼠海马IBA1和GFAP阳性表达面积均升高,且差异有统计学意义(P<0.001,P<0.01);Synaptophysin 阳性表达面积降低,但差异无统计学意义(P>0.05)。与模型组比较,党参-茯苓高、低剂量组小鼠海马IBA1 和GFAP阳性表达面积均明显降低,且差异有统计学意义(P<0.05,P<0.001);海马Synaptophysin 阳性表达面积升高,但差异无统计学意义(P>0.05)。以上表明党参-茯苓配伍可降低痴呆模型小鼠脑内小胶质细胞和星形胶质细胞的活化状态,而对神经突触无明显影响。
表5 党参-茯苓配伍对D-半乳糖诱导小鼠海马IBA1、GFAP 和Synaptophysin 表达面积的影响(±s,n=6)Table 5 Effect of Radix Codonopsis and Poria on the expression areas of IBA1,GFAP and Synaptophysin in hippocampus of mice induced by D-galactose(±s,n=6)
表5 党参-茯苓配伍对D-半乳糖诱导小鼠海马IBA1、GFAP 和Synaptophysin 表达面积的影响(±s,n=6)Table 5 Effect of Radix Codonopsis and Poria on the expression areas of IBA1,GFAP and Synaptophysin in hippocampus of mice induced by D-galactose(±s,n=6)
注:与空白组比较,**P<0.01,***P<0.001;与模型组比较,#P<0.05,##P<0.01,###P<0.001
Synaptophysin/%48.06±6.23 45.60±6.59 49.80±7.11 48.53±5.37 49.26±7.90组别空白组模型组盐酸多奈哌齐组党参-茯苓高剂量组党参-茯苓低剂量组剂量/(g·kg-1)--1.5×10-3 9 4.5 IBA1/%2.18±0.47 3.49±1.13***1.91±0.61###1.49±0.38###1.78±0.22###GFAP/%1.02±0.28 1.53±0.46**1.24±0.38 1.04±0.17#0.86±0.14###
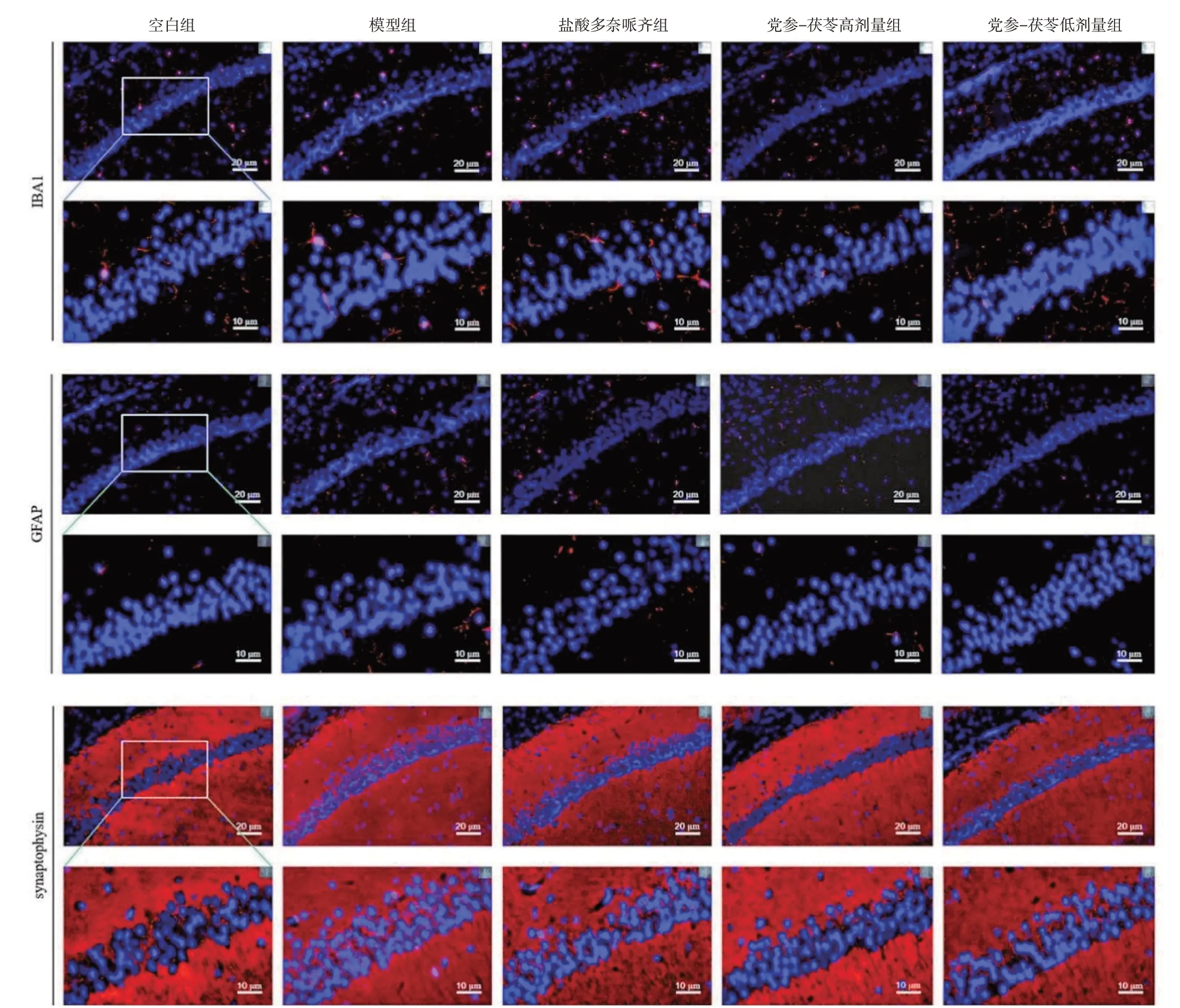
图3 免疫组化法检测各组小鼠海马IBA1、GFAP 和Synaptophysin 的表达(免疫组化法,×400,×1 000)Figure 3 The expressions of IBA1,GFAP and Synaptophysin in the hippocampus of each group detected by immunohistochemical method(IF,×400,×1 000)
2.5 党参-茯苓配伍对D-半乳糖诱导的小鼠海马GluR2、GR、CHRM1、CHRNB2 和5-HT1A 蛋白表达的影响如图4、图5 和表6所示。与空白组比较,模型组小鼠海马GluR2、CHRM1 和CHRNB2 的平均荧光强度均明显降低,而GR的平均荧光强度升高,差异均有统计学意义(P<0.05,P<0.01);与模型组比较,党参-茯苓高、低剂量组小鼠海马GluR2、CHRM1、CHRNB2 和5-HT1A 的平均荧光强度均明显升高,而GR的平均荧光强度明显降低,差异均有统计学意义(P<0.05,P<0.01,P<0.001)。
表6 党参-茯苓配伍对D-半乳糖诱导小鼠海马GluR2、GR、CHRM1、CHRNB2 和5-HT1A 平均荧光强度的影响(±s,n=6)Table 6 Effect of Radix Codonopsis and Poria on the average fluorescence intensity of GluR2,GR,CHRM1,CHRNB2 and 5-HT1A in hippocamups of mice induced by D-galactose(±s,n=6)
表6 党参-茯苓配伍对D-半乳糖诱导小鼠海马GluR2、GR、CHRM1、CHRNB2 和5-HT1A 平均荧光强度的影响(±s,n=6)Table 6 Effect of Radix Codonopsis and Poria on the average fluorescence intensity of GluR2,GR,CHRM1,CHRNB2 and 5-HT1A in hippocamups of mice induced by D-galactose(±s,n=6)
注:与空白组比较,*P<0.05,**P<0.01;与模型组比较,#P<0.05,##P<0.01,###P<0.001
5-HT1A 7.72±3.19 3.79±1.44 5.03±3.64 12.62±3.68#16.56±4.71#组别空白组模型组盐酸多奈哌齐组党参-茯苓高剂量组党参-茯苓低剂量组剂量/(g·kg-1)--1.5×10-3 9 4.5 GluR2 3.23±1.19##1.64±0.13**2.04±0.38 2.31±0.20#2.54±0.27##GR 2.67±0.49##4.38±0.87**3.57±0.17 2.33±0.36##2.08±0.22###CHRM1 5.34±0.40#4.59±0.10*2.46±0.78###5.62±0.65#5.67±0.87#CHRNB2 4.16±1.09#2.25±0.84*2.29±0.11 4.57±1.40#4.70±1.69##
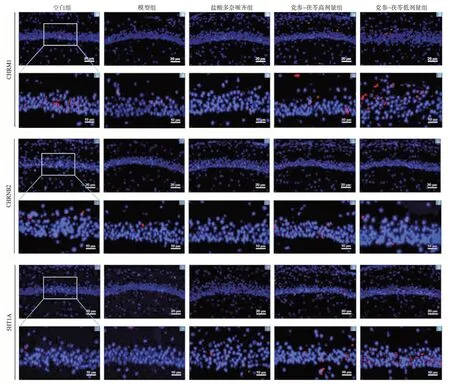
图5 免疫组化法检测各组小鼠海马CHRM1,CHRNB2 和5-HT1A 蛋白的表达(免疫组化法,×400,×1 000)Figure 5 The protein expressions of CHRM1,CHRNB2 and 5-HT1A in hippocampus of each group detected by immunohistochemical method(IF,×40,×1 000)
2.6 党参-茯苓配伍对D-半乳糖诱导小鼠脑组织谷氨酸、TNF-α 和IL-10 含量的影响如表7所示,与空白组比较,模型组小鼠脑组织谷氨酸、TNF-α 的含量均明显升高,而IL-10含量则明显降低,差异均有统计学意义(P<0.05,P<0.001);与模型组比较,党参-茯苓高、低剂量组小鼠脑组织谷氨酸、TNF-α 的含量均明显降低,而IL-10 含量则明显升高,差异均有统计学意义(P<0.05,P<0.001)。
表7 党参-茯苓配伍对D-半乳糖诱导小鼠脑组织谷氨酸、TNF-α 和IL-10 含量的影响(±s,n=6)Table 7 Effect of Radix Codonopsis and Poria compatibility on the concentrations of glutamate,TNF-α and IL-10 in brain tissue of mice induced by D-galactose(±s,n=6)
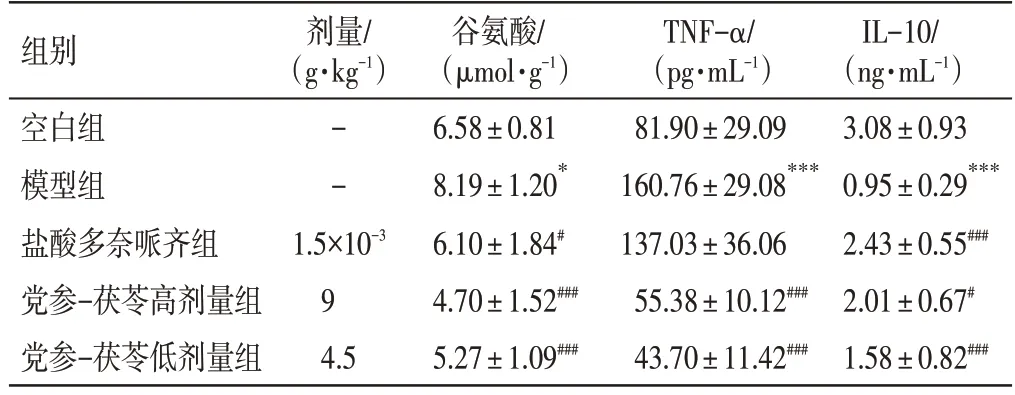
表7 党参-茯苓配伍对D-半乳糖诱导小鼠脑组织谷氨酸、TNF-α 和IL-10 含量的影响(±s,n=6)Table 7 Effect of Radix Codonopsis and Poria compatibility on the concentrations of glutamate,TNF-α and IL-10 in brain tissue of mice induced by D-galactose(±s,n=6)
注:与空白组比较,*P<0.05,***P<0.001;与模型组比较,#P<0.05,###P<0.001
IL-10/(ng·mL-1)3.08±0.93 0.95±0.29***2.43±0.55###2.01±0.67#1.58±0.82###组别空白组模型组盐酸多奈哌齐组党参-茯苓高剂量组党参-茯苓低剂量组剂量/(g·kg-1)--1.5×10-3 9 4.5谷氨酸/(μmol·g-1)6.58±0.81 8.19±1.20*6.10±1.84#4.70±1.52###5.27±1.09###TNF-α/(pg·mL-1)81.90±29.09 160.76±29.08***137.03±36.06 55.38±10.12###43.70±11.42###
3 讨论
中药药对是中医临床用药的最小单元,两者合理配伍具有同气相求、相辅相成或相制减毒的作用[18]。基于《本草正义》[7]中党参与人参功效相似而药性更宜于补养五脏的论述,结合历代典籍中从脾病治痴呆症思路,本研究探讨了调理脾运的党参-茯苓药对能否治疗痴呆症,并借助网络药理学分析和实验验证相结合的方式初步探讨了其抗痴呆的潜在作用机制。研究结果表明,党参-茯苓配伍能够提高D-半乳糖诱导小鼠的学习记忆能力,改善海马区神经细胞排列紊乱、细胞间隙增大、变性及坏死等病变,还可改善脑组织中谷氨酸、TNF-α 和IL-10 水平。同时,网络药理学分析表明党参-茯苓治疗痴呆症主要与调节神经活性配体受体相互作用、cAMP 信号通路、钙信号通路等有关。本次研究选择最优的神经活性配体受体相互作用通路中与认知功能最相关的GluR2、GR、CHRM1、CHRNB2和5-HT1A进行验证。
GluR2是α-氨基-3-羟基-5-甲基-4-异恶唑受体(α-amino-3-hydroxy-5-methyl-4-isoxazole-propionic acid receptor,AMPAR)的重要构成亚基之一[19],缺乏GluR2 的AMPAR 则参与Ca2+介导的兴奋性毒性及神经元死亡[20]。值得注意的是,TNF-α可增加海马培养物中缺乏GluR2 的AMPAR 的表达,且具有快速和剂量依赖性特征[21]。本研究发现模型小鼠脑组织中谷氨酸和TNF-α 含量均明显升高而GluR2 的平均荧光强度则明显降低,并伴随有认知下降及神经细胞变性或坏死等病变,而经党参-茯苓干预后则促进GluR2的表达而逆转了上述病变。
GR 在海马体中参与认知障碍和神经内分泌过程[22-23],其功能失调与AD 的许多功能紊乱有关,包括神经炎症、氧化应激和兴奋性毒性等[24-25]。如长期高水平的糖皮质激素通过表达于小胶质细胞上的GR改变脑中小胶质细胞的分化、增殖和激活[26]。而在D-半乳糖诱导的衰老小鼠脑内可观察到明显的炎症因子水平升高、糖皮质激素水平及其受体mRNA 表达改变[27],这与本研究中模型小鼠脑内GFAP和IBA1阳性表达面积增加,炎症因子TNF-α含量升高及GR平均荧光强度升高较一致。但经党参-茯苓干预后能够明显逆转上述指标改变。
CHRM1和CHRNB2同为胆碱受体,前者在AD患者脑内的表达水平明显降低[28-29],后者的基因敲除小鼠的海马和新皮质可见神经元肥大、星形胶质细胞增生和小胶质细胞增生等病变[30],且老年CHRNB2基因敲除小鼠和该基因突变的患者均显示空间认知损伤症状[31]。本研究中模型组小鼠海马区CHRM1 和CHRNB2 的平均荧光强度均明显降低,伴随有IBA1和GFAP表达增加及空间认知障碍,这与上述报道较一致。而党参-茯苓组小鼠海马区CHRM1 和CHRNB2的平均荧光强度均明显升高且相关病变均明显改善。
5-HT1A 在大脑中广泛分布,但AD 患者的影像学和尸检研究都显示海马中的5-HT1A 结合减少[32-34]。5-HT1A 受体主要表达在神经元细胞体、树突和突触[35],其表达变化可间接反映突触和神经元的损失。本研究发现模型小鼠海马区Synaptophysin 阳性表达面积和5-HT1A的平均荧光强度均下降,但差异无统计学意义,这可能与本研究注射D-半乳糖的时间相对较短有关[36-37]。而党参-茯苓组小鼠海马区5-HT1A 的平均荧光强度明显升高,这与HE 染色观察到海马区神经细胞损伤结果一致。
以上研究表明党参-茯苓确实可以通过调节上述神经活性受体的表达而改善AD模型小鼠认知相关病变,但本研究缺乏对它们的配体如糖皮质激素、乙酰胆碱和5-羟色胺的含量检测等。这些激素、神经递质或氨基酸都属于中医津液内含物的范畴,归脾脏调控,后续将深入探讨党参-茯苓配伍如何通过调理脾运进而改善痴呆症,进而阐释从脾论治痴呆症的科学内涵。
