基于蛋白组学探讨消癌解毒方通过IL-6/TNF-α/STAT3通路抑制肝癌小鼠肿瘤生长的作用机制
2023-11-30孙玉侠吴勉华孙莎莎谢美萍姜泽群李文婷南京中医药大学医学院整合医学院江苏南京210023江苏省中医药防治肿瘤协同创新中心江苏南京210023南京中医药大学第一临床医学院江苏南京210029
孙玉侠,吴勉华,孙莎莎,谢美萍,姜泽群,李文婷(1.南京中医药大学医学院·整合医学院,江苏 南京 210023;2.江苏省中医药防治肿瘤协同创新中心,江苏 南京 210023;3.南京中医药大学第一临床医学院,江苏 南京 210029)
肝癌是全球普遍发生的恶性肿瘤之一,据官方最新癌症统计数据显示,原发性肝癌是目前世界第六大最常被诊断的癌症且已成为第三大癌症死亡原因[1]。我国肝癌的形势更加严峻,不仅发病率不断上升,其死亡率更是仅次于肺癌排在第二,针对无转移的肝癌患者目前常采用手术切除的方式治疗,但对于中晚期患者则很难彻底手术切除,而采用放、化疗方式往往给患者带来极大痛苦[2]。中医从“虚劳”立论,辨证论治,不仅可以延长肿瘤患者的生存周期,而且可以大大改善其生活质量[3]。临床研究[4]表明,对于肝癌患者单纯使用中医药治疗已卓有成效,而使用中西医结合治疗则更是效果明显。
消癌解毒方是在国医大师周仲瑛教授“癌毒”病机理论指导下经过长期临床实践的有效抗癌复方,是由白花蛇舌草、僵蚕、蜈蚣、八月札、山慈姑、太子参、麦冬组成的中药复方,其中白花蛇舌草清热解毒为君药;山慈菇、僵蚕、八月札、蜈蚣化痰祛瘀,解郁消癌为臣药;佐以益气养阴,扶正消癌的太子参和麦冬,全方配伍得当,发挥扶正消癌的效果,在临床治疗肝癌上取得了良好疗效[5]。根据癌毒理论,肿瘤以“癌毒”为特异性致病因子,夹杂痰、瘀、阴伤、气耗等邪气,患者表现出虚实夹杂、正气亏虚症状,因此治疗以消癌解毒为主同时兼顾化痰、祛瘀、补气、养阴[6]。全国名中医吴勉华教授团队对消癌解毒方的作用机制进行了深入研究[7],发现其既能通过直接杀伤癌细胞发挥抗癌解毒作用,又能通过增强免疫力抗肿瘤的方式起到扶正抗癌作用。
本研究致力于探索消癌解毒方抑制肝癌的体内作用及其分子机制,并通过蛋白组学寻找该方治疗肝癌的潜在作用靶点,丰富消癌解毒方防治恶性肿瘤的实验基础和疗效观察指征,以期为肿瘤的临床防治提供新的依据。
1 材料与方法
1.1 动物及细胞株C57-BL/6 小鼠,雄性,SPF 级,6~8周龄,体质量(18±2)g,上海斯莱克实验动物有限责任公司提供,动物生产许可证号:SCXK(沪)2017-0005,动物质量合格证号:20170005027692。饲养于南京中医药大学SPF级实验动物中心,使用许可证号:SYXK(苏)2018-0049,饲养温度(23±2)℃,湿度45%~50%,自由进食、饮水。实验经南京中医药大学伦理委员会批准,批准号:202004A004。肝癌H22细胞购自上海中乔新舟生物技术有限公司。
1.2 药物及试剂消癌解毒方由白花蛇舌草、山慈菇、僵蚕、蜈蚣、太子参、麦冬、八月札组成,中药饮片均购自南京百草堂中医门诊部,并经南京百草堂中医门诊部执业中药师严建国鉴定为正品。顺铂注射液,购自豪森药业有限公司,批号:H20040812;胎牛血清、免封闭PAGE 凝胶快速制备试剂盒、蛋白酶和磷酸酶抑制剂,购自翌圣生物科技(上海)股份有限公司,批号分别为:40130ES76、20326ES62、20124ES03、20109ES05;DMEM 高糖培养基,购自上海龙田生物技术有限公司,批号:L110KJ;胰蛋白酶、PBS溶液,购自上海源培生物科技有限公司,批号分别为:M430957、L210921;BCA 蛋白浓度测试盒,购自上海碧云天生物技术有限公司,批号:P0012;HE 染液,购自福州飞净生物科技有限公司,批号:PH0516;4%多聚甲醛固定液,购自北京兰杰柯科技有限公司,批号:21335405;TMT®Reagent-6Plex Multiplex Kit,购自美国Thermo fisher公司,批号:90061;IL-6和TNF-α Elisa 检测试剂盒,购自武汉塞维尔生物科技有限公司,批号分别为:GM1154、GM1151;兔一抗β-actin、STAT3、p-STAT3、c-Myc、Bcl-2、Bax、Cleaved-Caspase-3 和Cleaved-Caspase-9 抗体,购自美国CST公司,批号分别为:#4970、#2640、#9145、#5605、#3498、#2772、#9664、#9509;山羊抗兔IgG,购自美国Immunoway公司,批号:RS0002。
1.3 仪器Guava easyCyte 流式细胞仪,美国Merck Millipore 公司;Labsystems Mμltiskan MS 酶标仪,芬兰Thermo Labsyste 公司;1200SL/6410BLCMS 液相色谱质谱联用仪(LC-MS/MS),美国Thermo Scientific公司;MALDI-TOF/TOF 质谱仪,德国Ultrafle Xtreme公司;ChemiDoc MP 多功能凝胶成像仪,美国BIORAD公司。
1.4 药物制备按照标准配比称取各种药材,加入10 倍量的纯净水,煎煮2 h,干净双层纱布过滤;然后加入8 倍量纯净水,二次煎煮1.5 h,合并两次滤液。用旋转蒸发仪浓缩成终浓度为2 g·mL-1的药液,置于4 ℃冰箱备用。
1.5 模型复制[8]将处于对数生长期的H22 细胞用PBS 处理,得到浓度约为1×107个·mL-1的细胞悬液。通过皮下注射200 μL 细胞悬浮液到每只小鼠的右腋窝中创建小鼠肝癌模型;正常组注射同等体积的生理盐水。SPF环境下饲养1周,观察其造模情况。当小鼠腋下出现黄豆粒大小包块,说明造模成功,可用于后续实验。
1.6 分组及给药取造模成功小鼠,随机分为模型组、消癌解毒方组、顺铂组和消癌解毒方联合顺铂组,每组10只;另选10只健康小鼠作为正常组。模型组和正常组灌服生理盐水,消癌解毒方组给予20 g·kg-1的消癌解毒方,顺铂组给予1 mg·kg-1的顺铂注射液,消癌解毒方联合顺铂组给予相应的消癌解毒方和顺铂注射液,每日1次,持续给药11 d。
1.7 观察小鼠状态、计算抑瘤率和免疫系数给药后观察小鼠饮食、粪便、毛发和精神状况,用电子天平分别测量小鼠初次给药前和末次给药后体质量变化。给药结束第二天取血后处死小鼠,完整剥离瘤体组织、胸腺和脾脏,用PBS冲洗干净,称质量并计算肿瘤抑瘤率和免疫指数。抑瘤率=模型组与给药组瘤体平均质量差值/模型组瘤体平均质量×100%,胸腺(脾脏)系数=胸腺(脾脏)质量(mg)/小鼠体质量(g)。
1.8 瘤体组织HE 染色取出待测样本,用PBS冲洗干净,浸于适量4%多聚甲醛过夜;将其依次用由低到高乙醇溶液脱水,置于二甲苯中透明,浸蜡;用石蜡进行包埋并切片得到厚度为3~5 μm 的切片,经盖玻片捞片后,用二甲苯Ⅰ、Ⅱ脱蜡;然后浸入由高到低浓度乙醇溶液各10 min,用苏木精染色5 min,流水冲洗,经5%盐酸分化1 min 并冲洗干净;用伊红染色3 min,流水冲洗干净后浸入由低到高梯度乙醇溶液脱水,经二甲苯透明化,中性树脂封片,在显微镜下观察各组瘤体组织形态。
1.9 瘤组织凋亡的流式检测取待测样本,用无菌剪剪取1~2 mm 小块若干,移入1.5 mL 离心管,用PBS 洗涤干净;每管加入500 μL 0.25%胰酶消化液,37 ℃消化30 min,用含血清的培养基终止消化;以2 000 r·min-1离心3 min(离心半径15 cm),弃上清,PBS洗涤两次;用200目的尼龙网过滤悬液,再次离心3 min,弃上清;PBS 洗涤干净后严格按照Annexin V-FITC/PI 试剂盒说明书进行操作,在流式细胞仪上检测细胞凋亡率。
1.10 血清样本制备给药结束后,取小鼠全血,放入1.5 mL 离心管中,静置,常温3 000 r·min-1离心10 min,重复2 次,离心半径15 cm,得到待测上清;每管取10 μL,加入Elution Buffer,漩涡振荡;加入DTT,水浴。加入IAM,避光静置;加入预冷的丙酮,-20 ℃沉淀3 h;以6 900 r·min-1离心20 min,离心半径15 cm,取沉淀;加入复溶buffer,终浓度为50%TEAB,0.1%SDS;超声助溶,bradford 法进行蛋白定量。
1.11 蛋白质消化、肽段标记和质谱检测取100 μg蛋白体积样品,加入胰酶,37 ℃水浴。取1 μL消化后肽段,检测消化效率,加入异丙醇,涡旋1 min离心。将混好的标记试剂加入到肽段中,TMT 试剂标记,随后使用BioLC HPLC 柱子通过强阳离子交换的方法进行汇集、分液,再以LC-MS/MS 方法进行分析。使用Thermo 公司的仪器进行色谱扫描分离和质谱分析。将柱子在初始状态下平衡10 min,得到分析样本蛋白,按照常规方法在阳离子模式下进行扫描,所得数据由Maxquant(V 1.2.2.5)处理。
1.12 数据库搜索和生物信息学分析使用Uniprot.proteome(Version 2012048)数据库对质谱数据进行分析,其中倍数变化和P值(t检验)的切分分别设为1.5 和0.05。使用Ingenuity®Pathway Analysis(IPA)通路分析工具进行此部分实验的生物信息学分析。
1.13 Elisa 试剂盒检测IL-6、TNF-α 表达将采集的各组血液标本,置于1.5 mL 离心管中,室温放置2 h,于4 ℃、3 000 r·min-1离心15 min(离心半径15 cm),取上清。严格按照Elisa 试剂盒说明进行操作,检测IL-6和TNF-α含量。
1.14 Western Blot 法检测STAT3、p-STAT3、c-Myc、Bax、Bcl-2、Cleaved-Caspase-3 和Cleaved-Caspase-9 蛋白表达用Ripa 裂解液提取蛋白后使用BCA 试剂盒检测浓度。定量上样,将样品电泳至分离胶底部,转膜后用5%BSA 溶液室温封闭1.5 h,TBST 洗膜3 次,每次5 min;4 ℃环境孵育一抗过夜,TBST 洗膜3 次,每次10 min;室温孵育二抗1 h,TBST洗膜3次,每次15 min;按照1∶1配制显影剂,经曝光显影后用ImageJ 软件处理条带,并计算目的蛋白条带与β-actin条带灰度值的比值。
1.15 统计学处理方法采用GraphPad Prism 8软件进行统计学分析,实验数据以均数±标准差(±s)表示。组间数据对比采用单因素方差分析法,以P<0.05为差异有统计学意义。
2 结果
2.1 消癌解毒方对H22 荷瘤小鼠体质量、肿瘤生长和免疫指数的影响如图1、表1所示,与模型组比较,各给药组小鼠给药前后体质量基本一致,无明显统计学差异(P>0.05),其中各组肿瘤质量均不超过其体质量的10%,且体积不超过2 000 mm3,符合伦理规范,数据可用。与模型组比较,各给药组肿瘤质量明显下降,抑瘤率明显升高(P<0.01);顺铂组小鼠胸腺、脾脏系数明显降低(P<0.05),消癌解毒方组与消癌解毒方联合顺铂组胸脾和脾脏系数均明显升高(P<0.05,P<0.01)。观察小鼠生理状态发现消癌解毒方组及消癌解毒方联合顺铂组与单独使用顺铂组小鼠相比饮食更佳,大便、毛发受到影响较小,精神更活跃。以上结果提示,消癌解毒方和消癌解毒方联合顺铂组在抑制肝癌小鼠肿瘤增殖的同时可以促进其免疫器官发育,提高其免疫功能。
表1 各组荷瘤小鼠抑瘤率及免疫指数(±s,n=7)Table 1 Tumor inhibition rate and immune index of H22-bearing mice in each group(±s,n=7)
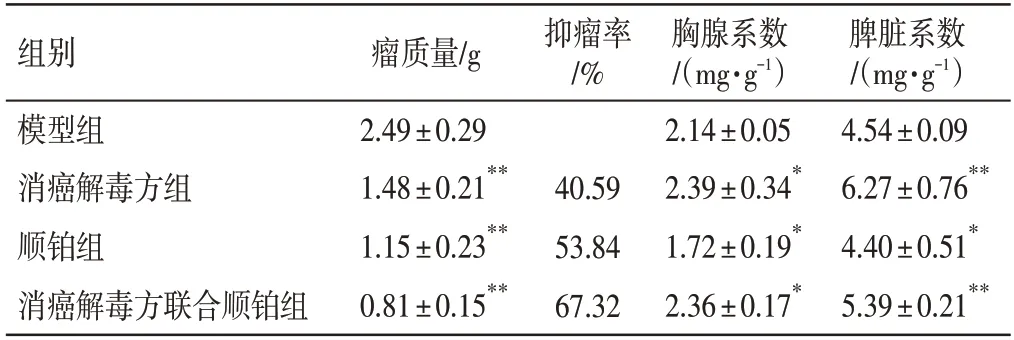
表1 各组荷瘤小鼠抑瘤率及免疫指数(±s,n=7)Table 1 Tumor inhibition rate and immune index of H22-bearing mice in each group(±s,n=7)
注:与模型组比较,*P<0.05,**P<0.01
脾脏系数/(mg·g-1)4.54±0.09 6.27±0.76**4.40±0.51*5.39±0.21**组别模型组消癌解毒方组顺铂组消癌解毒方联合顺铂组瘤质量/g 2.49±0.29 1.48±0.21**1.15±0.23**0.81±0.15**抑瘤率/%40.59 53.84 67.32胸腺系数/(mg·g-1)2.14±0.05 2.39±0.34*1.72±0.19*2.36±0.17*
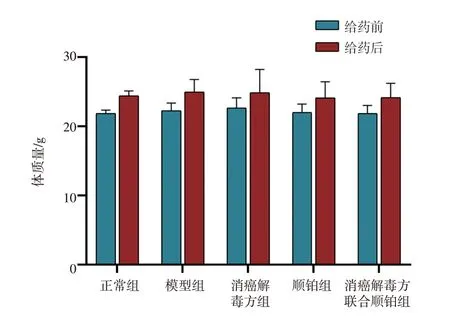
图1 消癌解毒方与顺铂联用对肝癌荷瘤小鼠体质量的影响(±s,n=7)Figure 1 Effects of Xiao’ai Jiedu Recipe combined with cisplatin on body mass of hepatoma-bearing mice(±s,n=7)
2.2 消癌解毒方对H22 荷瘤小鼠瘤体组织的影响如图2所示,HE 染色后显微镜下观察到模型组肿瘤细胞团体积较大,细胞排列密集且无序,与周围组织边界不明确,瘤细胞病理性核分裂像较多,肿瘤组织坏死程度均较轻,有不同程度空泡。药物干预后肿瘤细胞胞核异型、核质比高,核仁不明显,未见明显核分裂相,细胞大面积坏死,细胞胞核固缩深染、碎裂并出现明显细胞凋亡;与模型组比,瘤组织坏死程度加大,分裂增殖程度减轻。
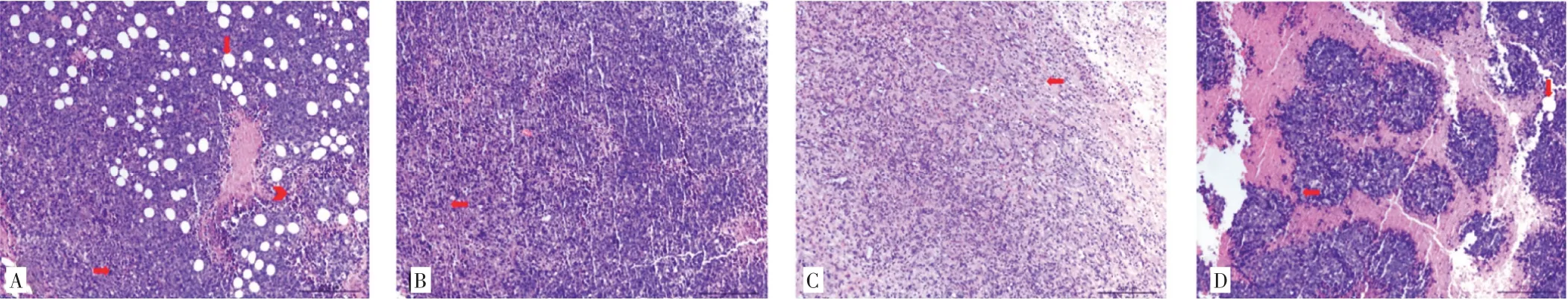
图2 各组小鼠瘤体组织病理学观察(HE 染色,×200)Figure 2 Observation of tumor histological morphology in each group(HE,×200)
2.3 消癌解毒方对H22 荷瘤小鼠肿瘤组织凋亡的影响如图3所示,与模型组比较,给药组凋亡率明显升高(P<0.01),差异具有统计学意义,表明给药组能促进肝癌小鼠细胞凋亡。

图3 各组小鼠瘤体组织流式检测结果(±s,n=7)Figure 3 Flow detection results of tumor tissue in each group(±s,n=7)
2.4 消癌解毒方对H22 荷瘤小鼠血清差异蛋白的影响如图4、表2所示,同组差异蛋白相似度高,表明结果可重复且客观有效;不同组之间蛋白差异明显,表明用药物干预后小鼠血清中蛋白出现不同程度的改变。消癌解毒方组与模型组比,血清中共鉴定出132 种差异蛋白,其中表达下调95 个蛋白,上调37 个蛋白(Fold change≥±1.5)。对差异蛋白进一步分析,主要涉及炎症因子、能量代谢、细胞凋亡酶、生长因子等,以表达较明显的部分蛋白为例,见表2。
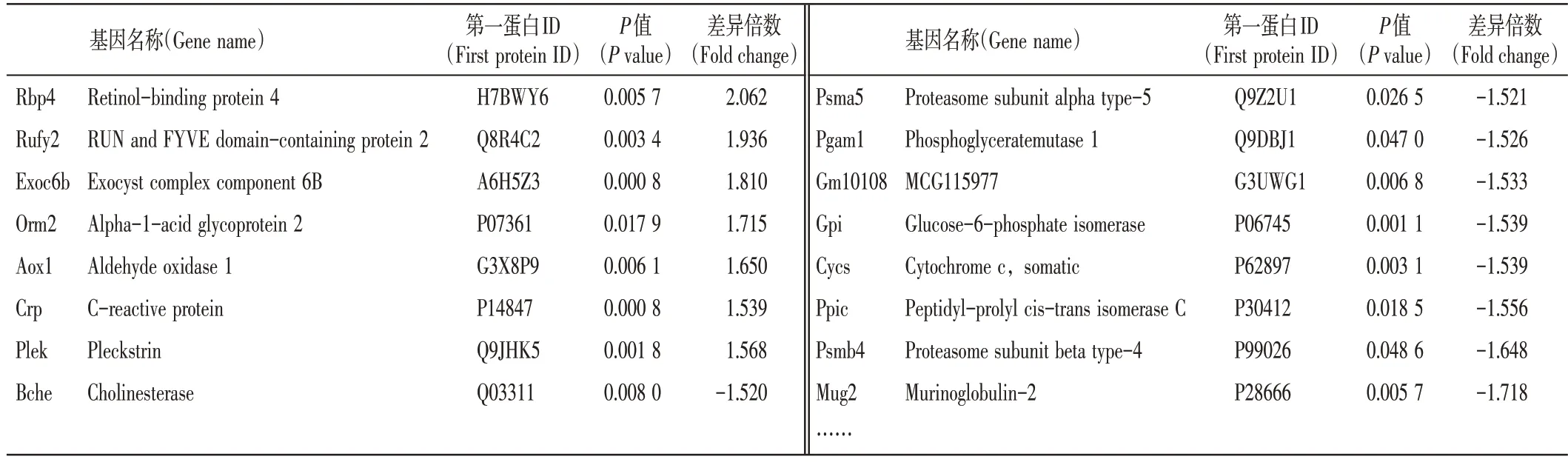
表2 消癌解毒方组与模型组比血清部分差异蛋白Table 2 Some serum different proteins for comparison between Xiao’ai Jiedu Recipe and the model group
2.5 消癌解毒方对H22 荷瘤小鼠差异蛋白的亚网络分析如图5所示,为了进一步了解差异蛋白之间关系,运用IPA软件对差异蛋白相互作用网络进行富集度分析。根据Score 值,与模型组比,消癌解毒方组得到5个富集度最高的蛋白质亚网络调控图,主要涉及脂质代谢、炎症反应、细胞死亡和生存、细胞信号和互动等方面。其中STAT3 信号通路被捕捉到参与炎症相关蛋白质网络调控。
2.6 消癌解毒方对H22 荷瘤小鼠差异蛋白上游调节因子的预测如表3、图6所示,进一步运用IPA 软件对差异蛋白进行上游因子富集,有36 种上游因子被预测到激活或抑制,根据一致性得分、节点、目标值筛选出最明显的10 个上游因子分别是HNF4A、STAT3、EGF、AGT、FOS、IL-6、JNK、CD36、TNF、HIF1A。为进一步筛选生物靶标,以IL-6、STAT3作为上游因子筛选出受其调控的下游因子。
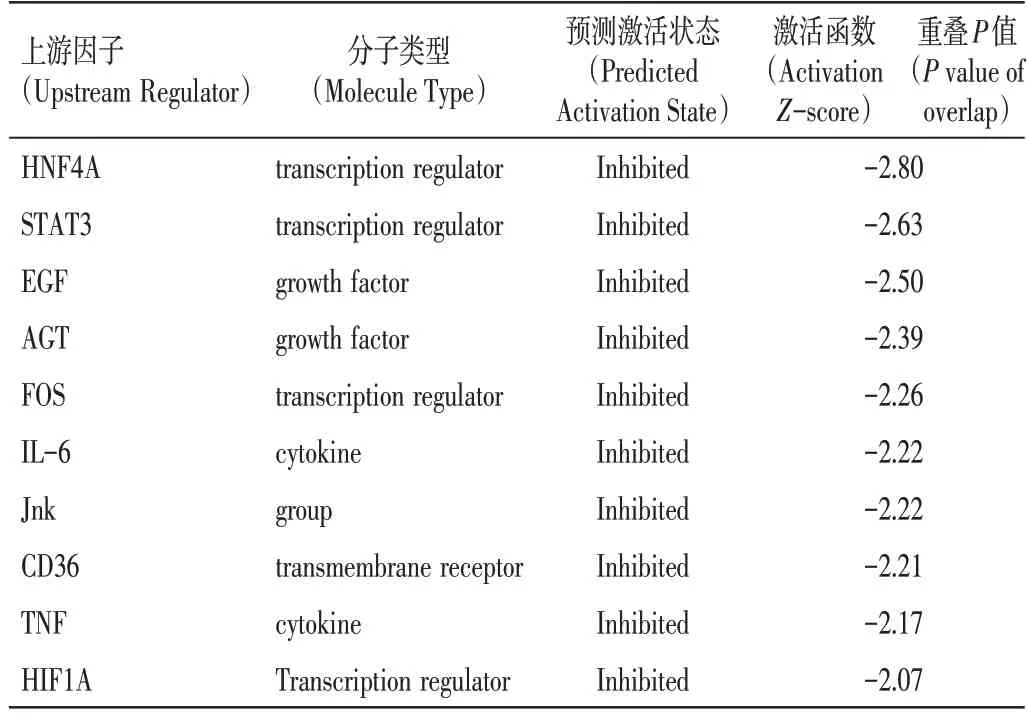
表3 预测消癌解毒方组与模型组差异蛋白活性状态的上游调节因子Table 3 Upstream regulatory factors of activity state predicted form the comparation between Xiao’ai Jiedu Recipe and model group
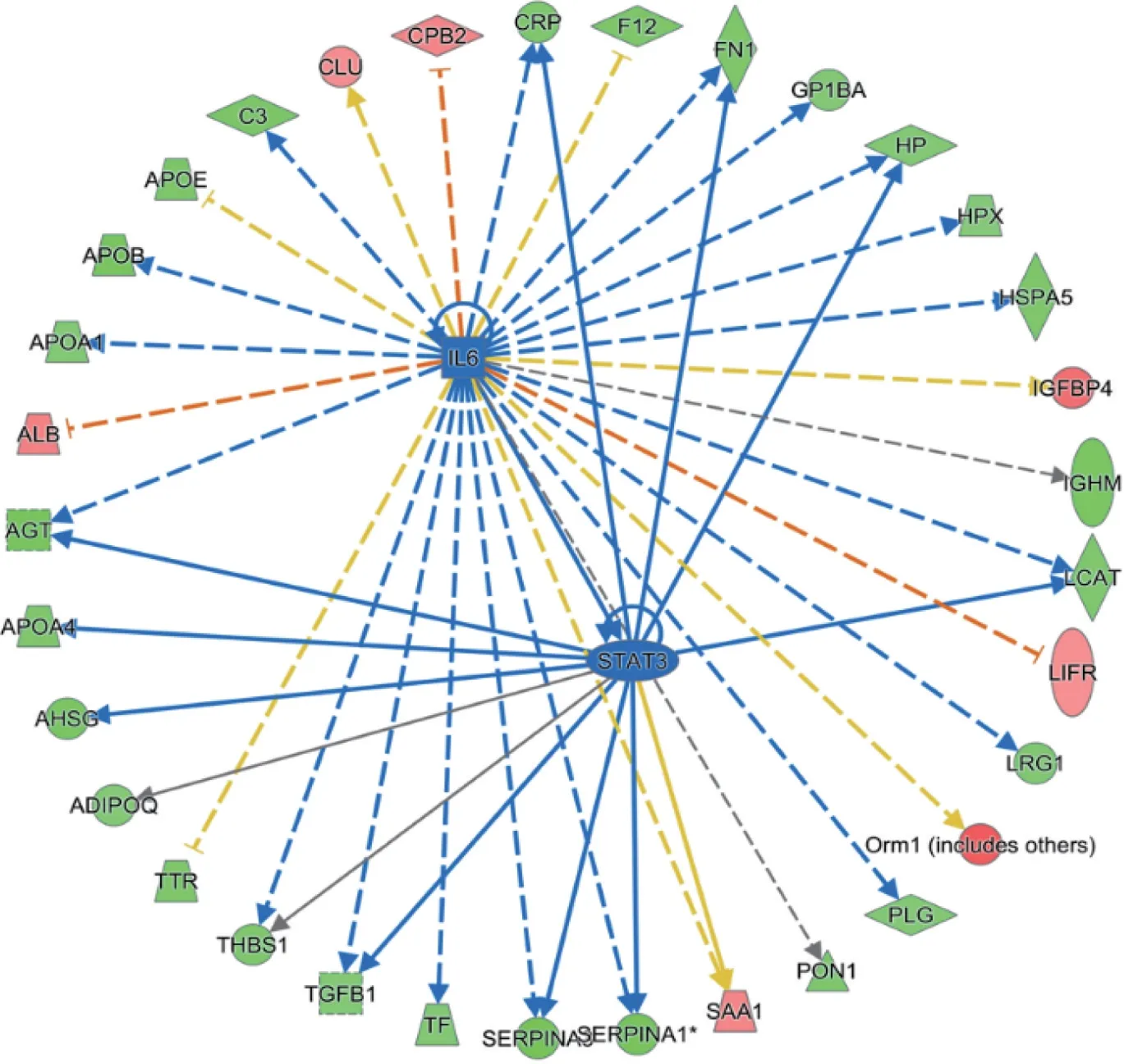
图6 消癌解毒方组与模型组差异蛋白质以IL-6、STAT3 作为上游因子筛选出受其调控的下游因子Figure 6 Differential protein from Xiao’ai Jiedu Recipe group and model group through screening downstream factor regulated by IL-6,STAT3
2.7 消癌解毒方对H22 荷瘤小鼠外周血IL-6 和TNF-α的影响如表4所示,与正常组比较,模型组IL-6和TNF-α 表达水平明显升高(P<0.01);与模型组比较,各给药组的表达水平明显下降(P<0.05,P<0.01),表明各给药组对小鼠炎症因子IL-6和TNF-α具有一定的调节作用,差异均有统计学意义。
表4 各组小鼠外周血IL-6、TNF-α 含量(±s,n=7)Table 4 Contents of IL-6 and TNF-α in peripheral blood of mice in each group(±s,n=7)

表4 各组小鼠外周血IL-6、TNF-α 含量(±s,n=7)Table 4 Contents of IL-6 and TNF-α in peripheral blood of mice in each group(±s,n=7)
注:与正常组比,##P<0.01;与模型组比,*P<0.05,**P<0.01
TNF-α/(ng·L-1)390.56±30.09 561.03±43.52##502.29±21.50*502.31±23.79*451.95±19.84**组别正常组模型组消癌解毒方组顺铂组消癌解毒方联合顺铂组IL-6/(ng·L-1)95.44±4.10 130.18±6.01##113.62±6.39**105.66±6.98**102.79±3.87**
2.8 消癌解毒方对H22 荷瘤小鼠瘤体组织STAT3、p-STAT3、c-Myc、Bax、Bcl-2、Cleaved-Caspase-3和Cleaved-Caspase-9 蛋白表达的影响如图7所示,与模型组比较,治疗后小鼠肿瘤组织中p-STAT3蛋白表达明显下降(P<0.05,P<0.01),差异具有统计学意义;而STAT3 变化不明显(P>0.05),差异无统计学意义;其下游基因Bax、Cleaved-Caspase-3和Cleaved-Caspase-9 蛋白含量明显升高(P<0.05,P<0.01),c-Myc、Bcl-2 蛋白含量明显下降(P<0.01),差异均有统计学意义。
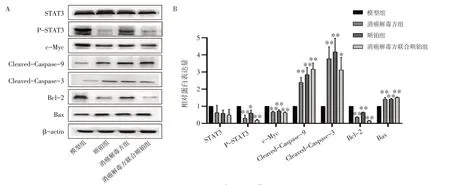
图7 各组蛋白表达水平(±s,n=7)Figure 7 Protein expression levels in each group(±s,n=7)
3 讨论
消癌解毒方是国医大师周仲瑛教授经过多年临床经验总结形成的肿瘤防治有效方。研究[9]发现消癌解毒方可以明显抑制胃癌、乳腺癌等肿瘤细胞的增殖。临床数据[10]显示消癌解毒方搭配化疗可增强患者免疫功能,具有减毒增效作用。
本实验通过对构建的肝癌荷瘤模型小鼠用药干预后,发现消癌解毒方可以抑制肝癌增殖、诱导肝癌细胞凋亡,且消癌解毒方与顺铂联用相对单独用药组效果更明显,相对单独使用化疗药组增加了免疫功能,且毒副作用更轻微。为了进一步探究其抗肝癌的机制,我们引入了蛋白组学的概念。
蛋白组学是指一个细胞组织或基因组所表达的所有蛋白质。蛋白组学通过整体分析细胞内生命过程中变化的蛋白质组成、表达水平、蛋白质之间的相互作用等,获知蛋白质功能及其在生命过程中的作用[11]。分析蛋白组学有利于疾病早期诊断和治疗。中医药是一个复杂的系统,其最具特色的就是整体观念和辨证论治,这与蛋白组学的研究思路不谋而合,利用蛋白组学方法有利于解读中医药复杂理论的科学内涵[12]。本实验以H22移植瘤小鼠外周血为实验对象,运用比较蛋白组学定量、定性分析,以TMT 肽段标记进行分析检测,探讨消癌解毒方干预后差异蛋白表达变化,并进一步分析差异蛋白间的网络调节和上游调控因子变化,最后得到与“癌毒”相关的生物标志物,以及消癌解毒方的抗癌分子靶标。
细胞生长不受控制,并不断拮抗其凋亡信号,是肿瘤快速发展的主要机制,故抑制增殖并诱导细胞凋亡是抗肿瘤药物的主要研究方向。IL-6/STAT3 信号通路在与肿瘤相关的疾病中发挥着很大作用,广泛参与了肿瘤细胞增殖、凋亡各组代谢调控[13]。IL-6是一种导致肿瘤发生增殖、转移的关键炎性因子,它的表达可以对STAT3的激活进行调节[14]。IL-6通过结合细胞表面抗体来激活JAK2,使得磷酸化的STAT3蛋白产生效应调控其下游基因的表达[15]。同时有研究[16]发现TNF-α 可以促进肿瘤发生,并且可以激活STAT3信号转导。c-Myc是STAT3通路上的关键下游基因之一,它通过促使细胞周期由静止变成活跃来促进肿瘤细胞增殖,故而,抑制c-Myc蛋白的表达可以抑制肿瘤增殖[17]。细胞凋亡是由多种基因调控的细胞自主有序的死亡,其中线粒体凋亡途径通路上的Bcl-2 家族与Caspase 家族是促使细胞发生凋亡的两个最重要的组成部分,STAT3信号的激活可以调节下游的Bax和Bcl-2参与肿瘤的异常凋亡[18]。Bcl-2是最主要的抗凋亡基因之一,Bax 则与其作用相反,Bax 的高表达有助于下调抗凋亡蛋白Bcl-2 的表达[19]。Bcl-2 的表达量降低会导致线粒体膜的通透性增加,此作为激活Caspase-9表达的信号,进一步激活Caspase-3的表达,开始执行细胞凋亡[20]。
本实验通过蛋白组学分析得出消癌解毒方的抗肿瘤分子机制可能与IL-6、TNF、STAT3等有关;随后对各组小鼠外周血进行Elisa 检测,发现模型组IL-6和TNF-α 因子的表达相对正常组明显上升,而各加药组IL-6 和TNF-α 因子的表达则相较于模型组明显下调;对STAT3 和磷酸化的STAT3 蛋白进行Western Blot检测,检测结果发现与模型组比较,单独或联合使用消癌解毒方和顺铂时,p-STAT3 蛋白的表达均明显降低。这反映了消癌解毒方联合顺铂的抑癌作用与IL-6/TNF-α/STAT3 通路紧密相连。为了进一步探讨其发挥作用的机制,我们随后对其下游基因的蛋白水平进行检测,结果显示相较于模型组各给药组均明显下调了c-Myc 和Bcl-2 蛋白水平,Bax、Cleaved-Caspase-3 及Cleaved-Caspase-9 蛋白含量则明显上调。上述实验均表明消癌解毒方联合顺铂组效果均优于单独给药组。
综上所述,消癌解毒方可以抑制肝癌增殖、诱导细胞凋亡并且增强免疫功能,消癌解毒方与顺铂联用可以增加疗效并减轻顺铂毒副作用。其抑癌机制可能是通过调控IL-6/TNF-α/STAT3 通路进一步影响其下游基因c-Myc、Bcl-2 和Caspase 家族的蛋白水平。阻断IL-6/TNF-α/STAT3 通路可以成为未来治疗肝癌的新思路,这有待于我们进一步探讨。
