瑞香素调节AMPK/mTOR信号通路对IL-1β诱导的关节软骨细胞自噬和凋亡的影响
2023-11-30冷雨李清山何克李善武
冷雨 李清山 何克 李善武
骨关节炎(osteoarthritis,OA)是临床常见的慢性退行性关节疾病,患者表现为关节软骨发生退行性病变、纤维化、断裂、缺损或者整个关节面的损伤[1,2]。现阶段,OA是全球范围内导致患者残疾的主要疾病原因之一,且OA的发病率正在逐年攀升,显著影响了患者的身体健康和生活质量[3]。目前临床治疗OA主要依靠止痛药或物理治疗,但这些药物的疗效有限,且无法根治[4]。因此,寻找治疗OA安全有效的治疗药物,对提高患者的生活质量具有重要意义。瑞香素(Daphnetin,DAP)作为一种中药,是香豆素的衍生物,药理学研究表明DAP具有抗炎、抗肿瘤、抗凝、抗氧化、神经保护等药理作用[5,6]。但关于DAP对OA患者关节软骨细胞的自噬和凋亡的影响还尚未有相关报道。自噬是细胞通过溶酶体途径降解和清除体内物质的重要生物学过程,其广泛存在于细胞的生长、增殖、分化、代谢等生理病理过程中,也与一些退行性疾病如OA等息息相关[7]。腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路是自噬相关的信号通路之一,研究发现活化的AMPK可以激活AMPK/mTOR信号通路,从而激活细胞自噬[8]。本研究以大鼠关节软骨细胞为研究对象,探究DAP对白介素-1β(interleukin,IL-1β)诱导的关节软骨细胞自噬和凋亡的影响。
1 材料与方法
1.1 细胞 大鼠关节软骨细胞购自宁波明舟生物科技有限公司。
1.2 主要试剂 DAP(纯度≥98%)购自上海源叶生物科技有限公司;IL-1β、AMPK抑制剂Compound C购自美国Sigma公司;DMEM培养基、胎牛血清购自美国Gibco公司;胰蛋白酶购自上海钰博生物科技有限公司;CCK-8试剂盒购自江苏弘麒生物科技有限公司;Annexin V-FITC/PI细胞凋亡检测试剂盒购自美国BD公司;Transwell小室购自Corning公司;Trizol试剂、反转录试剂盒购自北京天根生化科技有限公司;BCA蛋白定量检测试剂盒购自上海碧云天生物科技有限公司;p-AMPK、AMPK、p-mTOR、mTOR、Bcl-2、Bax、Beclin-1、LC3、GAPDH一抗和相应二抗购自美国Abcam公司。肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-6(interleukin-6,IL-6)ELISA试剂盒购自南京建成生物工程研究所;单丹磺酰戊二胺(MDC)试剂盒购自北京索莱宝科技有限公司。
1.3 细胞培养 大鼠关节软骨细胞培养在含体积分数为10%的胎牛血清的DMEM培养基中,在37℃、5%CO2的二氧化碳培养箱中进行常规培养。每2~3天更换1次新鲜培养基。传代3次后取生长状态良好的对数生长期细胞用于后续实验。
1.4 细胞分组与处理 取对数生长期的大鼠关节软骨细胞以1×104个/孔的密度接种于96孔板中,待细胞贴壁后随机分为对照组(Control组,空白培养基处理)、模型组(Model组,10 ng/ml IL-1β[9])、低浓度DAP组(DAP-L组,30 mg/L DAP)、高浓度DAP组(DAP-H组,60 mg/L DAP[10])、高浓度DAP+AMPK抑制剂Compound C组(DAP-H+CC组,60 mg/L DAP+10 μmol/L CC[11])。其中DAP-L组、DAP-H组与DAP-H+CC组均需先加入IL-1β进行预处理。分组后加入相应浓度药物进行处理。
1.5 CCK-8法检测细胞增殖活性 取对数生长期的大鼠关节软骨细胞以1×104个/孔的密度接种于96孔板中,每组设6个复孔,按照1.4进行相应分组与处理。继续置于细胞培养箱中培养24、48、72 h,在各时间点弃去培养基,PBS洗涤后分别加入CCK-8试剂10 μl,37℃继续孵育2 h,用酶标仪检测各组细胞在450 nm下的吸光度值(OD450)。
1.6 ELISA法检测细胞上清液中TNF-α、IL-6水平 取对数生长期的大鼠关节软骨细胞以1×104个/孔的密度接种于96孔板中,每组设6个复孔,按照1.4进行相应分组与处理。继续培养48 h,收集培养基上清液,根据TNF-α、IL-6 ELISA试剂盒说明书,对细胞上清液中TNF-α、IL-6水平进行检测。
1.7 流式细胞术检测细胞凋亡 将对数生长期的大鼠关节软骨细胞以3×104个/孔的密度接种于6孔板中,培养过夜后按1.4方法对细胞进行相应处理。继续培养48 h后,加入胰蛋白酶消化收集细胞,PBS洗涤2次后加入500 μl的结合缓冲液重悬细胞,加入Annexin V-FITC和PI各5 μl于室温下避光反应15 min。上流式细胞仪测定细胞凋亡率。
1.8 实时荧光定量PCR检测细胞中AMPK、mTOR mRNA的表达 将对数生长期的大鼠关节软骨细胞以3×104个/孔的密度接种于6孔板中,培养过夜后按1.4方法对细胞进行相应处理。继续培养48 h后收集细胞,加入Trizol试剂提取细胞总RNA,反转录试剂盒合成cDNA,进行PCR扩增。反应程序为:95℃ 5 min,95℃ 15 s,60℃ 30 s,72℃ 30 s,共循环40次。以GAPDH为内参,应用2-ΔΔCt方法计算AMPK、mTOR mRNA的相对表达。见表1。

表1 引物设计序列
1.9 Western Blot检测细胞AMPK/mTOR信号通路、自噬和凋亡相关蛋白的表达 取对数生长期的大鼠关节软骨细胞按1.4处理。收集细胞,加入RIPA裂解液提取细胞总蛋白。采用BCA蛋白定量试剂盒对总蛋白浓度进行定量。经10% SDS-PAGE凝胶电泳,转膜,4℃封闭2 h。加入AMPK(1∶1 000)、p-AMPK(1∶1 000)、mTOR(1∶1 000)、p-mTOR(1∶1 000)、Bcl-2(1∶1 000)、Bax(1∶1 000)、Beclin-1(1∶2 000)、LC3Ⅱ/Ⅰ(1∶1 000)一抗于4℃下孵育过夜。次日,洗膜后加入相应二抗(1∶5 000)于室温摇床下孵育2 h,加入ECL试剂进行显影,以GAPDH蛋白作为内参。在凝胶成像仪下进行曝光,采用Image Lab软件对目标蛋白的灰度值进行分析。
1.10 MDC染色观察细胞自噬 将对数生长期的大鼠软骨细胞接种在24孔板中,并按1.4处理。待细胞生长至80%时,弃去培养基,使用Wash buffer清洗2次后,在每孔中加入MDC染色液100 μl,室温下避光孵育45 min,弃去染色液,Wash buffer清洗2次,在荧光显微镜下观察细胞的自噬囊泡,计算阳性细胞的比例。
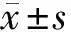
2 结果
2.1 DAP对细胞增殖活性的影响 与Control组比较,Model组细胞OD450值(48、72 h)显著下降(P<0.05);与Model组比较,DAP-H组细胞OD450值(48、72 h)显著上升(P<0.05),DAP-L组差异无统计学意义(P>0.05)。与DAP-L组比较,DAP-H组细胞OD450值(48、72 h)显著上升(P<0.05)。与DAP-H组相比,DAP-H+CC组细胞OD450值(48、72 h)显著下降(P<0.05)。见表2。
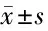
表2 5组大鼠关节软骨细胞增殖活性比较 n=6,
2.2 DAP对细胞上清液中TNF-α、IL-6水平的影响 与Control组比较,Model组细胞上清液中TNF-α、IL-6水平显著升高(P<0.05);与Model组比较,DAP-H组细胞上清液中TNF-α、IL-6水平显著下降(P<0.05),DAP-L组差异无统计学意义(P>0.05)。与DAP-L组比较,DAP-H组细胞上清液中TNF-α、IL-6水平显著下降(P<0.05)。与DAP-H组比较,DAP-H+CC组细胞上清液中TNF-α、IL-6水平显著上升(P<0.05)。见表3。
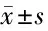
表3 5组细胞上清液中TNF-α、IL-6水平比较 n=6,pg/mL,
2.3 DAP对细胞凋亡率的影响 与Control组比较,Model组细胞凋亡率显著升高(P<0.05);与Model组比较,DAP-H组细胞凋亡率显著下降(P<0.05),DAP-L组差异无统计学意义(P>0.05)。与DAP-L组比较,DAP-H组细胞凋亡率显著下降(P<0.05)。与DAP-H组比较,DAP-H+CC组细胞凋亡率显著上升(P<0.05)。见图1,表4。
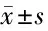
表4 各组细胞凋亡率的比较 n=6,%,
2.4 DAP对细胞中AMPK、mTOR mRNA表达的影响 与Control组相比,Model组细胞中AMPK mRNA表达显著降低(P<0.05),mTOR mRNA水平显著升高(P<0.05)。与Model组相比,DAP-H组细胞中AMPK mRNA表达显著升高(P<0.05),mTOR mRNA水平显著降低(P<0.05),DAP-L组无显著性差异(P>0.05)。与DAP-L组相比,DAP-H组细胞中AMPK mRNA表达显著升高(P<0.05),mTOR mRNA水平显著降低(P<0.05)。与DAP-H组相比,DAP-H+CC组细胞中AMPK mRNA表达显著降低(P<0.05),mTOR mRNA水平显著升高(P<0.05)。见表5。
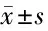
表5 5组细胞中AMPK、mTOR mRNA表达比较 n=6,
2.5 DAP对细胞中自噬的影响 与Control组比较,Model组MDC阳性细胞比例显著下降(P<0.05);与Model组比较,DAP-H组MDC阳性细胞比例显著上升(P<0.05),DAP-L组差异无统计意义(P>0.05);与DAP-L组比较,DAP-H组MDC阳性细胞比例显著上升(P<0.05);与DAP-H组比较,DAP-H+CC组MDC阳性细胞比例显著下降(P<0.05)。见图2,表6。
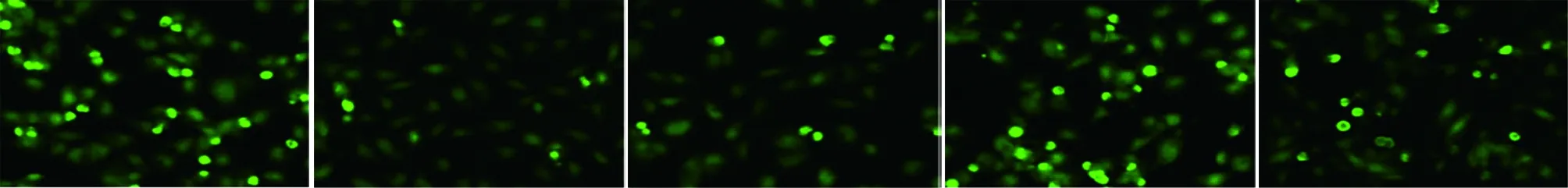
图2 大鼠关节软骨细胞MDC荧光染色图(比例尺=100 μm)
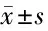
表6 5组阳性细胞比例比较 n=6,%,
2.6 DAP对细胞中AMPK/mTOR信号通路、自噬、凋亡相关蛋白表达的影响 与Control组比较,Model组细胞中AMPK磷酸化水平、Bcl-2、Beclin-1、LC3Ⅱ/Ⅰ蛋白表达显著降低(P<0.05),mTOR磷酸化水平、Bax蛋白表达显著升高(P<0.05)。与Model组比较,DAP-H组细胞中AMPK磷酸化水平、Bcl-2、Beclin-1、LC3Ⅱ/Ⅰ蛋白表达显著升高(P<0.05),mTOR磷酸化水平、Bax蛋白表达显著降低(P<0.05),DAP-L组差异无统计学意义(P>0.05)。与DAP-L组比较,DAP-H组细胞中AMPK磷酸化水平、Bcl-2、Beclin-1、LC3Ⅱ/Ⅰ蛋白表达显著升高(P<0.05),mTOR磷酸化水平、Bax蛋白表达显著降低(P<0.05)。与DAP-H组比较,DAP-H+CC组细胞中AMPK磷酸化水平、Bcl-2、Beclin-1、LC3Ⅱ/Ⅰ蛋白表达显著降低(P<0.05),mTOR磷酸化水平、Bax蛋白表达显著升高(P<0.05)。见图3,表7。
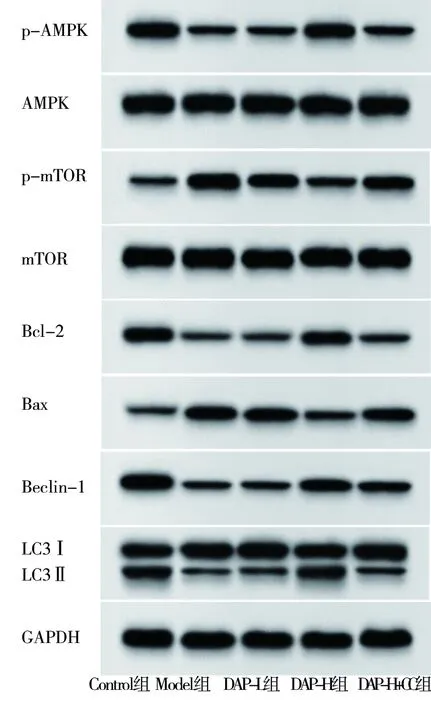
图3 Western Blot检测细胞中AMPK/mTOR信号
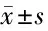
表7 5组细胞中AMPK/mTOR信号通路、自噬、凋亡相关蛋白表达比较n=6,
3 讨论
OA是在力学或者生物学的影响因素下,导致软骨细胞、细胞外基质、软骨下骨三者降解和合成正常耦联失衡的结果[12]。其中,65岁以上人群的患病率男性为60%,女性为70%,且随着人口老龄化的进程、生活方式的变化等因素,OA的发病率正在逐年攀升[13]。OA的发病机制复杂,且尚未阐明,研究者发现关节软骨细胞在OA的发生发展中发挥着重要的作用。软骨细胞具有能够维持机体软骨完整程度,并使关节软骨获得充分负重的能力[14]。因此,探究关节软骨细胞的生物学活动将为OA的发病机制阐明与治疗方法的新发现带来帮助。IL-1β是常见的体外诱导关节炎软骨细胞模型的诱导因子,本研究采用IL-1β诱导关节软骨细胞建立OA体外模型,结果显示,与Control组比较,Model组关节软骨细胞OD450值(48 h、72 h)、Bcl-2蛋白表达显著下降,细胞凋亡率、炎性因子TNF-α、IL-6水平、Bax蛋白表达显著上升。这些结果说明OA的体外模型构建成功。
已有研究发现,DAP作为一种血液化瘀剂,能够用于心血管病的治疗[15]。现阶段,也有研究者发现,DAP也可以用于炎症类疾病如类风湿关节炎、癌症等治疗过程中。Zhang等[16]研究发现DAP可能通过抑制PI3K/AKT、MAPK和NF-κB信号通路和凋亡相关因子,对体外和体内的OA模型均起到保护作用。Vinayagam等[17]研究发现DAP可以保护INS-1胰腺β细胞免受链脲佐菌素诱导的细胞凋亡,表明DAP有望成为治疗糖尿病的候选药物。代婵等[18]研究发现DAP可以降低NF-κB信号通路中p65的磷酸化水平,调节相关炎性因子分泌,减轻类风湿性关节炎的炎性反应。自噬是Ⅱ型程序性细胞死亡过程,研究发现保持高水平的自噬可能对软骨细胞具有保护作用[19]。在自噬激活过程中,Beclin-1表达上调,且LC3Ⅱ/Ⅰ的水平与自噬水平成正比。本研究结果显示,与Model组相比,DAP-H组关节软骨细胞OD450值(48、72 h)、Bcl-2、Beclin-1、LC3Ⅱ/Ⅰ蛋白表达、MDC阳性细胞比例显著上升,细胞凋亡率、炎性因子TNF-α、IL-6水平、Bax蛋白表达显著下降。这说明DAP能促进IL-1β诱导的关节软骨细胞自噬,抑制细胞凋亡。
AMPK/mTOR信号通路是自噬相关信号通路之一,AMPK通过磷酸化被激活,并降低mTOR的磷酸化水平,从而激活自噬过程[20]。Hwang等[21]研究发现抗抑郁药物舍曲林能够通过激活AMPK,抑制mTOR来启动自噬,从而治疗自噬相关疾病。张哲等[22]研究发现利拉鲁肽能够通过激活AMPK/mTOR信号通路激活自噬,减轻2型糖尿病大鼠的心肌炎症和氧化应激损伤。本研究结果显示,与Control组比较,Model组关节软骨细胞的AMPK mRNA表达和蛋白磷酸化水平显著降低,mTOR mRNA水平和蛋白磷酸化水平显著升高。与Model组比较,DAP-H组关节软骨细胞的AMPK mRNA表达和蛋白磷酸化水平显著升高,mTOR mRNA水平和蛋白磷酸化水平显著降低。这说明DAP可能通过激活AMPK/mTOR信号通路促进IL-1β诱导的关节软骨细胞自噬,抑制细胞凋亡。为了验证此猜想,笔者用AMPK抑制剂Compound C来干预高浓度的DAP组,结果发现,Compound C减弱了DAP对关节软骨细胞自噬的促进作用,促进了细胞凋亡。
综上所述,DAP可能通过激活AMPK/mTOR信号通路促进IL-1β诱导的关节软骨细胞自噬,抑制细胞凋亡。本研究为阐明OA的发病机制和探寻治疗OA的新药物提供了科学的依据和参考。然而本研究还存在不足之处,本研究只在细胞水平上进行了探究,后续还需进一步在体内水平上进行验证。
