基于网络药理学和分子对接技术研究甘草附子汤治疗类风湿性关节炎的作用机制*
2023-11-29蓝绍航庞宇舟区佩琪韦露秋罗筱凡
蓝绍航,庞宇舟,区佩琪,韦露秋,罗筱凡,吕 挺
1 广西壮族自治区人民医院,广西 南宁 530022; 2 广西中医药大学,广西 南宁 530001
类风湿性关节炎(rheumatoid arthritis,RA)是一种以滑膜的炎性反应和异常增生为病理表现,影响关节和关节外结构的慢性、全身性、自身免疫性疾病[1],临床以多关节炎、关节肿痛、软骨和骨破坏,甚至关节畸形和功能丧失为主要表现特征。我国RA 的患病率约为0.42%,并呈现逐年上升的趋势[2]。RA 至今病因未明,西医认为主要与遗传、感染、内分泌失调和药物诱导等因素有关,多选用非甾体类抗炎药、激素、抗风湿药、生物药剂及小分子植入药等治疗,但这些药物存在剂量大、给药频繁、毒副作用严重等缺点[3]。
RA 属于中医“痹证”范畴。《素问·痹论篇》曰:“风、寒、湿三气杂至,合而为痹也。”[4]《黄帝内经》首提“痹”之病名,明确提出痹证是风、寒、湿三气杂至,故多以祛风、散寒、除湿为基本治法。甘草附子汤源自张仲景《伤寒杂病论》:“风湿相抟,骨节疼烦,掣痛不得屈伸,近之则痛剧,汗出短气,小便不利,恶风不欲去衣,或身微肿者,甘草附子汤主之。”[5]方中桂枝温通阳气,祛风和营;白术苦温,健脾燥湿;附子辛热扶阳温经,长于祛寒。附、桂、术三药相伍,既除风、寒、湿,又温表阳而固卫气,故被誉为治风湿之圣药[6]。又痹证急而剧,甘草既调和诸药,又缓急止痛。全方合用,可有效抓住RA 病源,切中病机,扼其病势,提高疗效。近年来运用甘草附子汤治疗RA 也取得一定的研究进展,廖常志运用甘草附子汤治疗RA 患者23 例,总有效率达100%[7]。王颖等[8]通过数据挖掘对治疗RA 常见药物频次总结后发现,桂枝和甘草分别排在出现频次最高的第2 位和第4 位。研究发现,甘草附子汤能抑制T 淋巴细胞的增殖与分化,减少炎性细胞向滑膜组织的浸润,下调血清相关细胞因子白细胞介素2(interleukin-2,IL-2)、肿瘤坏死因子α(tumor necrosis factor,TNF-α)的表达水平,进而起到抗炎和消除关节肿胀的作用[9]。此外,蔡悦等[10]研究发现,甘草附子汤可通过减少TNF-α、白细胞介素1β(interleukin-1β,IL-1β)等炎性细胞因子的产生,降低滑膜组织中基质金属蛋白酶1(matrix metalloproteinases-1)、MMP-3蛋白表达,从而抑制RA小鼠关节炎症和骨侵蚀的发生。
目前对于甘草附子汤治疗RA 的研究较多,但尚未对其作用机制进行系统阐释。网络药理学是基于系统生物学、药理学、药物化学和生物化学的一门综合性的新兴学科,为中药发展提供新的研究思想,是药物研究的新模式[11],为明确药物作用机制、新药研发、复方用药等提供理论依据和技术支撑[12]。同时,分子对接(molecular docking)也可揭示药物治疗疾病的分子机制,将药理作用上升到分子水平上,为研究药物机制奠定物质基础[13]。因此,本研究基于网络药理学结合分子对接技术,利用甘草附子汤中的化合物和受体分子虚拟结合,发现其作用靶点和结合位点,阐述甘草附子汤多成分、多靶点、多通路的协同作用机制,弥补片面的、不系统的研究,为后续深入研究提供相应的理论基础和科学依据。
1 资料与方法
1.1 药物有效成分筛选及靶点预测在中药系统药理学数据库与分析平台(traditional Chinese medicine systems pharmacology database,and analysis platform,TCMSP)数据库(http://lsp.nwu.edu.cn/tcmsp.php)筛选甘草附子汤(甘草、附子、桂枝、白术)的全部化学成分,并以口服生物利用度(oral bioavailability,OB)≥30%、类药性指数(drug-likeness,DL)≥0.18作为筛选标准,确定药物的活性成分。然后在Related Targets一栏中找出其所对应的作用靶点,将所有药物靶点进行合并整理,剔除重复的药物靶点,在Uniport数据库(https://www.uniprot.org/)中输入靶点名称并限定物种为homo sapiens(human),对靶点进行蛋白名称标准化,获得靶点对应的标准基因名。
1.2 RA疾病靶点获取以“rheumatoid arthritis”为检索词,在GeneCards(https://www.genecards.org/)、OMIM(https://omim.org/)、Pharm-Gkb(https://www.pharmgkb.org/)、TTD(http://db.idrblab.net/ttd/)、DrugBank(https://www.drugbank.ca/)等数据库获取RA 相关靶点基因。对收集的所有RA 靶点进行处理,删除重复靶点,即为所需的RA 总靶点。再利用R 语言绘制RA 靶点基因交集Venny图。
1.3 甘草附子汤与RA 交集靶点筛选将上述获得的药物靶点与疾病靶点基因通过R 语言绘制Venny 图,对甘草附子汤活性成分靶点与RA 相关靶点基因进行映射,得到药物与疾病交集靶点。
1.4 构建活性成分-核心靶点网络将以上所得的甘草附子汤所有药物的活性成分交集和RA 靶点基因交集数据导入Cytoscape 3.7.2 软件,并对其参数进行设置,得到活性成分-核心靶点相互作用网络图。
1.5 构建蛋白质相互作用(protein-protein interaction,PPl)网络及核心基因预测将筛选得到的“Drug-Disease”中的靶点蛋白导入STRING 数据库(https://string-db.org/),限定研究物种为“Homo sapiens”,最低相互作用评分设置为“0.900”,同时设置隐藏游离点,其余参数保持默认,进行蛋白质互作分析,得到PPI 网络图。将获得数据导入Cytoscape 3.7.2 软件,使用Network Analyzer插件对PPI网络进行拓扑分析筛选关键基因。
1.6 GO 功能富集分析与KEGG 通路分析将“1.3”项下筛选得到的药物疾病靶点交集通过导入R 语言软件中进行GO 功能富集分析和KEGG 通路分析。两者皆以P<0.01为筛选标准。
1.7 分子对接为验证筛选出的甘草附子汤治疗RA 可能关键靶点的准确性,将“1.1”项和“1.5”项中整理出的排名靠前的活性成分与药物靶点进行 分 子 对 接。在Pubchem(https://pubchem.ncbi.nlm.nih.gov/)数据库中下载活性成分的小分子配体2D 结构,将2D 文件导入ChemBio3D Ultra 14.0软件生成3D结构,使用优化模块进行分子结构优化,获取最稳定的分子构象。从PDB(https://www.rcsb.org/)数据库下载靶点蛋白受体三维结构,并将其导入PyMOLWin 软件,输入命令删除靶蛋白的水分子和小分子配体,完成蛋白受体准备。将蛋白受体文件导入AutoDock-Tools-1.5.6 软件中,对蛋白分子加氢等处理,保存文件为pdbqt 格式,再将小分子配体文件导入AutoDockTools-1.5.6 软件中,把文件转换为pdbqt 格式。以靶点的原型配体所在位置的中心定义为活性对接口袋位点,口袋大小设为1.0 nm,其他参数根据需要适当调整,确定活性口袋,使用Autodock vina软件进行对接。
2 结果
2.1 甘草附子汤有效活性成分筛选及靶点预测经TCMSP 数据库搜索,搜索关键词为“甘草、桂枝、白术、附子”,以OB≥30%,DL≥0.18 为筛选条件,检索到甘草附子汤4 味药材的有效活性成分共有127 个,其中甘草92 个、桂枝7 个、白术7 个、附子21 个。整理后预测靶点为1895 个,经Uniprot 数据库标准化注释并删除重复靶点后得到133个作用靶点。见表1。

表1 “中药-活性成分-疾病靶点”信息 个
2.2 药物靶点与疾病靶点交集经分析得到药物潜在活性成分靶点133个,RA疾病基因3750个,见图1;二者得出的交集靶点基因为133个,见图2。

图1 疾病基因合并Venny图

图2 药物靶点和疾病靶点Venny图
2.3 活性成分-核心靶点相互作用网络将“2.2”得到的133 个交集靶点运用Perl 相关脚本进行文件处理,所得数据导入Cytoscape 3.7.2软件进行可视化网络构建,得到活性成分-核心靶点相互作用网络图,见图3。图3中圆形节点代表药物的有效成分,绿、红、橙、蓝色分别代表甘草、白术、桂枝、附子的有效成分,多个颜色代表多个药物共同的有效成分,灰色线条代表边,黄色三角形节点代表中药和疾病的交集靶点。图中共有246个节点,其中来源于化合物的有99个,来源于基因的有147 个;经统计degree 较高的有效成分为槲皮素(quercetin)、山柰酚(kaempferol)、柚皮素(naringenin)、芒柄花素(formononetin)等。见表2。

图3 活性成分-核心靶点相互作用网络图

表2 度值大于20的前4位化学成分
2.4 PPl 网络及核心基因预测将“2.2”项得到的133 个交集靶点导入STRING 数据库,设定物种为“Homo sapiens”,得出string_interactions文件,并以tsv 格式保存。网络图共有132 个节点、435条边,平均每个节点的度值为6.59,平均局部聚类系数为0.489,PPI enrichment p-value值为<1.0e-16,邻接节点数目越多,说明这些蛋白在网络中的作用越显著。见图4。将tsv 格式文件数据导入Cytoscape 3.7.2 软件中,使用Network Analyzer 插件对PPI 网络进行拓扑分析筛选关键基因,处于核心位置的靶点有JAK2、JUN、IL-10、TNF、CSF2、CCL2、JAK3、IL-1B、JAK1、MAPK14、IL-2、IL-6等,提示这些基因在PPI中发挥了关键作用。见图5。

图4 交集基因PPI网络图
2.5 GO 富集分析和KEGG 通路富集分析经GO富集分析共得到1912 条富集结果,其中生物过程(biological process,BP)1792 个,主要涉及对细胞因子产生的正调控、对细胞黏附调节、对炎症反应的调节、对细菌源分子的反应、对脂多糖的反应等生物过程的调节;细胞组分(cellular component,CC)28 个,主要涉及质膜外侧、膜筏、膜微区、膜区等细胞组分;分子功能(molecular function,MF)89个,主要涉及细胞因子受体结合、细胞因子活性、受体配体活性、信号受体激活剂活性等。提示甘草附子汤在治疗RA 过程中通过参与调控多种生物学过程而发挥作用。见图6。
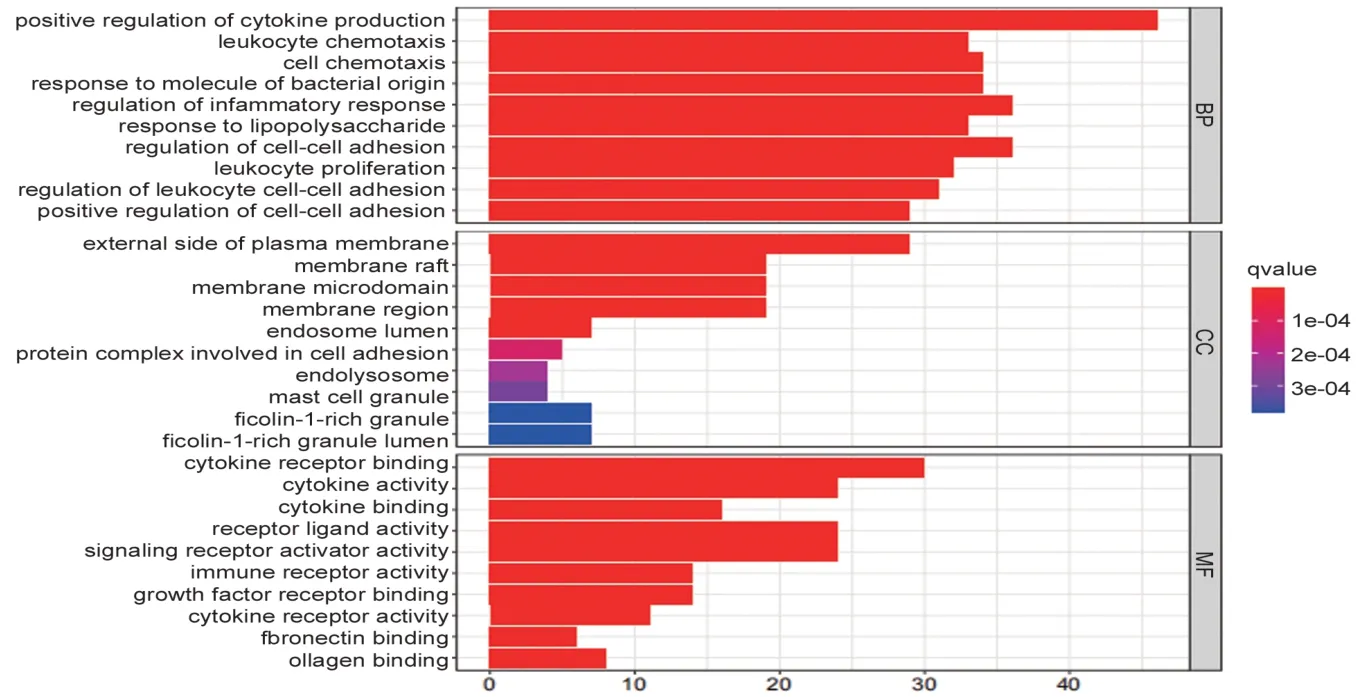
图6 交集基因GO条形图
经KEGG 通路富集分析共得到131条通路富集结果,主要涉及细胞因子-细胞因子受体相互作用通路、恰加斯病、类风湿性关节炎、新型冠状病毒肺炎、肺结核、人巨细胞病毒感染、TNF信号通路)、破骨细胞分化、人T细胞白血病病毒1感染等。提示甘草附子汤可能通过以上通路发挥对RA的治疗作用。见图7。

图7 交集基因KEGG条形图
2.6 潜在活性成分-核心靶点分子对接分析根据甘草附子汤“活性成分-核心靶点”网络中靶点与成分连接的度值,选取活性化合物中degree>20 的槲皮素、山柰酚、柚皮素、芒柄花素4 个主要有效成分,分别与经拓扑分析筛选后的关键核心靶点IL-6、JUN、MAPK14 进行分子对接。分子之间结合能量较低的构象则较为稳定,筛选对接结果中结合能量低的分子构象即为最优对接结果,结果表明槲皮素、山柰酚、柚皮素、芒柄花素与IL-6、JUN、MAPK14 的结合能均≤-6.0 kcal/mol,展现出良好的结合力。见图8,表3。

图8 潜在活性成分-核心靶点分子对接分析

表3 槲皮素、山柰酚、柚皮素和芒柄花素与RA潜在靶点结合能量 kcal/mol
3 讨论
甘草附子汤临床应用广泛,为深入研究其治疗RA 的作用机制,本研究采用网络药理学的方法,共筛选出127 个活性成分及133 个靶点,其中槲皮素、山柰酚、柚皮素、芒柄花素等活性成分对应靶点较多,是甘草附子汤治疗RA 的主要成分。槲皮素具有抗炎、抗氧化、调节免疫等作用[14-15],可促进RA成纤维样滑膜细胞的凋亡[16],降低IL-1β诱导的前列腺素E2(prostaglandin E2,PGE2)产物量与MMP-1、MMP-3、MMP-13的含量表达,抑制NF-κB激活,减弱炎症环境下软骨细胞内MMP-13 的产生、基质降解和细胞凋亡,从而起到保护软骨的作用[17-18]。山柰酚具有显著的抗炎作用,可通过抑制丝裂原活化蛋白激酶(MAPK)、磷脂酰肌醇-3-激酶(PI3K)等信号通路的表达,调控炎症反应过程,减少炎症因子产生,从而有效抑制炎症的发生发展[19]。柚皮素、芒柄花素等活性成分也有抗炎、抗氧化、调节免疫等作用[14-15],但关于其治疗RA 的作用目前鲜见报道,这可作为将来研究中药活性成分治疗RA 的新方向。上述成分在经过分子对接后进一步验证其可信度,为下一步临床研究治疗RA提供了新依据。
通过PPI 网络拓扑分析后筛选到JAK2、JUN、IL-10、TNF、CSF2、CCL2、JAK3、IL1B、JAK1、MAPK14、IL-2、IL-6 等12 个核心靶点,其中以IL-6 最为关键。IL-6 是活动期RA 患者血清及关节液中含量最高的细胞因子之一,其功能涉及多种与炎症相关的疾病状态,包括对糖尿病和全身性RA 的可疑性[20-21]。同时,破骨细胞活性与关节破坏程度密切相关,IL-6 作为一种炎性因子,可引起人体内破骨细胞与成骨细胞之间的平衡失调,是造成RA发生发展的主因之一[22]。高浓度的IL-6 可刺激骨吸收的调节作用,进一步刺激破骨细胞的前体细胞,激发破骨细胞活性,导致骨质破坏,通过多通路、多靶点参与RA 的炎症反应过程[23-24]。抑制IL-6的表达已成为治疗RA的新方法[25],托珠单抗(tocilizum)是目前广泛应用于临床治疗RA 的强效药,可通过结合IL-6 跨膜及溶解性受体来抑制IL-6 介导的信号转导,从而有效地缓解症状,预防关节破坏[26-27]。丝裂原活化蛋白激酶(MAKP)可参与细胞分化、增殖、生长、免疫调控等多种活动[28],有研究发现,microRNA-137 通过MAPK 信号通路和IL-6/COX-II 活化在PMS 诱导的RA 急性加重中起重要作用[29]。转录因子AP-1(JUN)由多种蛋白复合物组成,广泛参与调节细胞生命,如细胞分化、增殖、凋亡等过程,与外界环境压力、细菌及病毒感染、多种疾病和病理损伤的发生发展密切相关,如神经退行性疾病、RA、肿瘤等[30-31]。TNF靶点也非常重要,TNF 参与机体的免疫调节和炎症反应[32],而TNF-α 在维护骨、软骨组织的完整性及促进损伤修复方面发挥重要作用[33]。相关研究表明,其余靶点基因也与RA 密切相关,在此不再赘述。由此推测,甘草附子汤中的中药有效成分可能是通过上述靶点发挥治疗RA的作用。
GO 富集分析主要涉及对细胞因子产生的正调控、对细胞黏附调节、对炎症反应的调节、对细菌源分子的反应、对脂多糖的反应等生物过程的调节。其中,细胞因子是RA 炎症及关节损伤的重要介质,是免疫原、丝裂原或其他刺激剂诱导多种细胞产生的低分子量可溶性蛋白质,具有调节固有免疫和适应性免疫、血细胞生成、细胞生长及损伤组织修复等多种功能,细胞因子网络的不平衡可能诱导和维持炎症及相应的组织损伤,在RA 发病机制中有重要作用,与RA 最密切相关的细胞因子包括TNF-α、IL-6、IL-2 等[34-36]。脂多糖可刺激内皮细胞诱导转录因子核因子κB(nuclear factor kappa-B,NF-κB)活性升高,并上调其他炎症因子(如TNF-α、IL-1β)的表达,导致炎症的持续发生以及骨质的持续破坏并与其发生协同作用,产生炎症性疾病[37]。由此可知,在RA 的病理过程中,炎症反应是重要环节,如何使用中药缓解RA的炎症反应是治疗的重要内容。
KEGG 通路富集分析结果显示,甘草附子汤作用RA 的靶点主要涉及细胞因子-细胞因子受体相互作用通路、恰加斯病、类风湿性关节炎、新型冠状病毒肺炎、肺结核、人巨细胞病毒感染、TNF 信号通路、破骨细胞分化通路、人T 细胞白血病病毒1 感染等。以上通路大多数涉及炎症反应和骨破坏,而炎症反应和骨破坏是RA 的主要临床表现,骨平衡被破坏是导致骨侵蚀的主因,炎症反应直接或间接诱导破骨细胞分化,并使其功能减少,导致RA骨破坏[38]。TNF信号通路是炎症反应的重要通路,可以激活MAPK/NF-κβ等加剧炎症反应[39]。良好的TNF 抑制剂临床疗效也验证了该因子及其通路在RA 中的重要地位[40]。除上述信号通路外,尚有多条信号通路参与甘草附子汤治疗RA 的过程,这些信号通路为我们进一步研究甘草附子汤与RA 的关系提供一定依据和思路。由此预测,甘草附子汤主要是通过调节上述通路下调炎性因子表达,调节骨代谢,干预骨破坏,调节免疫功能等发挥治疗RA的作用,从而改善患者的生活质量。
为验证网络预测的准确性,利用分子对接技术,选取甘草附子汤中4 个核心活性成分(槲皮素、山柰酚、柚皮素、芒柄花素)与关键靶点IL-6、JUN、MAPK14 结合,结果提示结合能量均≤-6.0 kcal/mol,匹配能量较低,说明小分子与大分子结合的构象稳定,结合性好,展现出良好的亲和力,也验证了本研究成果。
综上所述,RA 是一种病理机制非常复杂的疾病,甘草附子汤治疗RA 的作用机制是一个多基因、多生物过程及多信号通路共同参与过程,符合中药治疗疾病多成分、多靶点的特征。本研究通过网络药理学和分子对接技术,初步预测甘草附子汤对RA 的主要有效成分、作用靶点、相关通路及协同作用的分子机制,为后续进一步开展机制研究、药物开发及临床试验等奠定基础,也提供了理论依据、线索与思路。
