TKX- 50/O2 混合体系的热分机理
2023-11-27朱丽
朱 丽
(西南大学 物理科学与技术学院,重庆)
概述
由于TKX-50 具有高密度(1.877 g.cm-3)、高爆速(9 698 m.s-1)、低冲击灵敏度(20 J) 和低摩擦灵敏度(120 N)等特点,具有同时满足高能量储存和低危险性要求的潜力,在含能材料中具有广阔的应用前景[1-4]。自TKX-50 于2012 年由Fischer 等人首次合成以来,已有多个团队对TKX-50 的合成及其性质进行了研究。由单键或双键连接的聚合氮,由于键能的差异,当聚合氮完全分解成N2时,放出极大的能量,分解产物主要是氮气,清洁无污染,而且不易被检测,在军事上具有低信息的优点[5-6]。
尽管前人在实验和理论方面做了很多努力,但我们对TKX-50 在富氧下的主要反应路径和反应动力学性质的认识还不够充分。研究富氧对EMs 分解动力学的影响对于更好地理解相关机制和解决安全问题至关重要。特别是通过动力学模拟可以直接观察到含能材料在极端条件下的微观分解过程,这是很难直接从实验中获得的[7]。为了研究TKX-50 在氧气中的热分解反应,我们利用周期量子力学(DFT 紧密结合,DFTB)的力对晶体进行了分子动力学模拟,以发现高温下的初始反应步骤。然后,我们利用Fortran 后处理代码来确定反应途径、过渡态几何形状。
1 模拟的细节
本研究构建了含8 个TKX-50 分子(2592 个原子)的8 超胞,模拟其热分解过程,用8 个TKX-50 分子和16 个氧分子混合的T-TKX-50 超级单体混合在一个非晶细胞(AC)模块中模拟氧化,获得其初始结构如图1 所示。并对TKX-50/O2结构进行几何优化,在此基础上进行第一性原理分子动力学模拟。首先,我们采用了NVT 系综(恒定温度、恒定体积和恒定原子数)在300 K 下进行了1.3 ps(时间步长为0.25 fs)的分子动力学模拟,以达到结构平衡。随后,我们使用Nose'-Hoover 恒温器来控制温度,在固定的温度3 000 K 下进行了NVT 分子动力学模拟,模拟时间步长为7.5 ps。选择如此高的温度,是因为首先在高温下,分解速率大大提升,在很大程度上会缩短模拟的时间,这正体现了模拟的优点;其次,含能材料在爆炸时会产生极高的温度。在所有模拟中,将每个反应分子动力学模拟的时间步长设置为0.25 fs,每0.25 fs 记录一次包含原子位置和速度的动态轨迹。
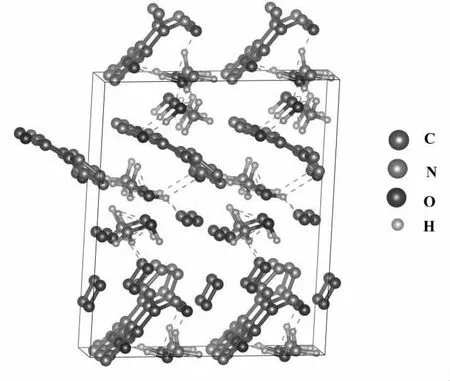
图1 TKX-50/TNA 结构(8 个TKX-50 分子的16 个氧气分子的混合超胞)
2 结果和讨论
2.1 TKX-50/O2 的热分解产物与势能演化
主要的小分子最终产物为N2、H2O、NH3和CO2,主要的中间产物为N2O、NO 和羟胺。图2 为3 000 k时的产物演化。NO、H2O 最先产生,随着分解的进行,数量从0 逐渐增加,并在5 ps 左右达到稳定。NO、NO2和CO 为主要的中间产物,数量先增加,随着反应的继续将减少,特别是CO,在后期减少为0。模拟结果表明,TKX-50/O2最丰富的产物为N2,释放N2分子的分解反应数量一开始就增加,然后逐渐保持恒定水平,说明N2分子的产生在整个分解过程中是连续的。氨分子的数量急剧增加到最大值,然后几乎保持不变,说明氨分子主要是由TKX-50 的NH3OH+离子的分解产生的,中间产物之间的反应不产生氨分子。在分解开始时,没有产生CO 分子,这说明C2O2N82-和NH3OH+离子的分解并不直接产生CO,而CO 主要是由中间产物之间的反应产生的。水分子的数量在一开始就增加了,然后逐渐减少,最后保持不变,这说明水分子作为一种中间产物,在分解过程中可能与其他中间产物发生反应。在反应后的产物H2O 仍然占大部分,水作为中间产物在反应时会消耗一部分,也是主要的产物。在5 Ps 左右各小分子数几乎达到了平衡。我们将平衡后的产物的个数及其来源统计在表1 中,从表1 中可以看出加入足够的氧气,总的小分子气体总数是增加的,由于氧气提供了足够的氧原子,使得H2O、NO、CO2的数量增多,特别是NO,在纯TKX-50 中,它作为中间产物几乎在反应中被消耗完,但是加入足够的氧后,虽然会消耗一部分,但是平衡后NO 的数量大幅度增加了,随着反应的进行将被消耗,但平衡时任还有许多的有毒气体NO。并且无毒且对环境无污染的气体N2大幅减少。
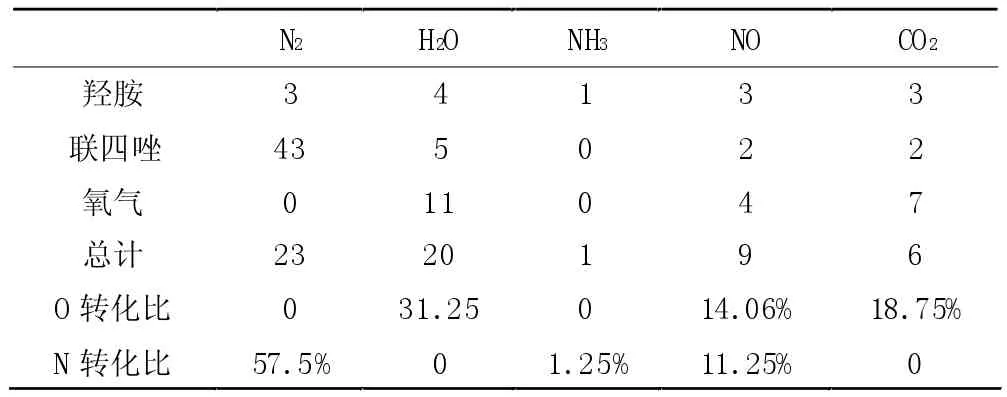
表1 分解产物的个数及其来源
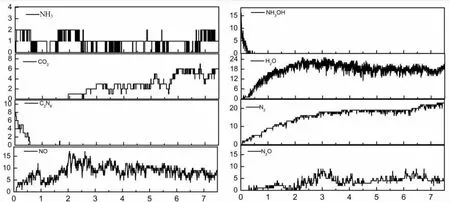
图2 TKX-50/O2 在3 000 K 下的产物随时间的演变
分子势能与分子相互作用和相对位置有关,因此体系总势能的演化决定了化学反应是否平衡。图3 给出了势能随时间演化曲线。势能在很短的时间内达到最大值,这表明吸热,然后逐渐降低,这是放热反应。势能的下降速率随着时间的推移而减小,并最终趋于稳定。势能的下降速率直接取决于放热反应的进行,可以用指数函数来拟合:
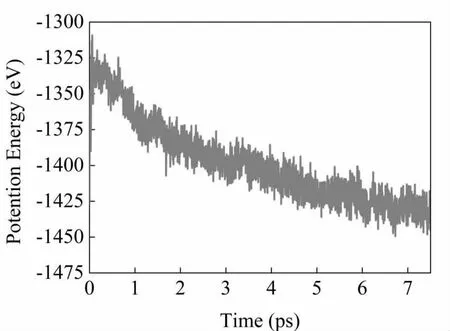
图3 体系势能随时间的演化
式中,U∞为渐进能量;ΔU 为反应热;tind 为诱导时间(表示放热反应开始的时间);k 为有效反应速率常数。先通过多项式拟合,确定了放热的开始时间,通过上面的公式,对放热阶段的数据进行拟合得到了反应热,加入足够的氧气后ΔU 为98.86(eV),相比于未加氧气的TKX-50,放热是有所提升的,这可能与分解产物的总的小分子数增多有关。
2.2 2TKX-50/O2 的热分解路径
为了获得加入氧气后TKX-50 的初始分解路径,使用一系列后处理代码对模拟得到的轨迹进行分析处理。得到了7.5 ps 内频率最高、最重要的主要反应,展示在图4 中。为了便于分析,我们对四唑环中的化学键用阿拉伯数字做了标记。热分解的首反应是羟胺阳离子(NH3OH)+上的氢转移到联四唑环(C2N8O2)2-上或者游离在系统中。体系中的主要产物N2少量来源于NH3OH+,大部分来源于四唑环。体系中所产生的氨气,来源于NH3OH。通过对每个化学键的断键前后及其原子追踪,发现四唑环首先是通过氮氮键的断裂来打开,路径P1 是通过1 号键的断裂来打开环的,1 号和2 号键的断裂将形成中间产物ON,2 号与4 号键最弱,他们最容易断裂去形成N2,1 号键与5 号键它们最不容易断裂,导致了C 上面附的N 不容易形成氮气,最终形成大分子产物。对于四唑环在最早的分解阶段,N-N 键的裂解表现出相当大的反应活性。观察到N-N键的断裂环开始打开,并生成第一个氮气,再此基础上,再进行深度裂解形成气体小分子,最后仍有一些没有裂解彻底并聚合形成了大分子产物。N2是四唑环热分解的第一气态产物。TKX-50 的氧平衡为负痒平衡,加入足够多的氧气后,导致体系内的氧原子过多,反而更容易形成有害气体NO, 氮气的产生率有所下降,加入足够的氧气后,能量释放稍微有所增加,可能与最后形成的小分子气体增多有关,不过不利于环境保护,减少氧气量或者加入其他含能氧化剂可能效果有所改善。
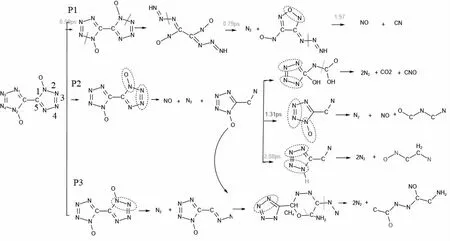
图4 加氧后TKX-50 的反应路径
3 结论
综上所述,当在TKX-50 中加入足够的氧,加入足够的氧气,总的小分子气体总数是增加的,反应能量释放会稍微有所增加,但由于氧气提供了足够的氧原子,使得H2O、NO、CO2的数量增多,特别是NO,但无毒且对环境无污染的气体N2大幅减少。减少氧气量或者加入其他含能氧化剂可能使环境有所改善。
