山药炭疽病病原菌的分离鉴定及其室内毒力测定
2023-11-27易思情金晨钟郭开发段秋媛
陈 功,易思情,金晨钟,2,郭开发,2,胡 彪,段秋媛
(1.有害生物绿色防控重点实验室·湖南人文科技学院 湖南娄底 417000;2.娄底市农业科学研究所 湖南娄底 417000)
山药(Dioscorea oppositaThunb.)即淮山,为薯蓣科薯蓣属植物[1]。青树坪淮山是国家地理标志产品,也是湖南地方特色品种,产自“全国重点镇”湖南双峰青树坪镇,具有山药界的“丑”山药之名,青树坪山药外形毛多、疙瘩多、弯曲不整齐,但口感细腻,性粉,粉中带糯,可媲美河南铁棍山药。其主产区土壤有机质含量高,微量元素丰富,经国家农业农村部农产品质量监督检验测试中心检测,青树坪山药中的硒元素含量较丰富,已经达到国家“富硒产品”要求,长久食用既可以提高身体素质,又能增强人体的免疫功能[2]。
近年来,随着农业产业结构调整和市场需求量的不断增加,双峰青树坪山药种植面积逐年扩大,病害问题日益突出。当山药茎叶受到炭疽病危害后,受害区域一般减产20%~30%,严重时在50%以上。炭疽菌属(Colletotrichum)是一种分布范围广、寄主植物多、侵染能力强的真菌性病害,危害柑橘、草莓、高粱和玉米等多种农作物从而引发炭疽病,导致严重的经济损失[3-4]。炭疽病病原菌的分生孢子主要通过风雨传播,有时昆虫也能作为传播媒介,孢子萌发后即可从气孔、皮孔等自然孔口入侵,也可以从伤口入侵[5]。天气条件适宜尤其高温高湿、种薯品质不佳、种植不合理、农业管理措施不当和农药使用不科学等都会引起炭疽病,造成严重的经济损失[6]。已有文献报道,引起山药炭疽病的主要病原菌有胶孢炭疽菌(Colletotrichum gloeospori‐oides)[7-8]、薯蓣盘长孢菌(Gloeosporium pestis)和辣椒炭疽菌(Colletotrichum capsici)[9],不同地区山药炭疽病的病原菌种类不同。笔者研究的山药病叶源于双峰青树坪镇的山药种植基地,将采集到的山药炭疽病病叶进行组织分离,结合致病性测定、形态学特征观察和分子生物学分析,明确山药炭疽病病原菌种类及筛选适合的化学药剂,可为双峰县山药炭疽病害的防治提供参考。
1 材料与方法
1.1 材料
2022 年6 月在湖南娄底市双峰县巡胜蔬菜种植专业合作社山药基地采集山药炭疽病样品,品种为湖南地方特色品种青树坪山药,共采集样品9 份。
供试杀菌剂:5%己唑醇悬浮剂(上海沪联生物药业(夏邑)股份有限公司);32.5%苯甲嘧菌酯悬浮剂(上海沪联生物药业(夏邑)股份有限公司);10%苯醚甲环唑水分散粒剂(先正达南通作物保护有限公司);70%丙森锌可湿性粉剂(拜耳股份公司)。
1.2 方法
1.2.1 病原物的分离与纯化 采用组织分离法[10]对典型的山药炭疽病病样进行分离纯化。取典型的山药炭疽病叶,放入超净工作台中,用75%乙醇擦拭干净,待叶片自然干燥后,取病健交界部位的叶组织(大小约为5 mm×5 mm)浸泡在2%次氯酸钠溶液中1 min,用无菌水漂洗3 次后放置在无菌滤纸上,使其干燥,然后接入PDA 平板,处理完成后放置培养箱中培养,2 d 后在WA 平板上进行单孢纯化,经多次纯化,将分离物接种在PDA 斜面试管中并培养一段时间后置于4 ℃冰箱保存,以备后续试验使用。
1.2.2 病原菌形态学特征 将病原菌PDA 培养基放入恒温培养箱中(25 ℃)培养10 d,制作临时玻片,对菌落形态、色泽、大小、分生孢子等进行观察拍照。在显微镜下参照张天宇[11]的方法观察分生孢子和孢子梗以及产孢细胞的形态和大小特征进行分类。
1.2.3 致病性测定 选用长势健康的山药叶片进行田间标记,对健康山药叶片采用孢子悬浮液进行喷雾接种完成致病性测定。在已分离纯化的菌落上用灭菌的打孔器(直径=5 mm)打取数个菌饼,将其置于PD 液体培养基中,放入恒温摇床,诱导产孢,使用血球计数板计数7 d 后的孢子浓度,用无菌水将其调整为1×106个孢子·mL-1。将健康山药叶片用75%酒精表面消毒后,使用无菌接种针进行划伤处理,用喷雾壶将孢子悬浮液均匀喷洒,以不接种孢子悬浮液的健康山药叶片作为对照,将接种后的山药叶片用套袋保湿培养48 h,3 次重复,定期观察病斑生长情况,拍照记录以及测量病斑直径,观察是否与田间病斑一致,同时对发病部位进行组织分离,比较是否与最初分离接种的发病菌株菌落特征和分生孢子形状相同,确认其致病性。
1.2.4 分子鉴定 取PDA 培养基上具代表性菌株的菌丝组织,研磨后用DNA 提取试剂盒,提取病原物的基因组DNA。使用引物ITS1/ITS4[12]进行PCR扩增。PCR 反应体系:总体积为50 μL,2×EasyTaqPCR SuperMix(+dye)25 μL、ITS1 2 μL、ITS4 2 μL、DNA 模板1 μL、ddH2O 20 μL。PCR 扩增反应程序为:94 ℃4 min、94 ℃30 s、55 ℃30 s、72 ℃40 s,30个循环,72 ℃10 min。反应完成后,用1%琼脂糖凝胶电泳检测PCR 产物,将PCR 产物送至生工生物工程(上海)股份有限公司进行测序,测序完的基因序列进行校正处理,然后在核酸序列数据库Gen-Bank 当中搜索比对同源序列,对比分析代表菌株与数据库已知的相关序列的同源百分率。代表菌株根据ITS 基因的扩增序列,然后利用MEGA 7 软件,通过自展法(bootstrap)构建系统发育树。
1.2.5 病原物的室内毒力测定 采用菌丝生长速率法进行室内毒力测定。供试杀菌剂有5%己唑醇悬浮剂、32.5%苯甲嘧菌酯悬浮剂、70%丙森锌可湿性粉剂、10%苯醚甲环唑水分散粒剂。在预试验的基础上,分别吸取各化学药剂滴入PDA 培养基的培养皿中(V化学药剂:VPDA培养基=1∶9),混匀,冷却凝固备用,每个浓度梯度3 次重复。4 种供试杀菌剂的最终质量浓度分别为32.5%苯甲嘧菌酯(650、325、162.5、81.25、40.625 mg ·L-1),5%己 唑 醇 悬 浮 剂(100、50、25、12.5、6.25 mg·L-1),70%丙森锌(1400、700、350、175、87.5 mg·L-1),10%苯醚甲环唑(5、2.5、1.25、0.625、0.321 5 mg·L-1),对照组则是在培养基中加入等量无菌水。使用已灭菌打孔器(直径=5 mm)在分离纯化后的菌落中打取菌饼1 块,将其接种在PDA 平板中央,放置恒温培养箱中(25 ℃)培养,用十字交叉法测量7 d 后的培养基菌落直径,记录数据,得出菌丝生长抑制率。求毒力回归方程,计算EC50及相关系数。
抑制率/%=[1-(处理菌落直径-菌饼直径)/(对照菌落直径-菌饼直径)]×100;
农药质量浓度/(mg·L-1)=(含量百分数/稀释倍数)×106。
1.3 数据处理
使用Excel 13.0 进行数据分析和绘图制表。
2 结果与分析
2.1 山药炭疽病田间症状及致病性测定
田间调查可见,山药炭疽病发病初期为不规则的褐色小点,周围伴有明显的黄色晕圈,病斑扩大后中间凹陷,颜色呈浅灰褐色,边缘呈黑褐色,病健界限明显,见图1。将病原菌离体接种到健康山药叶片上,接种3 d 后观察试验接种症状,发病叶片病斑中间部位下陷,呈暗灰色,边缘呈黑褐色,与田间观察一致,空白处理不发病,见图1。并且对发病病斑进行组织分离法后可重新分离鉴定为同一种病原菌。

图1 山药叶片致病性测定Fig.1 Pathogenicity determination of yam leaves
2.2 病原菌形态特征
从采集的9 份山药炭疽病病叶中分离得到9份病原菌,获得纯培养后观察(图2),菌落正面菌丝较为致密,呈褐绿色毛毡状,并形成几圈散落的橙红色孢子堆,具同心轮纹(图2-A)。显微镜下观察分生孢子为无色、圆桶形、两端钝圆、光滑、单孢、内有油滴状颗粒物,大小为(14.4~19.7)μm×(4.6~5.9)μm(n=50)(图2-C)。根据真菌分离物形态特征,初步鉴定为炭疽菌属(Colletotrichum)。

图2 炭疽菌属形态特征Fig.2 Morphological characteristics of the Colletotrichum
2.3 分子生物学鉴定
为准确鉴定病原菌的种类,对该病原菌采用ITS 基因序列进行PCR 扩增,经电泳检测可得500 bp左右的条带。登录NCBI 将测得的基因序列进行BLAST 比对(图3),9 株病原菌(T2、T5、T6、T7、T9、T11、T12、T21、T22)的ITS 基因序列(登录号依次 为:OQ607561.1、OQ607562.1、OQ607563.1、OQ607564.1、OQ607565.1、OQ607566.1、OQ607567.1、OQ607568.1、OQ607569.1),与已登录的菌株Colletotrichum gloeosporioides(登录号依次为EF208618.1、AJ311880.1),相似性在99%以上。使用MEGA 7 进行系统发育分析,该病原菌和胶孢炭疽菌(Colletotrichum gloeosporioides)聚为一个分支,进一步表明该菌株为胶孢炭疽菌(Colletotri‐chum gloeosporioides)。
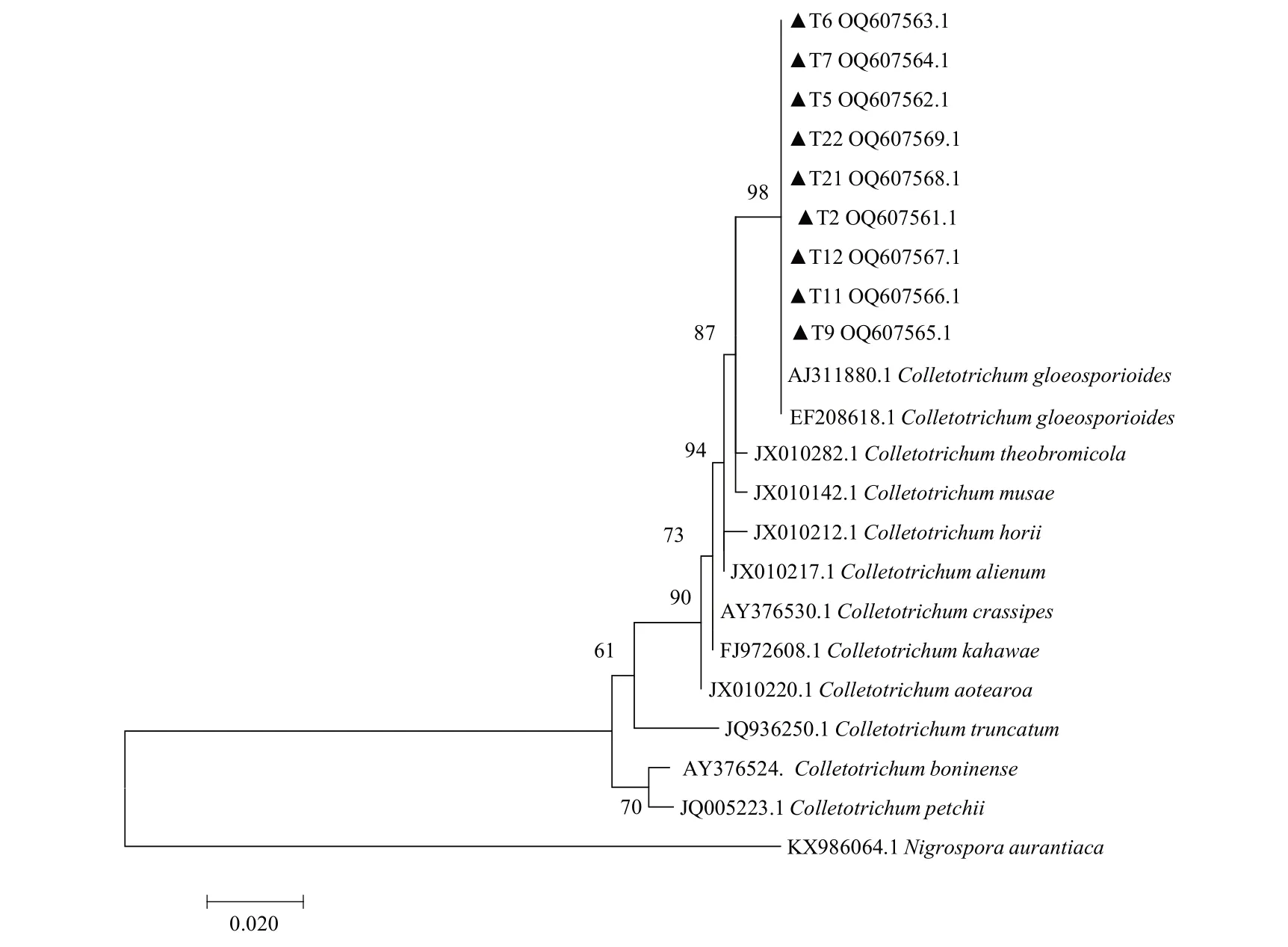
图3 基于ITS 基因构建的系统发育树Fig.3 Phylogenetic tree constructed based on ITS gene
2.4 室内毒力测定
由表1 可知,4 种化学药剂的EC50大小顺序为:70%丙森锌可湿性粉剂>5%己唑醇悬浮剂>10%苯醚甲环唑水分散粒剂>32.5%苯甲嘧菌酯悬浮剂,山药炭疽病菌对后3 种化学药剂表现敏感,其中山药炭疽病病原菌对32.5%苯甲嘧菌酯悬浮剂最为敏感,其EC50为0.020 4 mg·L-1。

表1 供试杀菌剂对山药炭疽病病菌的毒力回归方程和EC50Table 1 Virulence regression equation and EC50 of the tested fungicides against the pathogen of yam anthracnose
3 讨论与结论
炭疽病是山药种植中普遍发生的真菌病害,该病主要危害叶和茎,不同地区山药炭疽病的病原菌种类不同[13]。众多研究结果表明,山药炭疽病病原菌种类繁多,其中有关于胶孢炭疽菌Colletotri‐chum gloeosporioides的 报 道 最 多[7-8,14]。而 韩 晓 勇等[15]认为,引起紫山药炭疽病的病原菌是喀斯特炭疽菌Colletotrichum karstii、胶孢炭疽菌Colletotri‐chum gloeosporioides、暹罗炭疽菌Colletotrichum si‐amense、隐秘炭疽菌Colletotrichum aenigma、薯蓣盘长孢菌Gloeosporium Pestis[15]和辣椒炭疽菌Col‐letotrichum capsici[16]。炭疽菌类真菌在属和种的命名上曾经发生过重大变更,是同物异名,或是不同地域存在不同病原种,需要进一步深入了解。
目前,控制该病害的发生主要还是采用化学防治的手段,笔者在本试验中采用4 种杀菌剂对双峰青树坪山药炭疽病菌进行室内毒力测定,试验结果表明,室内毒力测定中5%己唑醇悬浮剂、10%苯醚甲环唑水分散粒剂、32.5%苯甲嘧菌酯悬浮剂3 种化学药剂对山药炭疽病病原菌均具有较好的抑菌效果,这与陈建等[17]、张帅等[8]对炭疽病原菌的研究基本一致,而且32.5%苯甲嘧菌酯悬浮剂是一种高效低毒的新型复配杀菌剂,在辣椒、水稻等农作物病害防治中已有应用研究,在生产过程中,不但能提高对该病的防治效果,还降低了成本,有效减少了农药用药量,以及降低产生抗药性的风险[18]。
笔者从双峰青树坪采集山药炭疽病病样9 份,分离得到9 株分离物,经致病性测定、形态学特征观察、18S rDNA-ITS 基因序列分析,明确引起山药炭疽病的病原物为胶孢炭疽菌Colletotrichum gloeosporioides。该病原菌对5%己唑醇悬浮剂、32.5%苯甲嘧菌酯悬浮剂、10%苯醚甲环唑水分散粒剂3 种化学药剂敏感,这些药剂可用于山药炭疽病的化学防治。通过对山药炭疽病的发生危害调查、病原菌鉴定、致病性测定及病原菌室内毒力测定的研究,为今后该病害发生和流行规律研究及科学防治奠定了基础。
