应用SSR 分子标记分析烟台地区黄瓜种质资源遗传多样性
2023-11-27满孝源王湘懿张凯歌陈晓峰
满孝源,王湘懿,张凯歌,胡 凌,陈晓峰
(中国农业大学烟台研究院 山东烟台 264670)
黄瓜(Cucumis sativusL.,2n=14)是葫芦科黄瓜属一年生蔓生植物,是一种世界性蔬菜,又名王瓜、胡瓜、青瓜,在果菜类蔬菜中具有很高的地位[1]。我国是黄瓜生产大国,其栽培面积占世界黄瓜栽培总面积的一半以上,产量和规模均居世界第一位。山东黄瓜地方品种由于栽培历史较久和引入途径不同,加之山东省不同地区气候差异较大,在长期自然和人工定向选择下,形成类型多、品种资源丰富的特点[2-3]。以白黄瓜和地黄瓜为代表的烟台地方黄瓜,因其具有品质优良、营养丰富、口感鲜脆等特点,市场地位不断提高[4-5]。随着市场需求扩大,黄瓜栽培及其选育品种逐渐增多,原优良品种在选育过程中纯度逐渐降低,在生产中重名现象普遍,烟台地区种质资源研究相对落后,导致优质种质流失严重[6]。
21 世纪以来,分子生物学得到了突飞猛进的发展,越来越多的分子标记技术相继出现,并逐渐广泛应用于作物遗传育种、植物亲缘关系鉴别、基因库构建等各个领域,例如RFLP、ISSR、RAPD、AFLP、SSR 等[7-10]。SSR(Simple Sequence Repeat)称为简单重复序列,具有单基因座、等位基因变异多、多态性丰富、信息量大、稳定性好、操作简单、进化所受选择压力小、特异性强等优点[11]。在众多的分子标记中,SSR 能精准识别目标基因DNA 片段大小,检测结果可靠、稳定且准确,所以SSR 荧光标记常应用于植物遗传分析、分子信息身份证的构建、品种鉴别等方面的研究[12]。王宇晴等[13]利用22 对SSR 核心引物,研究了111 份甜菜登记品种的相关遗传信息,邱杨等[14]从22 对引物中筛选出8 对,构建了75 份萝卜种质资源的分子身份证,徐晓丹等[15]用6 对多态性引物将36 份小豆品种区分成4 个类群。
笔者在本研究中对胶东地区主要栽培的黄瓜品种和全国多地性状及生长特点相似的品种进行遗传多样性分析,利用SSR 分子荧光标记技术,构建烟台地区黄瓜的遗传指纹图谱和分子身份证,再对其进行品种划分,最后采用聚类分析法确定各黄瓜品种间的亲缘关系,为烟台地区黄瓜的品种鉴定、种质资源保护和种质创新等提供参考依据。
1 材料与方法
1.1 材料
试验材料为22 份烟台地区主要栽培的黄瓜种质(表1),其中21 份种质来自山东、湖南和河北等省(市)不同种业公司,1 份是中国农业大学烟台研究院自育未授权品种。2022 年10—12 月,于中国农业大学烟台研究院温室播种黄瓜种子,采用随机区组方式于72 穴盘种植,每份种质播6 穴,培育至2 片真叶期后,每份种质随机取2~3 片真叶用于本研究。

表1 黄瓜种质资源及其主要农艺性状Table 1 Germplasm resources and main agronomic characters of cucumber
1.2 方法
1.2.1 基因组DNA 的提取与检测 采用上海生物工程有限公司Ezup 柱式植物基因组DNA 抽提试剂盒(批号B518261)提取DNA,取新鲜黄瓜真叶0.5 g,经过DNA 提取后,用1.4%琼脂糖凝胶电泳法检测DNA 的完整性,再用分光光度计检测样本纯度,保证OD260/280在1.8 以上,合格后将所有样本稀释,以备后续试验。
1.2.2 SSR 引物筛选 从近年来发表文献上选用特异性较好的引物[16-25],引物筛选遵循扩增多态性原则,挑选30 对引物。先通过常规PCR 扩增检测各引物的多态性,选取多态性较高的9 对引物(表2)。

表2 黄瓜种质资源SSR 分子标记检测的引物来源及其序列Table 2 Primers for SSR molecular labeling detection of cucumber germplasm resources
1.2.3 PCR 扩增体系 PCR 扩增体系如下:1 μL 模板DNA(20~50 ng·μL-1),引物F(10 μmol·L-1)和引物R(10 μmol·L-1)各0.5 μL,0.5 μL 混合dNTP(5 μmol·L-1),2.5 μL 含MgCl2的Taq缓冲液(10倍),0.2 μLTaq酶(5 U·μL-1),加入ddH2O 至25 μL。PCR 具体反应采用Touch-down PCR[26]:94 ℃预变性5 min;93 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,10 次循环;93 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30 次循环;72 ℃修复延伸,10 min;4 ℃保存。合成包含FAM(蓝色)、HEX(绿色)、TAMRA(黑色)3 种不同荧光染料的SSR 引物,所用SSR 引物均由上海生工生物工程有限公司合成。
1.2.4 荧光SSR 引物检测 采用连续加样器,吸取990 μL HIDI(甲酰胺)和10 μL LIZ-500(分子质量内标)混合均匀,以每孔10 μL 分别加入到96 孔反应 板 中。1200 r‧min-1离 心15 s 后 每 孔再加入1 μ L 样品,紧接着再次离心15 s,密封离心30 s 后置于PCR 仪中,98 ℃变性5 min 后立即置于冰水中冷却,待完全冷却后离心15 s,使用ABI 3730 XL 型DNA 分析仪进行毛细管电泳分析。
1.3 统计分析
对分析仪毛细管电泳输出结果人工读取峰值进行统计,以Excel 2016 进行数据整理并保存[27]。使用DataFormater 软件[28]将整理的数据转化为各相关软件可以识别的格式,并用PopGen32 计算有效等位基因、等位基因、期望杂合度、观测杂合度、Nei’s基因多样性指数和Shannon’s 信息指数;用软件Power Marker 3.2 统计多态性信息含量(PIC)和基因型数量;用UPGMA 法对22 份黄瓜种质进行聚类分析[29]。
1.4 DNA分子身份证构建
参考武志江等[30]的方法,将9 对引物的扩增带型按从小到大顺序排列,并从“1~9”依次按顺序赋值,超过“9”的从小写字母“a”开始按照字母顺序继续编码,将未检测出结果赋值为“0”,最后将9 位数字串联到一起,得出9 位独特的字符串即为该种质的DNA 分子身份证。
2 结果与分析
2.1 SSR引物筛选
利用初步筛选的30 对SSR 引物对22 份种质进行扩增,进一步挑选出扩增条带清晰、稳定性好的引物9 对,部分SSR 引物扩增结果见图1。
2.2 SSR标记多态性分析
由表3 所示,利用9 对SSR 引物对22 份黄瓜种质进行PCR 扩增,共检测到40 个等位基因位点,平均每对引物检测出4.44 个,检测出基因型数量平均4.78 个;其中引物SSR10954 扩增出的等位基因的数目最多,为9 个,引物CSWTAAA01 检测出的等位基因的数目最少,为2 个;有效等位基因(Ne)的范围为1.10~3.34,平均2.17;期望杂合度(He)的范围为0.09~0.72,平均0.48;观测杂合度(Ho)的范围为0.09~0.73,平均0.29;Nei’s 基因多样性指数(H)的范围为0.09~0.70,平均0.47;Shannon’s 信息指数(I)的范围为0.22~1.44,平均0.89;多态性信息含量(PIC)的范围为0.09~0.66,平均0.42。9 对引物的平均多态性较好,适合进行相关遗传分析和分子身份证的构建。部分种质的荧光检测电泳图见图2。

图2 部分黄瓜种质中荧光引物SSR10954 的SSR 扩增结果Fig.2 SSR amplification results of fluorescent primer SSR10954 in partial cucumber germplasms
2.3 SSR指纹图谱的构建
参考黄健婷等[31]的方法,对电泳后的数据进行校正和整理,人工读出等位基因条带,建立22 份黄瓜种质的DNA 指纹图谱(表4),同时制作数字指纹图谱。将表4 中的条带转化为数字0、1,其中“1”代表有扩增条带,“0”代表在相应位点无条带,“9”代表未检测出结果,同时按引物编号顺序和扩增条带片段从小到大顺序,组成一串数字,构成数字指纹图谱[32](表5)。

表5 22 份黄瓜种质的数字指纹图谱Table 5 Digital fingerprint of 22 cucumber germplasms
2.4 构建分子身份证
按照表4 所示的引物序列重新排列,将每对引物在不同样品上扩增得到的带型按照由少到多的顺序排列并将其编码串联得到带型编号(表6),进一步得出22 份黄瓜种质的分子身份证(表7)。其中,奇山压爬架和大禹爬满地两个品种共用一套分子身份证,具体品种差别需要进一步从基因组分析碱基差异,进而才能验证是否存在差异和亲缘关系。由表7 可见,21 份黄瓜种质的分子身份证均不相同,9 对SSR 引物能够区分21 个样本,表明采用的9 对SSR 引物是合理且有效的。
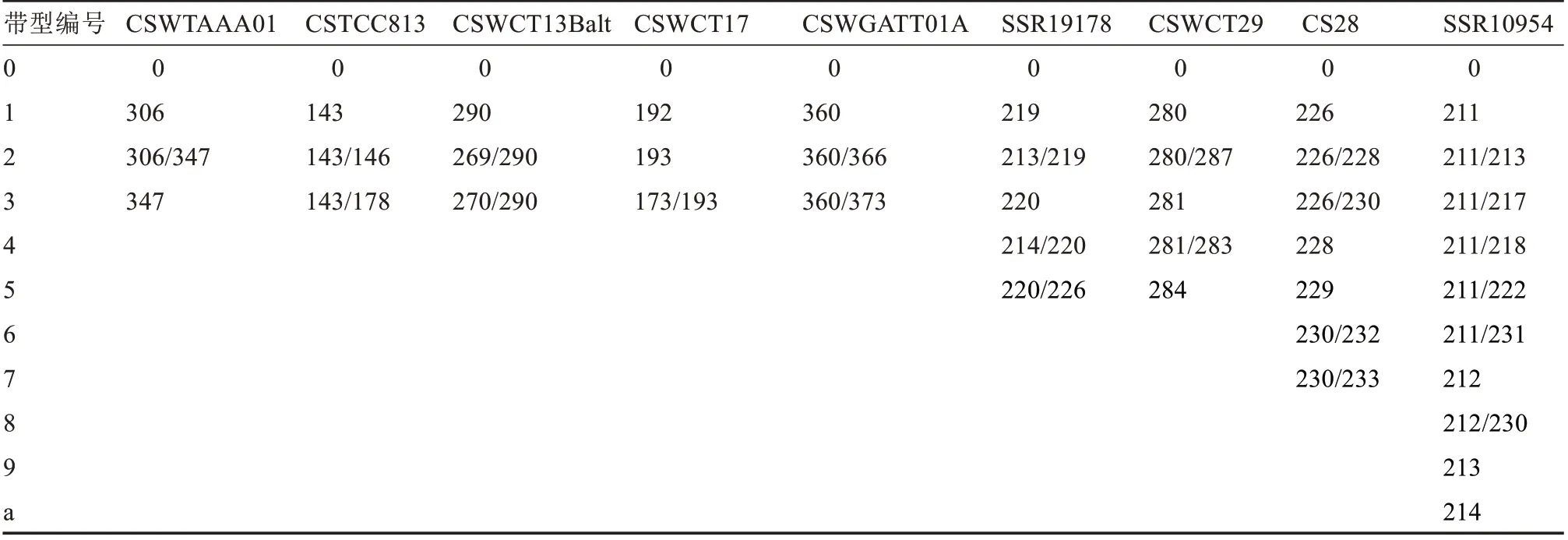
表6 9 对引物的扩增带型编号Table 6 Amplified band number of 9 pairs of primers
按照《商品二维码》和《追溯二维码技术通则》[33-34]的要求,采用二维码快速生成器生成22 份黄瓜种质分子身份证的二维码(表7)。
2.5 不同种质遗传关系聚类分析
使用NTSYSpc2.0 计算不同黄瓜种质间的遗传相似系数(表8)。由表8 可知,22 份黄瓜种质的遗传相似系数为0.25~1.00,其中,奇山压趴架(7)和大禹爬满地(20)之间的遗传相似系数最大,为1.00,表明二者几乎没有遗传差异,具体差别需要进一步分析;湘园813(14)和浏阳白皮(13)之间的遗传相似系数最小,为0.25,说明二者的遗传差异较大,亲缘关系较远。

表8 22 份样本间的遗传相似系数Table 8 The variance range of genetic similarity coefficients among 22 samples
根据9 对引物对22 份种质的扩增结果,用NTSYSpc2.0 分析得出22 份黄瓜种质的遗传关系树状图(图3)。分析表明,当相关系数为0.79 时,将22份黄瓜种质分成六类。第Ⅰ类包含7 个黄瓜品种,第Ⅱ类包含6 个黄瓜品种,第Ⅲ类有3 个品种,第Ⅳ类只有奇山翡翠F1,第Ⅴ类有4 个品种,第Ⅵ类只有玉女。在第Ⅰ和第Ⅱ类中主要是山东省(尤其是胶东地区)主栽的黄瓜杂交品种,有着相同或相似的父母本,其中奇山压趴架和大禹爬满地的性状和生长特点有着比较高的相似度,遗传差异极小;第Ⅲ类中的3 个品种,其农艺性状比较相似;第Ⅴ类中的3 个品种,浏阳白皮、蔬研十二号和上栗白黄瓜主要是湖南省当地杂交品种,另外一个湖南省品种湘园813 归类在第Ⅲ类里,推测是其育种所采用的父母本与第Ⅲ类黄瓜有着较近的亲缘关系。第Ⅳ类中的奇山翡翠F1 推测可能是由湖南省品种杂交而成。第Ⅵ类中的玉女虽然属于山东省培育的黄瓜品种,但与其他几类的黄瓜亲缘关系皆较远。

图3 基于9 对SSR 引物的黄瓜种质资源聚类分析Fig.3 Cluster analysis of cucumber germplasm resources based on 9 pairs SSR primers
3 讨论与结论
烟台地区的黄瓜栽培历史悠久,且地方品种特点明显,种类多样,如何对当地主栽品种进行分类、鉴定,进而培育优良的地方品种是当前黄瓜育种工作的重点。
SSR 分子标记由于其具有检测结果稳定、准确性高、效率高,多用于种质遗传多样性的鉴定,在指纹图谱和分子身份证构建上已经得到了广泛应用。吴仕蔓等[35]通过扩增带型分析,构建了22 份柚类种质的分子身份证,包括12 条信息独特的身份证。唐梅等[36]以48 对SSR 引物构建了24 个香稻品种的指纹图谱。李乔乔等[37]采用37 对SSR 引物对33 份多胚甜菜种质进行遗传多样性分析,将其分成两大类,说明了该分子标记技术的可靠性。SSR 分子标记技术同样在黄瓜的遗传多样性分析中有着广泛的应用,崔洪宇等[38]利用其中的24 对SSR 引物构建的指纹图谱可有效区分所有16 个供试品种。王蕾等[2]基于SSR 分子标记技术筛选出17 对引物,将32 份黄瓜种质聚为5 类。史建磊等[39]利用11 对SSR 特异性引物对黄瓜自交系进行聚类分析,将48 份黄瓜自交系聚为4 个类群。笔者筛选出9 对SSR 引物,利用其对22 份烟台主栽黄瓜种质进行了遗传多样性分析,9 对引物共筛选出40 个等位基因,高于史建磊等[39]研究的结果数,与王蕾等[2]研究中引物多态性较为相近,说明本研究所中采用的SSR 引物多态性良好,可以作为22份种质的分类依据。通过建立的黄瓜聚类分析图表明,遗传相似系数近的种质具有类似的性状特征。在相关系数为0.79 时,可将22 份种质分为六类,I 类群的春秋翠玉、奇山白天使、金棚白玉、碧秀、翠玉白叶三和中科白玉F1 均为短棒状,被聚为一类;V 类群的浏阳白皮、蔬研十二号和上栗白黄瓜均为中长棒状,蔬研十二号和上栗白黄瓜为黄绿色。聚类分析与性状特征分类基本符合,与前人[3-4]结论有一定的相似之处,可以作为依据进一步明确烟台地区现有黄瓜品种间的亲缘关系。
笔者的研究为烟台地区黄瓜的种质资源鉴定与保护、育种亲本选育提供了理论和技术支撑,对于保障黄瓜种质市场良好发展以及弥补烟台地区黄瓜的种质资源研究、利用和评价方法欠缺,为实现种质创新和推动黄瓜育种进程具有重要意义。但有关SSR 分子标记后续应开发筛选更多的引物,增加选用的种质数量,进一步推动种质资源的研究利用。
