高产β-葡聚糖酶木霉菌诱变育种及对黄瓜枯萎病的生防效果
2023-11-27杨春林李洪浩席亚东
杨春林,李洪浩,胡 强,席亚东
(1.蔬菜品种改良与种质创新四川省重点实验室·四川省农业科学院植物保护研究所 成都 610066;2.四川省乐山市植保植检站 四川乐山 614000;3.竹类病虫防控与资源开发四川省重点实验室·乐山师范学院 四川乐山 614000)
β-葡聚糖属于非淀粉性多糖,是葡萄糖以β-1,3和β-1,4 糖苷键连接而成的D 型葡萄糖聚合物[1]。β-葡聚糖除了在植物细胞壁中少量存在外,还是绝大多数病原真菌细胞壁的主要骨架结构成分[2]。β-葡聚糖酶属于水解酶类,广泛存在于细菌、真菌、植物和昆虫中,因来源和序列进化关系的差异,其结构和催化功能呈现多样性,目前关于具有应用潜力的不同来源的β-葡聚糖酶的报道很多[3]。外源β-葡聚糖酶通过催化葡聚糖多聚体的水解而抑制病原真菌的生长及增殖[4],在环境污染和农产品质量安全问题日益突出的今天,作为具有生防功能的生物酶类,β-葡聚糖酶在植物真菌病害防治方面具有很大的研究应用价值。
获得β-葡聚糖酶的途径主要有两种,一种是从动植物体内分离提取[5-6],另一种则是通过微生物发酵。目前报道产β-葡聚糖酶的微生物主要有芽孢杆菌[7-8]、镰刀菌[9]、曲霉菌[10-11]、木霉菌等[12-13]。其中,木霉菌因同时具有空间占位、降解病原菌细胞壁及诱导植物产生防御抗性等多种生防机制,是重要的植物病害生物防治菌[14-16]。由于筛选技术等方面的局限,野生菌株的产酶能力比较低,往往采取人工育种的方式对菌株进行改良[17-19]以获得理想菌株。诱变育种通过诱变剂处理提高菌种的突变概率和变异幅度,从而选出具有优良特性的变异菌株[20]。四川省农业科学院植物保护研究所生防实验室以往的研究表明,哈茨木霉菌株Th-30 对多种蔬菜作物具有防病促生效果[21-22]。笔者采用紫外线照射与亚硝基胍处理相结合的方法对哈茨木霉菌株Th-30进行诱变,选育β-葡聚糖酶高产突变菌株,提高其生防潜力,并评价突变木霉菌株β-葡聚糖酶诱导发酵液对黄瓜枯萎病的防治效果,以期为黄瓜枯萎病生物防治提供新的参考依据。
1 材料与方法
1.1 材料
哈茨木霉菌Trichoderma harzianumTh-30、黄瓜枯萎病菌Fusarium oxysporum由四川省农业科学院植物保护研究所生防实验室保存;3%氨基寡糖素由河北嘉和生物科技有限公司生产;2%春雷霉素由江西省赣州宇田化工有限公司生产;β-葡聚糖、葡萄糖标准品由德国Sigma 公司生产;其他试剂均为国产分析纯。
1.2 试剂及培养基制备
1.2.1 试剂配制DNS 试剂 3,5-二硝基水杨酸3.15 g、酒石酸钾钠91 g、NaOH 20 g、无水亚硫酸钠2.5 g、苯酚2.5 g、ddH2O 1000 mL;亚硝基胍(NTG)溶液:NTG 结晶10 mg、助溶剂甲酸铵0.05 mL、pH 6 磷酸盐缓冲液配成4000 μg·mL-1原液。
1.2.2 培养基制备 初筛培养基(1 L):l g·L-1β-葡 聚 糖、3 g·L-1NaNO3、0.6 g·L-1去氧胆酸钠、1 g·L-1K2HPO4、0.01 g·L-1FeSO4·7H2O、0.5 g·L-1MgSO4·7H2O、0.5 g·L-1KCl、18 g·L-1琼脂,4 g·L-1的刚果红溶液3 mL。葡聚糖诱导培养基:1 g·L-1β-葡聚糖、5 g·L-1蛋白胨、10 g·L-1燕麦粉、1 g·L-1KH2PO4、0.1 g·L-1CuSO4·5H2O、0.1 g·L-1CaCl2·2H2O、0.08 g·L-1MnCl2·4H2O、0.1 g·L-1MgSO4·7H2O、0.07 g·L-1ZnSO4·7H2O、0.05 g·L-1CoCl2·6H2O、0.01 g·L-1FeSO4·7H2O。
1.3 木霉菌的复合诱变育种
1.3.1 单孢子悬液的制备 诱变试验于2021 年7-11 月在四川省农业科学院植物保护研究所病害实验室进行。取斜面保存的木霉菌种,于30 ℃条件下活化培养,用无菌生理盐水冲洗孢子制成悬液,倒入无菌三角瓶中,塞紧棉塞并用无菌牛皮纸包扎瓶口,充分振荡形成单孢子悬液,用灭菌的脱脂棉过滤,血球计数板计数,调整孢子浓度为106CFU·mL-1。
1.3.2 紫外诱变 移取单孢子悬液5 mL 加至无菌培养皿,放入无菌磁力搅拌子,用黑纸包住后置于磁力搅拌器上,距15 W 紫外灯30 cm 处诱变5~45 min。移取经紫外线照射的孢子悬液,将孢子浓度调整为104CFU·mL-1,取0.1 mL 孢子悬液涂布于初筛培养基上,用黑纸包住于30 ℃培养72 h 后统计菌落数,计算致死率。从致死率为70%~80%的平板中挑取生长旺盛、透明圈大的菌落,接种于刚果红鉴定平板上,于28 ℃恒温培养48 h,连续转接3 次,观察记录菌落生长和透明圈产生情况。选取透明圈直径/菌落直径较大的菌株,培养至对数生长期后按1.3.1 的方法制成单孢子悬液进行下一步试验。
1.3.3 亚硝基胍诱变 将5 mL 单孢子悬液、1 mL NTG 溶液加入离心管中,充分混匀,28 ℃水浴振荡5~45 min,离心后去上清液,用无菌水洗涤菌体3~5 次以终止NTG 的诱变作用;加入5 mL 无菌生理盐水,充分摇匀,取0.1 mL 孢子悬液涂布于初筛培养基上,于28 ℃黑暗培养72 h 后统计菌落数,并计算致死率。从致死率70%~80%的平板中挑取菌落进行培养,观察记录菌落生长和透明圈产生情况,选取透明圈直径/菌落直径较大的菌株保存备用。
1.3.4 突变菌株β-葡聚糖酶粗酶液的制备 将突变菌株在PDA 培养基上活化培养至产生大量绿色分生孢子,用5 mL 无菌水冲洗并收集分生孢子液,将孢子浓度调整到106CFU·mL-1后接种到葡聚糖诱导培养基上,于28 ℃、150 r·min-1振荡培养64 h,得到木霉β-葡聚糖酶诱导发酵液。将发酵液于4 ℃、5000 r·min-1离心10 min,取上清液。在上清液中加入分散的硫酸铵,搅拌均匀后于室温静置过夜,将盐析液于4 ℃、8000 r·min-1离心20 min,去上清液,加入5 mL 磷酸盐缓冲液充分溶解,若出现浑浊现象则再次离心10 min;将上清液用0.20 μm 微孔滤膜过滤,除去分生孢子即得β-葡聚糖酶粗酶液,于4 ℃保存备用。
1.3.5β-葡聚糖酶活性测定 采用还原糖法(DNS法)测定突变菌株的β-葡聚糖酶粗提液活性,以1 mL 粗酶液1 分钟水解葡聚糖产生1 μmol 还原糖所需的β-葡聚糖酶量为1 个酶活性单位(U)。
1.3.6 突变菌株生长速率及产孢能力测定 将突变菌株于20 ℃活化培养3 d,用打孔器沿菌落边缘截取直径5 mm 菌块接种于PDA 培养基上,黑暗条件下20 ℃恒温培养2 d 和7 d 分别测量菌落直径和产孢量。
1.3.7 突变菌株产β-葡聚糖酶的遗传稳定性试验 将保存的突变菌株用PDA 培养基活化培养10 d 后进行转接培养,连续转接至第8 代,采用DNS 法测定每代菌株产β-葡聚糖酶活性,研究其高产β-葡聚糖酶的遗传稳定性。
1.4 不同木霉菌β-葡聚糖酶诱导发酵液对室内盆栽黄瓜枯萎病的防治效果
1.4.1 盆栽试验设计及处理 试验于2022 年3-4月在四川省农业科学院植物保护研究所蔬菜病害实验室进行。黄瓜种子经5%次氯酸钠溶液浸种10 min 后用清水冲洗,放入垫有2 层滤纸的培养皿中,置于恒温培养箱于28 ℃催芽;胚根长约5 mm时将其播种于塑料育苗钵内,在20~25 ℃光照培养箱内育苗,每天光照12 h,育苗基质为高温蒸汽灭菌(134 ℃,30 min)的蛭石、草炭和菜田土(体积比为1∶2∶1)。试验设6 个处理:清水对照(CK)、UN-2β-葡聚糖酶发酵液、UN-2β-葡 聚 糖 酶 粗 酶液、Th-30β-葡聚糖酶发酵液、3%氨基寡糖素、2%春雷霉素,每个处理3 次重复,出苗后每组保留30株生长健壮一致的幼苗,随机区组排列,常规管理,至2 片子叶展平期,将幼苗连根取出,清水冲洗根部后用106CFU·mL-1黄瓜枯萎病菌孢子悬浮液没过根部浸根5 s,重新定植于育苗钵内;间隔24 h 后,每育苗钵分别浇入200 mL 不同的处理液,15 d 后统计病情指数和防治效果。
1.4.2 盆栽病害调查 按照中华人民共和国农业行业标准(NY/T 1857.3—2010)《黄瓜主要病害抗病性鉴定技术规程第三部分:黄瓜抗枯萎病鉴定技术规程》,将黄瓜枯萎病病情级别划分为5 个级别:0 级,无症状;1 级,子叶黄化,但未萎蔫;2 级,子叶萎蔫;3 级,子叶和真叶萎蔫或植株矮化;4级,枯死。病情指数=Σ(病级数×该病级植株数)/(最大病级数×植株总株数)×100,防治效果/%=(对照组病情指数-处理组病情指数)/对照组病情指数×100。
1.4.3 幼苗鲜质量调查 试验结束后轻轻取出黄瓜幼苗冲洗干净,用滤纸将水分吸干后用电子天平称量各处理幼苗鲜质量,并计算增重率。增重率/%=(处理组幼苗鲜质量-对照组幼苗鲜质量)/对照组幼苗鲜质量×100。
1.5 突变木霉菌株UN-2对黄瓜枯萎病的大田防治效果
1.5.1 大田试验设计及处理 试验分别于2022 和2023 年3-6 月在四川省农业科学院现代农业科技创新示范园进行,选择黄瓜枯萎病发病较重的连作黄瓜地进行大田防治效果试验。黄瓜幼苗第1 片真叶出现时移栽,种植密度为3000 株·667 m-2。试验共设4 个处理,每个处理3 次重复,共12 个小区,随机区组排列,每个小区移栽100 株黄瓜苗。移栽5 d 后,采用灌根法施用1.3.4 制备的木霉UN-2β-葡聚糖酶诱导发酵液、木霉UN-2β-葡聚糖酶粗酶液,每株施用200 mL,每隔7 d 施用1 次,连续3 次,以施用3%氨基寡糖素800 倍液和清水为对照。
1.5.2 大田病害调查 第3 次施药后10 d(幼苗期)、25 d(速长期)、40 d(开花期)、55 d(盛果期)分4 次调查各小区黄瓜枯萎病发病情况。参照张忠良等[23]的方法,将黄瓜枯萎病病情级别划分为5 个级别:0 级,植株正常生长,不发病;1 级,植株有少于1/4 的叶片萎蔫;2 级,植株有等于或多于1/4、少于1/2 的叶片萎蔫;3 级,植株有等于或多于1/2、少于3/4 的叶片萎蔫;4 级,植株完全萎蔫死亡。病情指数和防治效果计算方法同1.4.2。
1.6 数据统计与分析
数据使用Excel 2007 软件进行统计,DPS 9.50统计软件进行方差分析,采用Duncan 氏新复极差法分析差异显著性。
2 结果与分析
2.1 复合诱变方法对木霉菌株的致死效应
由图1~2 可知,两种诱变方式下木霉孢子致死率在处理前期均呈快速增长趋势,处理15 min 时致死率已超过75%,随着诱变时间的延长,诱变处理对木霉孢子的致死率曲线趋于平缓。其中,紫外诱变15 min 对木霉孢子致死率为78.6%,亚硝基胍诱变10 min 对木霉孢子致死率为76.3%。试验以木霉孢子致死率70%~80%的处理剂量为参考,即紫外线辐射诱变15 min 再用亚硝基胍处理10 min 作为复合诱变育种方式。

图1 紫外诱变致死率曲线Fig.1 Mutagenic lethality curve of ultraviolet
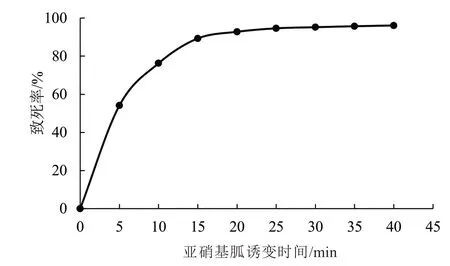
图2 亚硝基胍诱变致死率曲线Fig.2 Mutagenic lethality curve of NTG
2.2 高产葡聚糖酶木霉菌株的选育
通过复合诱变筛选出126 株在初筛培养基上生长旺盛且透明圈/菌落直径比较大的突变木霉菌株。将126 株突变菌株进行β-葡聚糖酶诱导发酵试验,DNS 法酶活测定结果表明,6 株突变木霉菌株产β-葡聚糖酶能力显著高于亲本木霉菌株Th-30,分别编号为UN-1、UN-2、UN-3、UN-4、UN-5和UN-6(表1),6 株突变菌株β-葡聚糖酶诱导发酵液酶活性为33.70~44.50 U,较亲本菌株提高57.70%~108.24%;其中突变菌株UN-2 和UN-5 发酵液酶活性提高率均超100%,产酶能力显著高于其他突变菌株。从不同菌株的生长特性来看,除了突变菌株UN-3、UN-5 的菌丝生长速率显著低于亲本菌株外,其他突变菌株生长速率与亲本菌株没有显著差异;除了UN-4 的产孢量显著低于亲本菌株外,其他突变菌株的产孢量与亲本菌株没有显著差异。

表1 不同菌株的β-葡聚糖酶活性及生长特性Table 1 Activity of β-Glucanase and growth characteristics of different strains
2.3 突变菌株产酶能力的遗传稳定性
突变木霉菌株产β-葡聚糖酶的遗传稳定性试验结果表明(图3),6 株突变菌株产酶能力在代次转接前期均有不同程度下降,转接5 代后其产β-葡聚糖酶活性基本保持稳定,说明本试验通过复合诱变获得的目标菌株高产β-葡聚糖酶的能力具有较好的遗传稳定性。其中,菌株UN-2 高产β-葡聚糖酶遗传稳定性最好,转接8 代后产β-葡聚糖酶活性为44.1 U,与第1 代基本相当;其次是菌株UN-4,其转接8 代后产β-葡聚糖酶活性为39.8 U;菌株UN-5 第1 代产β-葡聚糖酶活性最高,但是转接4 代后产酶能力下降较快,转接8 代后β-葡聚糖酶活性为38.1 U,较第1 代下降14.38%。

图3 突变菌株产酶能力的遗传稳定性Fig.3 Genetic stability of enzyme production ability of mutant strains
2.4 木霉菌β-葡聚糖酶诱导发酵液对室内盆栽黄瓜枯萎病的防治效果
由表2 可知,黄瓜枯萎病盆栽防治效果5 组处理病情指数为23.33~40.83,均显著低于清水对照;UN-2β-葡聚糖酶诱导发酵液和UN-2β-葡聚糖酶粗酶液处理的病情指数均显著低于Th-30β-葡聚糖酶诱导发酵液和2%春雷霉素处理。从防治效果看,3%氨基寡糖素对黄瓜枯萎病防治效果最好,达68.31%;UN-2β-葡聚糖酶诱导发酵液和UN-2β-葡聚糖酶粗酶液对黄瓜枯萎病防治效果分别为65.29%、63.77%,均与3%氨基寡糖素和2%春雷霉素处理差异不显著。不同处理对黄瓜幼苗增重率差异明显,其中木霉UN-2β-葡聚糖酶诱导发酵液和3%氨基寡糖素对黄瓜幼苗促生增重效果较好,增重率均超过30%。木霉UN-2β-葡聚糖酶诱导发酵液不论是对黄瓜枯萎病的防治效果还是黄瓜幼苗的单株增重率均高于UN-2β-葡聚糖酶粗酶液。

表2 不同木霉菌株对室内盆栽黄瓜枯萎病的防治效果Table 2 Indoor potted control effects of different Trichoderma harzianum strain on cucumber wilt disease
2.5 突变菌株UN-2对黄瓜枯萎病的大田防治效果
由表3 可知,大田防治效果试验突变木霉菌株UN-2 对黄瓜枯萎病具有一定的防控作用。2022 年大田防治试验数据显示,在黄瓜幼苗期和速长期,UN-2β-葡聚糖酶诱导发酵液对黄瓜枯萎病的防治效果分别为62.72%、67.11%,UN-2β-葡聚糖酶粗酶液对黄瓜枯萎病的防治效果分别为61.01%、63.28%,同一生育期内2 个生防处理的防治效果均与3%氨基寡糖素差异不显著。黄瓜开花期,UN-2β-葡聚糖酶诱导发酵液对黄瓜枯萎病的防治效果为66.38%,与3%氨基寡糖素处理差异不显著,显著高于UN-2β-葡聚糖酶粗酶液处理。黄瓜盛果期,UN-2β-葡聚糖酶诱导发酵液、UN-2β-葡聚糖酶粗酶液和3%氨基寡糖素的防治效果分别为65.22%、50.72%和57.24%,不同处理之间差异显著。不同处理均在黄瓜速长期(第3 次施药后25 d)防治效果达到最高,随着黄瓜生育期的发展,UN-2β-葡聚糖酶粗酶液和3%氨基寡糖素对黄瓜枯萎病防治效果下降较快,UN-2β-葡聚糖酶诱导发酵液的防治效果下降较慢,其原因可能是发酵液中的木霉孢子在黄瓜根际土壤和植株体内定殖,代谢产物包括β-葡聚糖酶等系列生防因子可持续产生抗病作用。2023年大田试验结果与2022 年相似,由于降雨偏少,黄瓜枯萎病田间病情指数比2022 年小,不同处理的防治效果均比2022 年有所提高,其中UN-2β-葡聚糖酶诱导发酵液对不同生育期黄瓜枯萎病的防 治 效 果 分 别 为68.47% 、71.63% 、70.79% 和68.65%。

表3 突变菌株UN-2 对黄瓜枯萎病的田间防治效果Table 3 Field control effect of mutant strain UN-2 on cucumber wilt disease
3 讨论与结论
野生菌株改良手段主要有诱变育种、原生质体融合以及遗传改造等[18,24]。虽然建立在现代基因操作技术基础上的基因改造更为精确,但诱变育种往往能带来更为复杂的连锁反应结果并具有应用简便、费用低、效率高等优点,是当前菌种选育最常用的方法[25]。目前,报道较多的诱变育种手段有紫外辐射诱变、亚硝基胍处理、低温等离子体诱变或以上述两种方法复合诱变[26-27]。本试验采用紫外线照射与亚硝基胍处理相结合的方法,对哈茨木霉菌Th-30 进行复合诱变育种,得到6 个高产β-葡聚糖酶的突变菌株,其β-葡聚糖酶活性与亲本菌株相比提高57.70%~108.24%,且高产酶能力具有遗传稳定性,说明该方法在木霉菌株诱变育种中具有一定的适用性。
诱变育种的原理是通过物理或化学的诱导使微生物中某些基因进行重组或缺失来优化基因性状,而这个过程往往对微生物具有一定的致死效应。在诱变育种过程中,致死率过低,不能产生足够的变异个体,使下一步筛选工作难度增加,致死率过高则存活菌数量太低且变异菌株活力较弱,一般选取致死率为70%~80%的处理剂量作为选育高产菌株的参考剂量[28]。试验中紫外诱变15 min、亚硝基胍诱变10 min 对应木霉孢子致死率分别为78.6%和76.3%,两种方法复合诱变获得的β-葡聚糖酶高产突变菌株具有遗传稳定性,且对木霉菌株菌丝生长速率和产孢量没有显著影响。由于试验室条件的限制,笔者仅从酶活性水平上考查了突变菌株产酶能力的遗传稳定性,在短期内为研究工作的开展提供了有价值的参考,突变菌株在β-葡聚糖酶基因表达水平上的遗传稳定性还有待在今后的研究和应用中验证。
天然来源的β-葡聚糖酶资源丰富、性质稳定,具有特定的催化活性,在植物保护方面发挥着重要的作用[29]。葡聚糖酶能通过水解病原真菌细胞壁成分控制病害发展,其直接作用于植物细胞壁的产物低聚糖可诱导与抗病反应有关的酶类如苯丙氨酸解氨酶(PAL)、4-香豆酸-CoA 联结酶(4CL)的合成,从而增强植物的抗病性[2]。范青等[30]探讨了两种拮抗菌葡聚糖酶的产生及抑菌的机制,李纪顺等[31]通过染色体整合β-1,4-葡聚糖酶基因提高绿色木霉对小麦纹枯病的防治效果,程红梅等[32]通过转β-1,3-葡聚糖酶基因提高棉花对枯萎病和黄萎病的抗性。黄瓜枯萎病是由尖孢镰刀菌黄瓜专化型Fusarium oxysporumf.sp.cucumerinum侵染引起的一种维管束病害[33]。黄瓜枯萎病发病率一般为20%~30%,严重时为80%~90%,是制约黄瓜产量及品质的重要因素[34]。目前,防控黄瓜枯萎病的方法主要以化学防治为主,也有利用木霉菌等生物制剂防控黄瓜枯萎病的研究和报道。李进一等[35]通过温室盆栽试验发现短密木霉菌株对黄瓜枯萎病的防治效果达90.4%;谷祖敏等[36]研究表明,木霉菌可以明显促进黄瓜根系和植株的生长发育;王依纯等[37]报道了一株拟康氏木霉菌对黄瓜枯萎病的防治效果高达81.54%,且对黄瓜幼苗有明显的促生作用。木霉菌能产生多种降解植物病原菌细胞壁的酶类物质,其中β-葡聚糖酶是公认的影响生防菌株重寄生能力的重要因子。笔者的试验通过诱变育种获得的β-葡聚糖酶高产木霉菌株UN-2 发酵液处理黄瓜枯萎病的病情指数显著低于亲本菌株Th-30 处理,并对黄瓜幼苗具有明显的促生增重作用,证实木霉菌株产β-葡聚糖酶能力的增强和生防潜力之间具有正相关性。2023 年大田试验结果表明,突变木霉菌株UN-2β-葡聚糖酶诱导发酵液对不同生育期黄瓜枯萎病的防治效果分别为68.47%、71.63%、70.79%和68.65%。
综上所述,突变木霉菌株UN-2 产β-葡聚糖酶活性显著提高,其β-葡聚糖酶诱导发酵液对黄瓜枯萎病具有良好的防治效果,对黄瓜幼苗具有明显促生作用,是一种可以有效防治黄瓜枯萎病的生防资源。下一步需要优化突变菌株UN-2β-葡聚糖酶诱导发酵条件及生防制剂的生产工艺,深入探讨其高效利用技术,为黄瓜枯萎病的生物防治提供重要技术支撑。
