甲状腺继发性肿瘤细胞病理学特征
2023-11-26刘坦坦
杨 巧,付 欣,王 哲,刘坦坦,3
(1.西安大兴医院病理科,陕西西安 710016;2.空军军医大学第一附属医院(西京医院)病理科,陕西西安 710032;3.西北妇女儿童医院病理科,陕西西安 710061)
原发性甲状腺癌占甲状腺恶性肿瘤的绝大多数(约90%),而原发于其他部位转移至甲状腺的继发性肿瘤(secondary thyroid neoplasms, STN)少见,仅占0.16%~3.00%[1-4]。但STN 的来源种类众多,包括肺脏、胃肠道、乳腺、肾脏、前列腺、鼻咽部、涎腺、肝脏和膀胱以及白血病和肉瘤等[2,5-8]。STN 患者通常缺乏特异性的临床表现和影像学特征,尤其是当非甲状腺来源的原发性肿瘤历经多年之后又发生转移的情况下,STN 更易被临床和病理医师忽略或误诊为甲状腺原发性肿瘤。因此,细针穿刺活检对于区分STN与原发性甲状腺肿瘤至关重要,可以让部分STN患者避免不必要的手术。
超声引导下的细针抽吸术(fine-needle aspiration,FNA)是一种可靠的能够准确评估甲状腺原发性病变的微创活检方法,在临床甲状腺肿瘤术前诊断中具有重要价值。本研究应用FNA细胞学检查及免疫组化检测,分析STN 的细胞病理特点及免疫表型。笔者发现来源于肺和乳腺的病例形态与甲状腺髓样癌有重叠,但STN 的治疗方案与甲状腺原发性肿瘤显著不同,故对STN的正确诊断非常重要。本研究进一步探讨其与细胞学检查中较难鉴别的甲状腺髓样癌间的鉴别要点,以提高病理医师对STN的认识。
1 资料与方法
1.1 资料收集
2011 年1 月至2021年5月期间,空军军医大学第一附属医院(西京医院)病理科经FNA 细胞学检查诊断为甲状腺恶性肿瘤的病例5 023 例纳入研究,重新调取其中诊断为STN和甲状腺髓样癌患者的FNA 标本,进行重新染色和免疫组化检测。并由2 位高年资细胞病理专科医师重新阅片、评估,总结STN 和甲状腺髓样癌的细胞形态学特点及免疫表型。
1.2 方法
1.2.1 超声引导下经皮甲状腺FNA 术及常规细胞涂片制作
患者取平卧位,常规消毒铺巾后,在超声引导下选点穿刺定位,用2%利多卡因5 mL 局部麻醉,在超声引导下用22G PTC 针穿刺,进入甲状腺包块内,拔出针芯,反复穿刺5 次后退针,将穿刺物直接涂片,用95%乙醇固定后行苏木素-伊红(hematoxylin-eosin,HE)染色。选择另2 个穿刺点重复操作,取出组织液洗入液基固定液中,制成薄片并行巴氏染色。每例病例至少制作2 张HE 传统涂片和1 张液基制片。
1.2.2 细胞蜡块的制作
将常规细胞学检查剩余的标本移入2支50 mL离心管,然后以600 g 的速度离心10 min;弃去上清液,将2 管沉渣并入同一离心管中,倒入95%乙醇固定液,再以600 g 的速度离心30 min;用擦镜纸包裹沉渣后进行常规脱水、包埋、切片及HE 染色。沉渣较少的标本加入少量伊红以便识别。
1.2.3 细胞免疫组织化学
利用Ventana Bench Mark XT(Roche)全自动免疫组织化学仪进行检测,具体步骤按照试剂盒和抗体说明书进行,实验中设立PBS代替一抗作为空白对照。所用抗体包括CK8/18(克隆号5D3)、CgA(克隆号MX018)、ER(克隆号SP1)、PR(克隆号SP2)、GATA3(克隆号L50-823)、NapsinA(克隆号MX015)、P63(克隆号MX013)、SYN(克隆号MX038)、TTF-1(克隆号SPT24)、Ki-67(克隆号MIB-1)、CK7(克隆号OV-TL12/30)、CA125(克隆号TA347)、WT-1(克隆号MX012)、TG(克隆号2H11+6E1)、AE1/AE3(克隆号AE1/AE3)、CD56(克隆号MX039)及降钙素CT(克隆号SP17)。所有抗体均购自福州迈新公司,所用二抗及DAB 试剂盒均购自罗氏公司。
2 结果
2.1 一般情况
5 023例经FNA细胞学检查诊断为甲状腺恶性肿瘤的患者中,甲状腺髓样癌有33例,约占0.66%,STN 为8 例,包括肺癌2 例(1 例肺腺癌,1 例肺小细胞癌),乳腺癌2例,鳞状细胞癌4例(食管、下咽、气管及喉各1例)(见表1)。
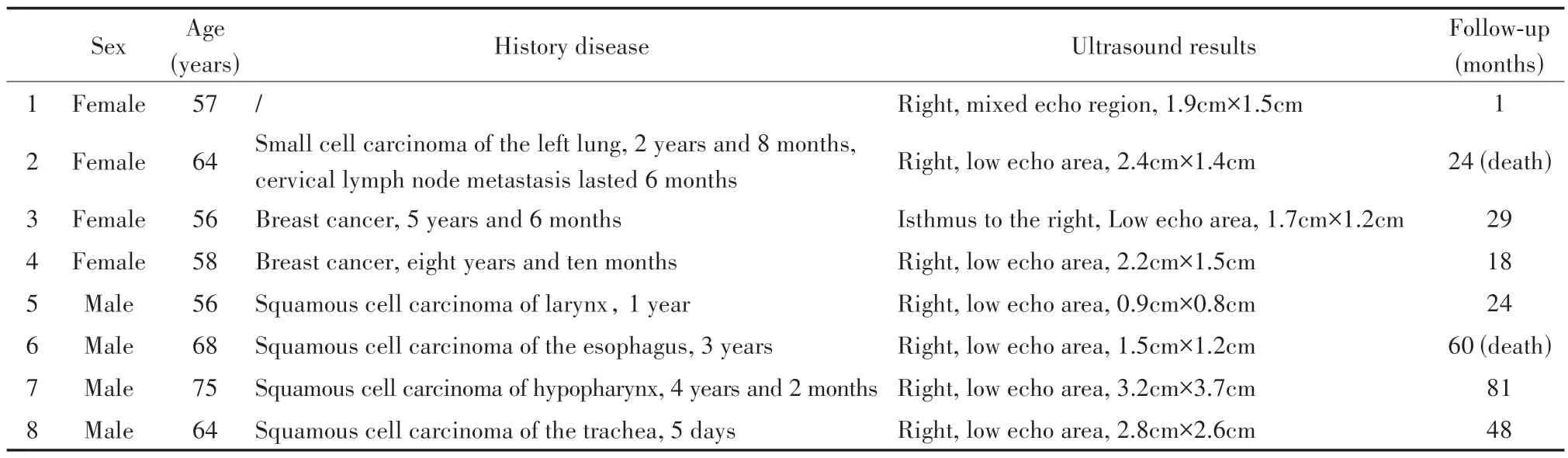
表1 甲状腺继发性肿瘤患者的临床资料Table 1 Clinical datas of patients with secondary thyroid tumors
2.2 细胞学检查结果及免疫表型
转移性肺腺癌及转移性鳞状细胞癌具有较明显的细胞形态学特征(见表2)。肺腺癌细胞呈三维立体腺样结构、乳头状结构,细胞体积较大;免疫组化检测显示,CK7、TTF-1、NapsinA 阳性,CA125、WT-1、PAX-8、甲状腺球蛋白(thyroglobulin,TG)阴性。鳞状细胞癌具有片状、巢团状或散在分布的异型鳞状细胞,且细胞大小常差距明显;免疫组化检测显示,P63、P40阳性,TG阴性(见表2)。

表2 STN与甲状腺髓样癌间的细胞形态学特征及免疫表型比较Table 2 Comparison of cell morphology and immunophenotype between STN and medullary thyroid carcinoma
转移性乳腺癌、转移性肺小细胞癌与甲状腺髓样癌的细胞学形态间有部分重叠,细胞均体积小、核深染。乳腺癌细胞多呈团状、簇状排列,无胡椒盐样染色质,免疫组化检测显示其特征性地表达GATA-3、ER 及PR 等免疫组化标志物,不表达降钙素(calcitonin,CT)和神经内分泌标志物(Syn、CgA、CD56等)。转移性肺小细胞癌的细胞大小一致,几乎没有细胞质,呈裸核样,核拥挤可形成特征性的“镶嵌样”结构;免疫组化检测不表达CT。甲状腺髓样癌与转移性乳腺癌、小细胞癌的单一性不同,甲状腺髓样癌细胞形态多样,呈浆细胞样、上皮样、梭形,可见少量奇异性巨细胞,且背景中可见淀粉样物,免疫组化检测显示其特异性地表达CT 及神经内分泌标志物(见表2)。

图1 病例1,甲状腺转移性肺腺癌(FNA)Figure 1 Case 1,metastatic lung adenocarcinoma of thyroid(FNA)
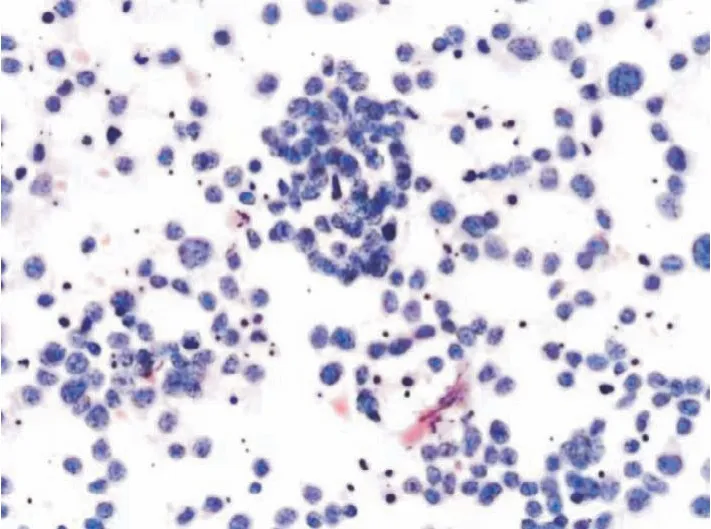
图2 病例2,甲状腺转移性肺小细胞癌(FNA)Figure 2 Case 2, thyroid metastatic small cell carcinoma of lung(FNA)

图3 病例8,甲状腺转移性鳞状细胞癌Figure 3 Case 8, Metastatic squamous cell carcinoma of thyroid

图4 病例4,甲状腺转移性乳腺癌Figure 4 Case 4,Metastatic breast cancer of thyroid
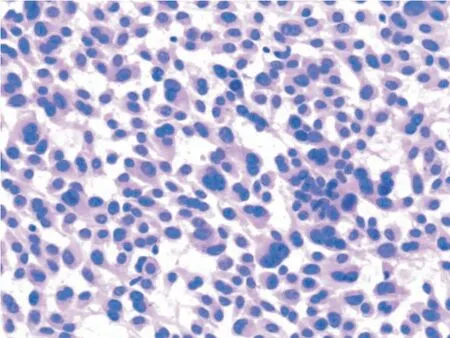
图5 髓样癌(HE,×400)Figure 5 Medullary carcinoma(HE,×400)
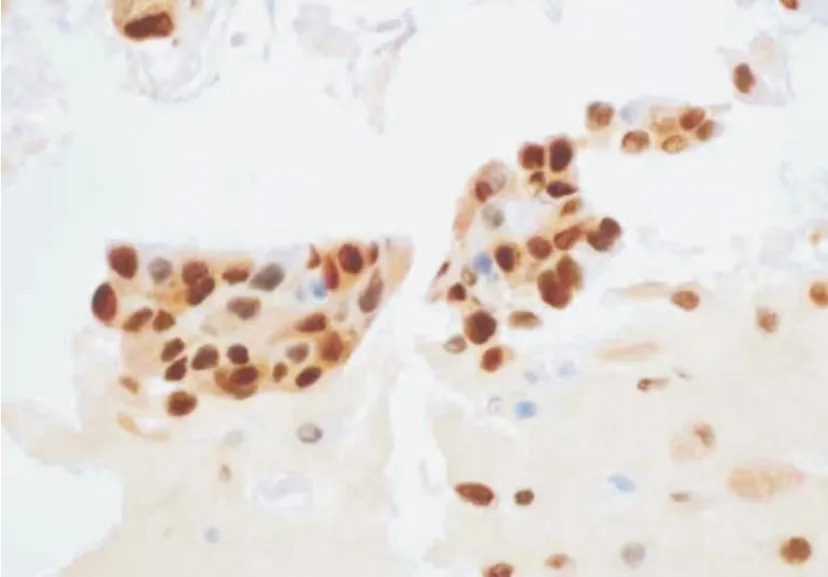
图6 乳腺癌细胞(病例4)(IHC,×400)Figure 6 Breast cancer cells(Case 4)(IHC,×400)
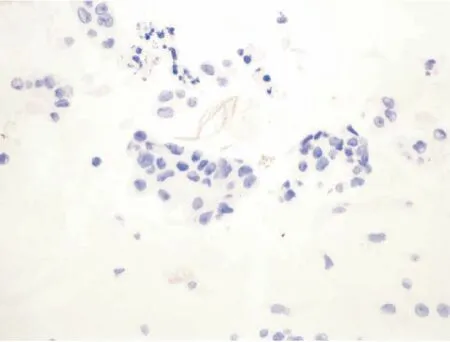
图7 乳腺癌细胞(病例4)(IHC,×400)Figure 7 breast cancer cells(Case 4)(IHC,×400)
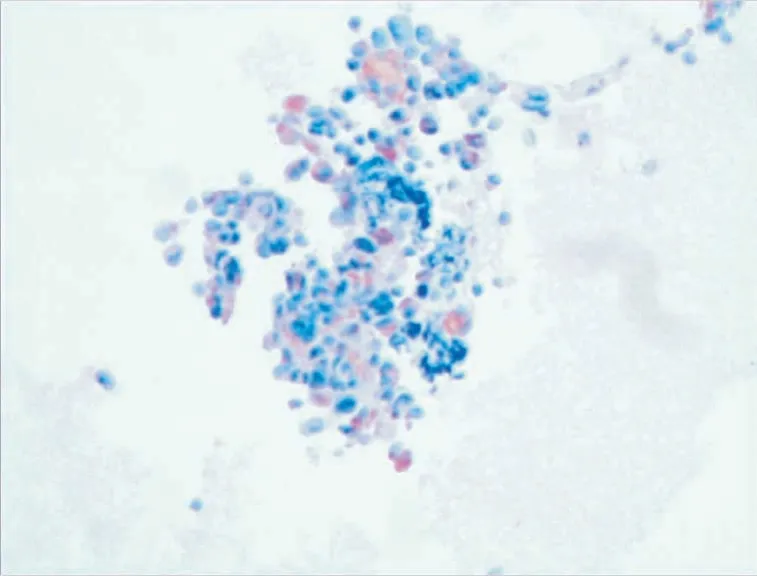
图8 髓样癌(IHC,×400)Figure 8 Medullary carcinoma(IHC,×400)
3 讨论
3.1 STN发生率
本研究观察了一组非甲状腺来源的恶性肿瘤转移到甲状腺的病例。目前国外文献报道的STN在甲状腺恶性肿瘤中的发生率为0.16%~3.00%[1-4],本研究中STN 占甲状腺恶性肿瘤的0.16%。但Papi等[9]在尸检研究中发现,其发病率可高达24%,提示STN 存在一定比例的漏诊或误诊。甲状腺继发性肿瘤与原发性恶性肿瘤患者在治疗和预后方面存在显著差异[10]。除甲状腺髓样癌和未分化癌以外,大多数常见的甲状腺原发性癌(如甲状腺乳头状癌和滤泡性癌)通常进展缓慢、预后良好,以手术切除为首选治疗方案。而STN患者多为晚期,常伴有其他多种器官的广泛转移,病情进展快,死亡率高,手术切除并非首选治疗方案[5,11]。因此,临床医师应提高对这类肿瘤的认识,将其与原发性甲状腺恶性肿瘤区分开。
3.2 FNA细胞学检查
FNA 是一种常用的对甲状腺原发性病变进行取样并展开细胞学检查的微创方法,其在甲状腺原发性病变中诊断的准确率和特异度分别为84%和98.2%[12],但通过这种取样方法诊断的STN 病例却比较少见。有研究显示,FNA诊断STN的准确率分别为85.7%和86.4%[5,7],表明基于FNA 的细胞学检查是诊断STN 的有效方法。国外研究显示,STN的来源非常广泛,其中最常见的原发部位是肾、乳腺和肺[2,5-7,11],其次为结直肠[13-14];少数情况下,也可来源于淋巴造血系统肿瘤、肉瘤和恶性黑色素瘤。本文研究中最常见的STN 原发部位为肺和气管(3/8例),其次为乳腺(2/8例),最常见的组织学类型是鳞状细胞癌(4/8例),其次是腺癌(3/8例)。
3.3 STN细胞学病理鉴别诊断
STN 与甲状腺原发性肿瘤的鉴别诊断中,由于甲状腺滤泡上皮来源的肿瘤(如甲状腺乳头状癌和滤泡性肿瘤、甲状腺低分化癌和未分化癌)一般会不同程度地表达TTF-1、PAX-8 以及TG,这些特点可有助于与STN 相鉴别。STN 中转移性肺腺癌及转移性鳞状细胞癌的细胞形态学特征明显,可见三维立体乳头状结构、腺样结构、成簇或散在分布的异型鳞状细胞,结合其各自的特征性免疫表型,明确诊断也不难。
而STN中的转移性乳腺癌、小细胞癌与甲状腺髓样癌在形态学上可有重叠,三者之间的鉴别较为困难。转移性乳腺癌的细胞大小不一,核深染,但无甲状腺髓样癌的胡椒盐样染色质;乳腺癌细胞多呈团状、簇状排列,特征性地表达GATA-3、ER 及PR 等免疫组化标志物,不表达CT 和神经内分泌标志物(如Syn、CgA、CD56 等)。转移性小细胞肺癌的细胞大小一致,几乎没有细胞质,呈裸核样,染色质呈胡椒盐样,常散在、单行列兵样或小簇状排列,核拥挤可形成特征性的“镶嵌样”结构;免疫组化检测不表达CT。甲状腺髓样癌为大量单个散在的细胞或合体样细胞簇交替分布,与转移性乳腺癌、小细胞癌的单一性不同,甲状腺髓样癌细胞形态多样,呈浆细胞样、上皮样、梭形,可见少量奇异性巨细胞,且背景中可见淀粉样物,免疫组化检测显示其特异性地表达CT及神经内分泌标志物。结合细胞学形态特征的微小差别、免疫表型及临床病史,可鉴别三者。
同时,详细询问患者既往的肿瘤病史仍是获取准确诊断STN的有效线索的方法之一,即使是在患者的肿瘤病史已较长的情况下,仍需要考虑到STN的可能。有文献总结了近十年来STN病例后发现,肾脏是甲状腺STN最常见的原发部位,发生率可高达48.1%[15-16]。与之不同的是,本研究中无一例STN 起源于肾脏。造成这种差异的可能原因是,肾脏起源的STN 细胞细胞大小一致,细胞质透亮,易被误认为是甲状旁腺来源的肿瘤而造成漏诊,但笔者团队在复核了甲状旁腺肿瘤的细胞学检查和免疫组化检测结果后未发现有相关病例被漏诊。另外,在临床医师未提供患者既往肾细胞癌病史,或患者病史过长而导致临床医师忽略甲状腺结节为肾脏起源的可能性时,容易发生漏诊。有研究显示,目前仍有高达76%的STN患者就诊时没有提供肿瘤病史[3]。本研究8 例STN 患者中仅2 例送检时提供了患者的既往肿瘤病史,其余6 例患者均未提供肿瘤病史。肿瘤病史的缺失,也会容易导致FNA诊断STN时导致误诊,值得警惕。
由于甲状腺STN病例数量较少,目前对其治疗方案尚未达成共识。一些国外文献的治疗和随访结果表明,接受甲状腺切除术的患者比非手术治疗的患者生存时间更长,提示甲状腺切除术能够改善患者的生存率[17-18]。因此,有些学者建议甲状腺STN 患者,尤其是孤立性甲状腺结节和转移性肾细胞癌的患者,需手术切除[6,9]。但对于发生广泛转移性的患者,则不推荐手术治疗,除非为减轻患者颈部肿瘤负担。本文中8 例病例无颈部压迫症状,均未行手术治疗。
总之,STN 相对少见,在患者肿瘤病史较长的情况下容易被忽视,而将STN误诊为甲状腺原发性肿瘤。本研究通过对8 例STN、33 例甲状腺髓样癌的FNA 样本进行详细的病理学和免疫组化检查,分析其间的细胞形态学特征和免疫表型差异,证实了FNA 细胞病理学检查是鉴别STN 与包括甲状腺髓样癌在内的甲状腺肿瘤的,一种灵敏度、特异度均较高的有效方法。结合本研究结果,笔者建议,对于既往有恶性肿瘤病史的甲状腺肿块患者,都应行FNA 检查,并将样本制作包埋细胞块,行细胞形态学观察和免疫组化检查,以排除STN 或确诊STN,协助制定患者的治疗方案及评估其预后,也可避免部分不需要手术的STN 患者接受不必要的手术治疗。
利益冲突说明/Conflict of Interests
所有作者声明不存在利益冲突。
伦理批准及知情同意/Ethics Approval and Patient Consent
本文不涉及伦理批准及知情同意。
作者贡献/Authors’Contributions
杨巧负责采集数据、草拟和修改文章,付欣负责采集数据,王哲负责策划和设计实验,刘坦坦负责对文章知识性内容做批判性审阅,并确认终稿。
