紫苏粕蛋白抗氧化活性肽的制备、分离纯化及序列鉴定
2023-11-26张恒慧张志军陈士国叶兴乾张国华
张恒慧,张志军,陈士国,叶兴乾,张国华
(1 太原工业学院生物与食品教研室 太原030008 2 中北大学化学工程与技术学院 太原030051 3 浙江大学生物系统工程与食品科学学院 杭州310058 4 山西大学生命科学学院 太原 030006)
紫苏(Perilla frutescens L.)别名荏子、赤苏、红苏,为唇形科苏属一年生草本植物,是我国南北方普遍种植的传统经济植物,也是卫健委首批许可的60 种药食同源植物之一[1]。紫苏在我国有2 000 多年的栽培历史,在日本、朝鲜、韩国、印度、缅甸及俄罗斯等其他国家也有广泛分布[2]。紫苏全身是“宝”,其叶(苏叶)、梗(苏梗)和果(苏子)均可入药,也可用于香料、油用及食用,已成为一种备受世界关注的多用途植物[3-7]。
由于紫苏籽中富含不饱和脂肪酸的油脂含量较高,因此过去针对紫苏籽的研究主要在于紫苏籽油用作高端食用油的开发和利用[8]。然而,脱油后所剩的紫苏粕不易被消化和直接利用,常被丢弃或者用作廉价饲料,难以高效利用且大量丢弃造成环境污染。研究表明,紫苏籽粕中不仅蛋白质含量高(最高约为65%),而且所含蛋白质氨基酸组成丰富,包括8 种人体必需氨基酸,各必需氨基酸含量与鸡蛋蛋白相当[9]。紫苏粕蛋白的低溶解性和大分子质量限制了其应用。通过酶解制备生物活性肽,是提升紫苏粕蛋白价值的手段。
通过控制酶解技术对副产物蛋白进行深度开发,制备具有抗氧化、抗菌、降血脂、醒酒等功能的生物活性肽的研究已取得一定进展[10-11]。例如,赵谋明等[12]以副产物玉米黄粉为原料制备具有高效醒酒活性潜力的玉米肽,能够高效激活乙醇脱氢酶。Chen等[13]通过酶解大米渣蛋白制备高抗氧化活性的大米肽,具有较强的自由基清除活性。还有许多学者通过水解如大豆粕、山核桃粕等植物蛋白[14-15]以及秋刀鱼、金枪鱼副产物等动物蛋白[16-17]制备高抗氧化活性的肽段,并对抗氧化肽的富集和氨基酸序列鉴定等研究方法及思路的创新做出了贡献。
氧化应激是自由基在体内引起的一种负面作用,被认为是衰老和疾病的重要原因。当机体的抗氧化防御系统清除自由基的速度赶不上自由基产生的速度,自由基大量累积,从而造成氧化损伤,使生物大分子出现交联或者断裂,细胞结构和功能被破坏。为了恢复抗氧化与氧化作用体系的平衡,机体根据需要及时补充抗氧化膳食添加剂。本文在前期研究的基础上,筛选碱性蛋白酶、木瓜蛋白酶、中性蛋白酶和风味蛋白酶来水解紫苏粕粉,制备高抗氧化活性的紫苏肽,并对其抗氧化活性组分进行分离、富集及氨基酸序列鉴定,为拓展紫苏粕的附加值和研发抗氧化的功能紫苏肽产品提供理论参考。
1 材料与方法
1.1 材料与试剂
紫苏籽采自中北大学试验田。碱性蛋白酶Alcalase(2.4AU/g),诺维信(中国)生物技术有限公司;木瓜蛋白酶(80 万U/g)、中性蛋白酶(6 万U/g)、风味蛋白酶Flavourzyme(1.5 万U/g),北京索莱宝科技有限公司;1,1-二苯基-2-三硝基苯肼(DPPH)AR,国药集团化学试剂有限公司;Sephadex G-25 填料(P 17-0033-01),美国GE 公司;BCA 蛋白浓度测定试剂盒,上海碧云天生物技术有限公司;其它试剂均为分析纯级。
1.2 仪器与设备
酶标分析仪,北京普朗新技术有限公司;Isolera One 快速制备液相系统,瑞典Biotage 公司;纳升级UHPLC 液相系统,美国Thermo Fisher 公司;质谱仪,美国Thermo Fisher 公司;紫外-可见分光光度计,上海元析仪器有限公司;TGL-12B 型低温高速离心机,上海安亭科学仪器厂。
1.3 方法
1.3.1 紫苏活性肽的制备 参考Mudgil等[18]的方法并稍加调整。以紫苏粕为原料,分别选用碱性蛋白酶、木瓜蛋白酶、中性蛋白酶和风味蛋白酶进行酶解反应制备紫苏活性肽。将紫苏籽榨油脱脂,粉碎过筛,得到脱脂紫苏粕粉。将脱脂紫苏粕粉以1∶22(g/mL)的料液比加入去离子水,以7%的加酶量加入所需蛋白酶,低速搅拌均匀后调节pH 值至蛋白酶最适pH 值,置水浴锅中60 ℃恒温加热反应。酶解4 h 后,将反应溶液于沸水中加热10 min,使蛋白酶钝化失活,反应终止。
1.3.2 样品中蛋白质总含量的测定 参照Olsen等[19]的方法,采用凯氏定氮法测定紫苏粕粉中蛋白质含量。
1.3.3 水解度(DH)的测定 参照Rios-Herrera等[20]的方法,采用改进的pH-stat 法测定酶解液的水解度(degree of hydrolysis,DH)。当pH>6 时,酶解液释放H+的量大于结合H+的量,通过加碱保持pH 值与初始条件一致,碱液的消耗量水解的肽键数目成正比,即可计算水解度。向反应后的紫苏蛋白酶解液中加入40%甲醛溶液,固定游离氨基,精确、迅速滴加0.1 mol/L NaOH 使pH 值恢复初始值(±0.1 pH),记录标准浓度NaOH 的用量,并将冷却后的反应液在3 000 r/min 离心15 min,收集上清液4 ℃保存或-20 ℃冻存待用,上清液即粗制的紫苏活性肽。紫苏蛋白水解度计算公式:
式中:h——单位质量蛋白质被水解肽键的量,标准单位mmol/g;htot——单位质量蛋白质中肽键总数,mmol/g,对于紫苏蛋白htot为8.0 mmol/g;V——滴定消耗碱的体积(mL);N——滴定消耗标准碱液的浓度(mol/L);α——为α-氨基的解离度,取0.986;Mp——称取样品所含蛋白总量,g。
1.3.4 可溶性蛋白浓度的测定 参照Betti等[21]的方法,采用BCA 法测定粗制紫苏活性肽上清液的可溶性蛋白质(肽)含量。
1.3.5 抗氧化活性的测定 参照Abeynayake等[22]的方法测定DPPH·清除率。取100 μL 稀释至已知浓度的紫苏蛋白酶解上清液,加入900 μL 160 μmol/L DPPH 工作液,以去离子水代替样品作对照组,以无水甲醇代替DPPH 溶液作空白组,室温混匀避光放置30 min,以无水甲醇作参比,在518 nm 处测吸光值,重复3 次取平均值,计算DPPH清除率。
式中:AS——试验组样品与DPPH 工作液反应后的吸光值;Ar——空白组样品加入无水甲醇后的吸光值;A0——对照组去离子水加入DPPH工作液后的吸光值。
1.3.6 膜超滤法分离紫苏活性肽 采用截留分子质量分别为10 ku 和3 ku 的超滤离心管对紫苏蛋白酶解上清液进行分级分离。酶解上清液首先通过截留分子质量为10 ku 的超滤膜,其滤液再通过3 ku 的超滤膜,控制离心条件4 ℃、5 000 r/min离心处理10 min。经超滤离心后得到组分F1(<3 ku)、F2(3~10 ku)、F3(>10 ku),测定各组分的蛋白质浓度以及抗氧化活性等[23]。收集超滤分离后的各组分冻干,备用。
1.3.7 Sephadex G-25 凝胶过滤层析分离 将超滤离心分离所得抗氧化性最强的组分用凝胶层析柱纯化。凝胶层析柱选用葡聚糖凝胶Sephadex G-25 为填料,柱2.6 cm×70 cm,将层析柱安装在Biotage 快速制备液相系统Isolera One 上,用0.025 mol/L Tris-HCl 磷酸盐缓冲液(pH 7.2)平衡层析柱,流速1.0 mL/min。上样前对样品进行全波长扫描,检出多肽组分的最大吸收波长202 nm。结合文献[24]方法采用202 nm/214 nm 进行双波长检测。上样后用超纯水洗脱,洗脱流速3 mL/min,在线检测洗脱液在双波长下的吸光值。设定系统自动收集的最低吸收值,系统自动收集不同峰的分离组分,测定各组分抗氧化活性及蛋白质浓度。
1.3.8 快速制备液相C-18 反相色谱分离 将凝胶过滤层析分离所得抗氧化性最强的组分用Biotage SNAP Ultra C-18(30 g)色谱柱进行反相色谱分离。洗脱液A:0.065%TFA 超纯水溶液;洗脱液B:乙腈;检测:UV202nm/214nm。上样前,柱子先分别用100%乙腈和超纯水冲洗。进样后洗脱液B 的梯度洗脱步骤如下:0~10%(体积分数),3 min;10%~100%(体积分数),30 min;100%(体积分数),6 min;流速15 mL/min。系统自动收集各吸收峰的洗脱液,将同一分离组分收集的各管混合,测定各组分抗氧化活性及蛋白质浓度[25]。
1.3.9 RP-HPLC 在线连接的 ESI-MS/MS 鉴定紫苏肽的氨基酸序列组成
1)色谱条件 色谱柱:分析柱C18 column(C18 1.9 μm 0.15 mm×120 mm),Thermo Fisher;检测波长:214 nm;柱温:30 ℃;流速:600 nL/min;进样量:2 μL;流动相A:体积分数0.1%甲酸超纯水溶液;流动相B:体积分数0.1%甲酸乙腈溶液。梯度洗脱条件:0~8 min,0%~12% B(线性梯度);8~48 min,12%~23% B(线性梯度);48~68 min,23%~36% B(线性梯度);68~69 min,36%~95% B(线性梯度);69~78 min,95% B(等量洗脱)[13]。
2)质谱条件 经RP-HPLC 分析的样品流以600 nL/min 的速度穿过电喷雾界面进入质谱仪。采用正离子扫描模式,雾化气和干燥气为高纯氮气,扫描范围为m/z 0~1 500。MS/MS 肽序列分析借 助 Sequest 和 Proteome Discoverer(Thermo Scientific)软件搜库鉴定。
1.4 数据处理与分析
2 结果与分析
2.1 不同蛋白酶对紫苏蛋白水解度及酶解产物抗氧化活性的影响
蛋白酶的选择直接影响酶解反应结果和产物特性,包括蛋白质经酶切后肽段分子质量大小、蛋白质水解程度以及产生肽段的生物活性等。4 种蛋白酶对紫苏蛋白水解程度和酶解产物抗氧化活性结果见图1 和图2。由图1 可知,相对于其它3种酶,碱性蛋白酶Alcalase 对紫苏粕蛋白的水解程度最高,约25.94%。有研究表明蛋白质水解度是酶解产物高活性的重要指标,只有蛋白质水解度高才可能释放出更多具有活性的基团[15]。García等[26]对比碱性蛋白酶和风味蛋白酶对乳清蛋白的水解效果,其中碱性蛋白酶水解效果要优于风味蛋白酶,水解度最高达24.5%。本研究结果同样是碱性蛋白酶对紫苏蛋白的作用效果明显高于其它3 种酶。
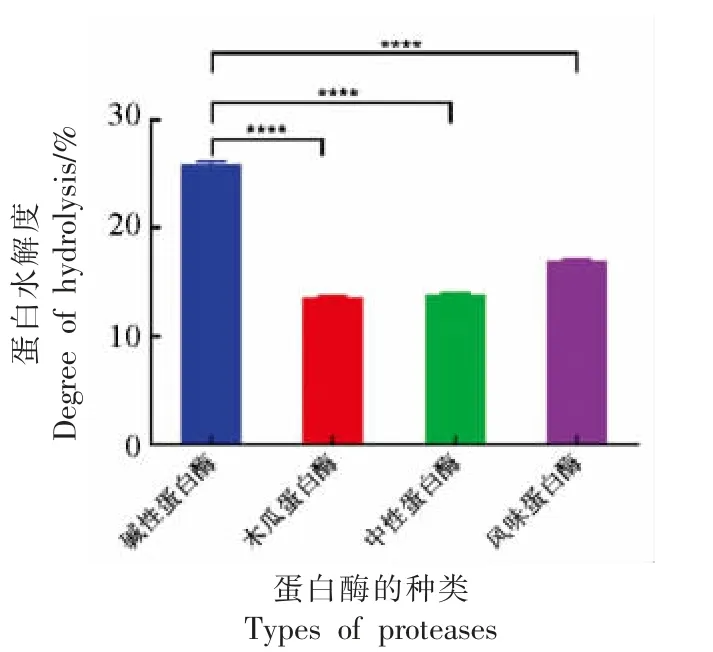
图1 4 种蛋白酶反应后蛋白质水解度的比较Fig.1 Comparison of degree of hydrolysis(DH)after reaction of 4 proteases
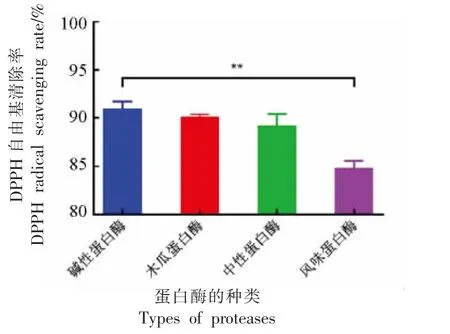
图2 4 种蛋白酶水解产物DPPH 自由基清除能力的比较Fig.2 Comparison of DPPH scavenging capacity of four protease hydrolysates
由图2 可知,碱性蛋白酶作用紫苏蛋白后的酶解产物的DPPH·清除率最高,且风味蛋白酶酶解产物的DPPH·清除率明显低于其它3 种酶,与碱性蛋白酶组存在显著差异(P<0.01)。在García等[26]的研究中,碱性蛋白酶和风味蛋白酶在不同水解条件下水解乳清蛋白获得的499 种肽段具有潜在的抗氧化活性。综合考虑水解度和抗氧化活性,决定选取碱性蛋白酶Alcalase 作为水解紫苏蛋白制备抗氧化活性肽的主要用酶。
2.2 不同超滤离心分离组分的抗氧化活性
采用超滤膜过滤法来分离纯化生物活性肽,如Roslan等[27]用多层超滤膜分离罗非鱼副产物酶解液,制备小分子肽,通过超滤分离手段实现了小分子肽的分离和富集。本研究中紫苏蛋白酶解上清液经超滤离心获得F1、F2、F33 个组分,稀释至相同浓度后测得抗氧化活性见图3。F1(MW<3 ku)清除DPPH·的能力高于其它组分,差异极显著。质量浓度50 μg/mL 的F1组分的DPPH·清除率为(50.50±0.16)%。收集组分F1,进行后续分离纯化。Sabeena等[23]通过酶解大西洋鳕鱼蛋白,分离纯化获得抗氧化肽,对比超滤分离的3 个组分(>5 ku,3~5 ku 和<3 ku)的抗氧化性,<3 ku 的组分具有更高的抗氧化活性。本研究结果与其研究结果相似,蛋白酶解液经截留分子质量较小的滤膜分离得到的组分(一般MW<3 ku)抗氧化活性较高,这是因为分子质量较小的肽链中具有抗氧化活性的氨基酸残基能够更多的暴露并且充分发挥抗氧化作用。

图3 超滤离心分离后各组分的DPPH·清除率Fig.3 DPPH radical scavenging rate of fractions separated by ultrafiltration centrifugation
2.3 Sephadex G-25 凝胶过滤色谱分离各组分的抗氧化活性
如图4 所示,在凝胶过滤色谱分离前先对F1组分的紫外-可见吸收光谱进行全波长扫描,获得光吸收值最大的波峰为202 nm。Hsu[28]在利用凝胶过滤色谱法分离金枪鱼副产物酶解液中抗氧化活性肽时,检测器选择的光吸收波长为214 nm 左右。You等[29]用凝胶过滤色谱分离泥鳅蛋白抗氧化活性肽,也选择214 nm 为检测波长。后续在快速制备液相系统自动收集分离组分的过程中选择双波长检测,将检测波长分别设置为202 nm(红色峰线)和214 nm(黑色峰线)(见图5)。

图4 F1 组分中多肽的紫外-可见全波长吸收扫描Fig.4 UV-visible full wavelength scanning of peptides in fraction F1

图5 凝胶过滤色谱法分离纯化组分F1Fig.5 Separation of fraction F1 by gel filtration chromatography
由图5 可知,根据色谱洗脱结果组分F1经凝胶过滤色谱分离后收集到3 个峰,分别命名为组分P1、P2和P3。收集3 个组分并确定各自浓度后稀释至相同质量浓度(3 μg/mL),测定它们的清除DPPH·的能力。如图6 所示,组分P3的DPPH·自由基清除率最高,为(54.09±1.18)%,抗氧化活性最强,被选作分离纯化的目标组分。经蛋白酶水解的片段分子质量大小各异,其抗氧化活性也与分子质量大小密切相关,因此分子质量大小分离酶解产物中不同活性组分的重要因素。凝胶过滤色谱可使小分子活性肽进入凝胶颗粒内部,最后被洗脱下来实现分离。用凝胶过滤色谱分离纯化活性肽已有很多报道,如Chen等[24]用Sephadex G-150 凝胶过滤色谱分离纯化南瓜籽蛋白抗氧化肽,能截留分子质量小于3 ku 的酶解上清液,分离成6 个组分,分离效果良好。本试验分离筛选目标肽的相对分子质量在1 000~3 000。选用Sephadex G-25 葡聚糖凝胶分离纯化经超滤离心分离的抗氧化活性最高的F1组分。

图6 凝胶过滤色谱法分离F1 后各组分的DPPH·清除率Fig.6 DPPH radical scavenging rate of fractions separated by gel filtration chromatography
2.4 制备液相C-18 反相色谱分离各组分的抗氧化活性
反相液相色谱法因色谱柱分离效率高、重现性好、生物活性分子相容性好以及灵敏、快速等优点,几乎对各种类型的有机化合物都呈现良好的选择性,被广泛应用于小分子肽类的分离。经凝胶过滤色谱分离所得组分P3抗氧化性明显高于其它组分,作为目标组分进一步通过反相制备液相系统分离,得到4 个组分,分别命名为P3-1、P3-2、P3-3和P3-4(见图7)。收集各组分浓缩至3 μg/mL,测定其清除DPPH·的能力,结果如图8 所示。组分P3-4的DPPH·自由基清除率最高,为(58.8±0.39)%,抗氧化活性明显高于其它组分,分析高抗氧化活性的肽段存在其中。
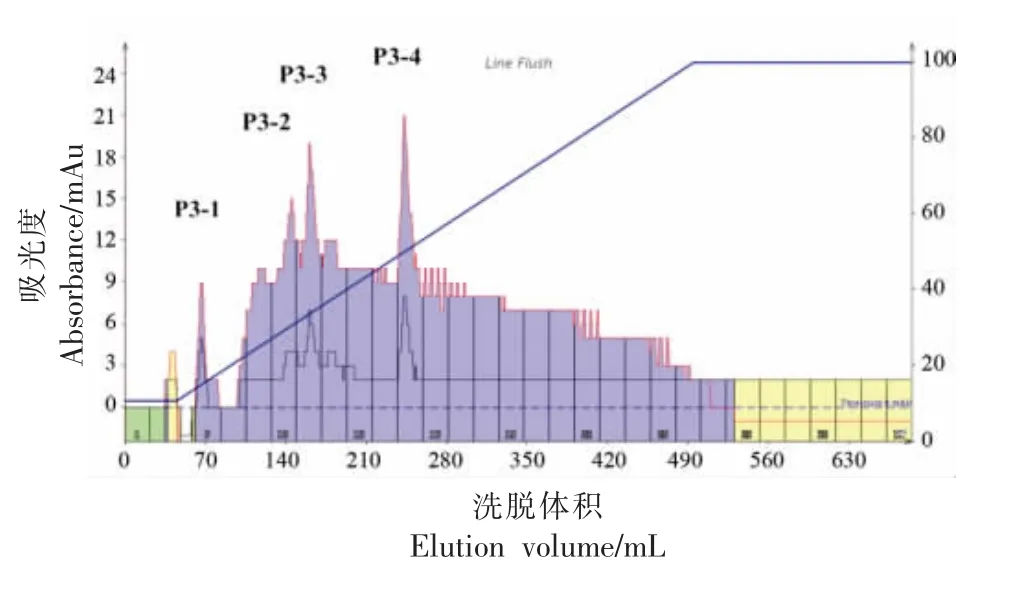
图7 反相液相色谱法分离纯化组分P3Fig.7 Separation of fraction P3 by reversed-phase liquid chromatography
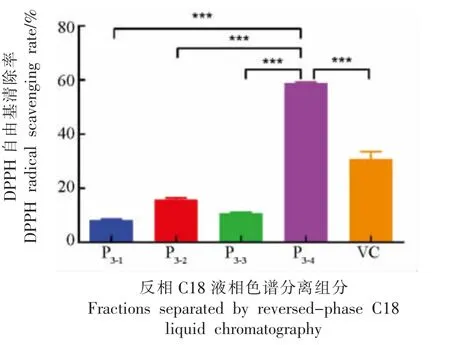
图8 反相C18 液相色谱分离P3 后各组分的DPPH·清除率Fig.8 DPPH radical scavenging rate of fractions separated by reversed-phase C18 liquid chromatography
在洗脱过程中,流动相极性减少、非极性增加时,不同水解片段分子与固定相之间的疏水作用下降,发生解缔,溶质分子被洗脱下来,因溶液中分子极性不同,洗脱时间也不同,从而实现分离。反相色谱技术可以更好地将分子质量相差不大的蛋白水解液小分子肽段细分,得益于具有抗氧化潜力的生物活性肽的高效富集,使得经过反相色谱分离后的一些组分的抗氧化活性得到了提高。类似的现象在多种蛋白质水解物中被观察到,其中包括油菜籽蛋白和珍珠粟蛋白等水解物中的抗氧化肽[25,30]。
2.5 高抗氧化活性肽的氨基酸组成及序列分析鉴定
采用RP-HPLC 串联ESI+源电喷雾质谱仪对分离纯化组分F1-P3-P3-4测序。图9 为紫苏蛋白酶解物分离纯化组分F1-P3-P3-4的RP-HPLC 图谱,可见有2 个主成分、4 个次成分及多个微量成分。经HPLC 洗脱的组分会自动进入质谱仪进行一级质谱(MS)和二级质谱(MS/MS)处理,采用分析软件对洗脱的各组分进行结构预测。对主成分(峰74.63 min)进行一级质谱(MS)后,直接进行二级质谱(MS/MS)分析,其MS/MS 分析结果如图10 所示。经测定,组分F1-P3-P3-4中丰度最高的活性肽段为十二肽,氨基酸序列为Lys-Leu-Lys-Asp-Ser-Phe-Glu-Arg-Gln-Gly-Met-Val,分子质量为1 437.75u。经肽谱库和美国化学文摘检索,该活性肽之前未有公开报道,是一种新发现的抗氧化性显著的十二肽。

图9 组分F1-P3-P3-4 的RP-HPLC 洗脱图谱Fig.9 RP-HPLC elution spectra of fraction F1-P3-P3-4

图10 74.63 min 出峰MS 质谱图Fig.10 Mass spectrogram of fraction 74.63 min
本研究分离肽段中含有疏水性氨基酸Leu、Gly、Met、Phe 及Val(约占总残基量的1/2),且末端3 个疏水氨基酸残基Gly-Met-Val 相连,对肽段抗氧化性有一定贡献。Ren等[31]和Rajapakse等[32]指出肽段的抗氧化活性与其组成的疏水氨基酸关系密切,尤其是末端氨基酸为缬氨酸或亮氨酸等疏水氨基酸时,肽段抗氧化活性普遍较高。分析原因是这些氨基酸残基中的非极性脂肪族基团能够很好地结合不饱和脂肪酸,增强捕获自由基的能力。此外,Glu 能给自由基提供质子,具有较高的自由基捕获能力,这些肽段特征都与紫苏活性肽的抗氧化活性相关。
3 结论
以紫苏粕粉为原料,省略蛋白质的提取分离过程,选用碱性蛋白酶为水解酶制备酶解产物。紫苏蛋白酶解上清液依次通过超滤、凝胶过滤层析和反相色谱等一系列分离纯化手段,分别利用分子质量不同及亲水、疏水等特性,将其中高抗氧化活性的肽组分进行分离、纯化和富集。以RPHPLC 在线连接的电喷雾离子质谱(ESI-MS-MS)结合蛋白质及多肽数据库分析,对抗氧化活性最高组分的氨基酸序列进行鉴定,得到序列为Lys-Leu-Lys-Asp-Ser-Phe-Glu-Arg-Gln-Gly-Met-Val 的紫苏抗氧化活性肽,分子质量为1 437.8 u。而紫苏肽在细胞水平和动物水平的抗氧化活性还需进一步研究。
