不同产地“宁杞1 号”枸杞果实的多糖合成代谢差异
2023-11-26马瑞雪寇婷婷孙霞芝范艳丽
马瑞雪,寇婷婷,孙霞芝,范艳丽
(宁夏大学食品科学与工程学院 银川 750021)
枸杞(Lycium barbarum L.)属茄科,多年生落叶灌木,是我国珍贵的传统药用植物[1],也是药食同源品种之一[2],具有抗炎、抗老和神经保护等多种生物学功能[3-5]。其种植区域从传统的宁夏中宁产区,逐渐扩展为“宁夏道地产区为核心,青海、甘肃、新疆、内蒙为两翼”的大枸杞种植区[6]。枸杞多糖(Lycium Barbarum polysaccharides,LBP)是 枸杞的主要活性成分,是一种有效的抗氧化剂[7]。由于环境因素不同,导致不同产地枸杞的品质存在很大差异[8],而枸杞多糖结构和活性是否存在典型的地区差异,对其质量评价和产品研发有至关重要的作用[9]。
基于同位素标记相对和绝对定量(Isobaric Tags for Relative and Absolute Quantitation,i-TRAQ)技术的蛋白组学分析,广泛应用于植物蛋白的识别和定性、定量分析中,该技术可同时比较8 个样品的表达量[10]。目前关于不同产区枸杞多糖的研究已有报道。Wang等[9]的研究发现,青海产地的枸杞果实明显大于宁夏和新疆,而其产量低于其它产地,研究还发现不同产地枸杞多糖的单糖组成、分子质量和构象相似,抗氧化和免疫活性结果也一致。徐金楠等[11]通过对不同产地枸杞多糖结构特征对比,发现不同产地的枸杞多糖结构相似,且环境因素对多糖糖环形式和单糖组成的影响比品种因素大。在蛋白水平探究不同产地枸杞多糖差异的相关报道较少,课题组前期比较了不同产地枸杞多糖的含量、分子质量、单糖组成以及结构特征,通过iTRAQ 技术比较枸杞蛋白表达差异[12],而未分析枸杞多糖的相关蛋白。本文基于前期iTRAQ 定量蛋白组学技术,对不同产地“宁杞1号”枸杞果实的蛋白质进行分析,筛选出与枸杞多糖合成代谢相关的蛋白质,并初步推测枸杞多糖合成代谢相关通路,为不同产地枸杞多糖的差异提供理论依据。
1 材料与方法
1.1 材料与试剂
SDS(色谱纯)、Urea(色谱纯)、二硫苏糖醇(色谱纯)、碘乙酰胺(色谱纯),美国Bio-Rad 公司;碳酸氢铵(色谱纯)、Tris(色谱纯)、三氟乙酸(色谱纯),美国Sigma-Aldrich 公司;甲酸(色谱纯),德国Fluka 公司;乙腈(色谱纯),德国Merck 公司;其它试剂均为国产分析纯。
1.2 设备与仪器
液相色谱系统(Easy nLC)、质谱仪(Q Exactive)、微量紫外光度计(2000c)、酶标仪(Multiskcan FC),美国Thermo Scientific;低温高速离心机(5430R)、真空离心浓缩仪(Concentrator Plus),德国Eppendorf 公司;超声破碎仪(JY92-II),宁波新芝生物科技股份有限公司。
1.3 方法
1.3.1 采样 枸杞样品为分别采摘自宁夏中宁、新疆精河、内蒙古乌拉特前旗、甘肃瓜州和青海德令哈的“宁杞1 号”枸杞。于7 月枸杞夏果期,选择6 年生树势健壮、栽培管理一致的“宁杞1 号”代表性植株5 株,从开花坐果起第32 天进行取样。共设3 个重复,兼顾东、西、南、北4 个方向及上、下、内、外各个方位的果实,并将其充分混匀。取样后立即用液氮冷冻24 h,并用-80 ℃冰箱贮藏,待所有产地全部采样完成后,用干冰冷冻快递至上海美吉生物科技有限公司进行测样。
1.3.2 蛋白质提取与定量 将5%TCA/丙酮(1∶9)加入枸杞细粉中,并用涡旋混匀。混合物在-20 ℃下沉淀4 h 后离心(6 000×g、40 min),并将沉淀风干。将30%的SDT 缓冲液加入20 μg 粉末中,混合煮沸5 min,并在80 W 的条件下匀浆超声10 次,每次10 s,间歇15 s。煮沸15 min 并离心(14 000×g、40 min),用0.22 μm 过滤器过滤上清液。用BCA 蛋白检测试剂盒测定蛋白质含量,并于-80 ℃保存。采用SDS-聚丙烯酰胺凝胶电泳对枸杞蛋白进行验证。
1.3.3 蛋白质消化 利用过滤辅助样品制备程序进行蛋白质消化[13],并用BCA 蛋白测定试剂盒测定蛋白质含量。
1.3.4 iTRAQ 标记 按说明使用iTRAQ 试剂标记每个枸杞样品的100 μg 肽混合物。蛋白质样品分别标记为113(宁夏中宁)、114(新疆精河)、115(内蒙古乌拉特前旗)、116(甘肃瓜州)及117(青海德令哈)。
1.3.5 分离标记肽 利用纯化系统通过强阳离子交换SCX 色谱分离iTRAQ 标记的肽。用缓冲液A(25% ACN、10 mmol/L KH2PO4、pH 3.0)酸化重组干燥的肽混合物,并将其装入聚硫乙基(4.6×100)mm 柱(5 μm,200Å)。用缓冲液B(500 mmol/L KCl,10 mmol/L KH2PO4,25% ACN,pH 3.0)以1 mL/min 的流速梯度洗脱肽。缓冲液B 吸光度值的线性梯度和后续步骤与前人研究方法相同[14]。
1.3.6 液相色谱-串联质谱分析 液相色谱-串联质谱(LC-MS/MS)分析的方法与Wang等[15]的研究相同。每个样品都采用液相色谱系统Easy nLC 分离。0.1%甲酸为缓冲液A,0.1%甲酸(84%乙腈)为缓冲液B,色谱柱与95%缓冲液A 平衡。将样品从自动进样器装入装载柱,并通过ntelliFlow 技术用分析柱分离,流速为300 nL/min。在Q Exactive 上进行LC-MS/MS 分析,并将其与Easy nLC 耦合。
1.3.7 数据库搜索和蛋白质鉴定与定量 质谱的鉴定和定量通过Proteome Discoverer 1.4 和Mascot 2.2 进行。用蛋白表达倍数≥1.2 或≤0.83 且P<0.05 来确定上调或下调差异表达蛋白(DEPs),用t 检验进一步分析蛋白质比值。
1.3.8 生物信息学分析 以宁夏中宁“宁杞1 号”枸杞作为相对定量参考,采用层次聚类算法对5个产地的总蛋白质进行聚类分析,对所有DEPs进 行KEGG(Kyoto Encyclopedia of Genes and Genomes,KEGG)通路富集分析。后将各个比较组DEPs 通过蛋白质ID 在uniprot 网站进行查找,标注所有DEPs 的主要功能,并筛选出与多糖合成相关的DEPs。将筛选的DEPs 通过STRING 软件构建蛋白质互作网络(protein-protein interaction,PPI),利用KEGG 通路结合筛选后的DEPs推测出多糖合成代谢途径。
2 结果与分析
2.1 枸杞蛋白质质谱鉴定和聚类分析
质谱数据(图1a)表明共有818 444 个LCMS/MS 谱与已知谱进行了匹配;匹配谱数为60 795 个,利用率为7.43%;得到16 384 个肽段;其中鉴定到的唯一肽段总数有12 375 个。这些肽共鉴定得到4 852 个蛋白质,表明采自宁夏、新疆、内蒙古、甘肃和青海的“宁杞1 号”枸杞共鉴定出4 852 个蛋白质。将鉴定到的蛋白进行聚类分析(图1b),结果表明采自各产地的枸杞样品的3次重复结果较好,蛋白组学测定结果可靠。

图1 蛋白质鉴定(a)和聚类分析(b)Fig.1 Mass spectrometry identification results(a)and Cluster analysis(b)
2.2 差异蛋白筛选与分析结果
4 个比较组共鉴定出1 437 个DEPs,如图2a,青海/宁夏组的DEPs 数量最多,共1 015 个。其次是甘肃/宁夏组和新疆/宁夏组,分别是966 个和446 个。而内蒙古/宁夏组的DEPs 最少,共166个。此外,各比较组上调的DEPs 数量均小于下调的。将4 个比较组的DEPs 做Venn 图,结果如图2b 所示,发现在4 个比较组中都存在的DEPs 有56 个,且新疆/宁夏组、青海/宁夏组和内蒙古/宁夏组共有的DEPs 最少,共2 个。
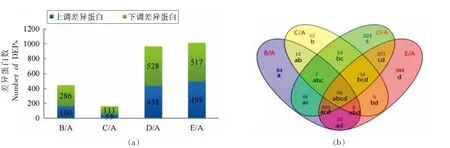
图2 DEPs 分布及重叠情况Fig.2 Distribution and overlap of DEPs
2.3 差异蛋白KEGG 通路分析
对新疆/宁夏组、内蒙古/宁夏组、甘肃/宁夏组及青海/宁夏组的DEPs 进行KEGG 通路分析,并将各组注释到DEPs 数最多的前20 个通路列出。结果如图3 所示,新疆和宁夏比较组KEGG 途径中DEPs 数目最多的条目是“碳代谢”,其次为“氨基酸的生物合成”和“核糖体”。内蒙古和宁夏比较组KEGG 途径中DEPs 数目最多的条目是 “内质网蛋白质加工”,其次为“氨基酸的生物合成”和“嘌呤代谢”。甘肃和宁夏比较组KEGG 途径中DEPs 数目最多的条目是“碳代谢”,其次为“氨基酸的生物合成”和“核糖体”。青海和宁夏比较组KEGG 途径中DEPs 数目最多的条目是“碳代谢”,其次为“氨基酸的生物合成”和“内质网蛋白质加工”。在4 个比较组中DEPs 占比最大的是光合有机体的“碳代谢”,中心碳代谢是所有生物体最基本的细胞代谢途径之一[16],而且光合作用本身是糖合成和运输的决定性因素,并连接着调节果实发育的环境和生物因素[17]。
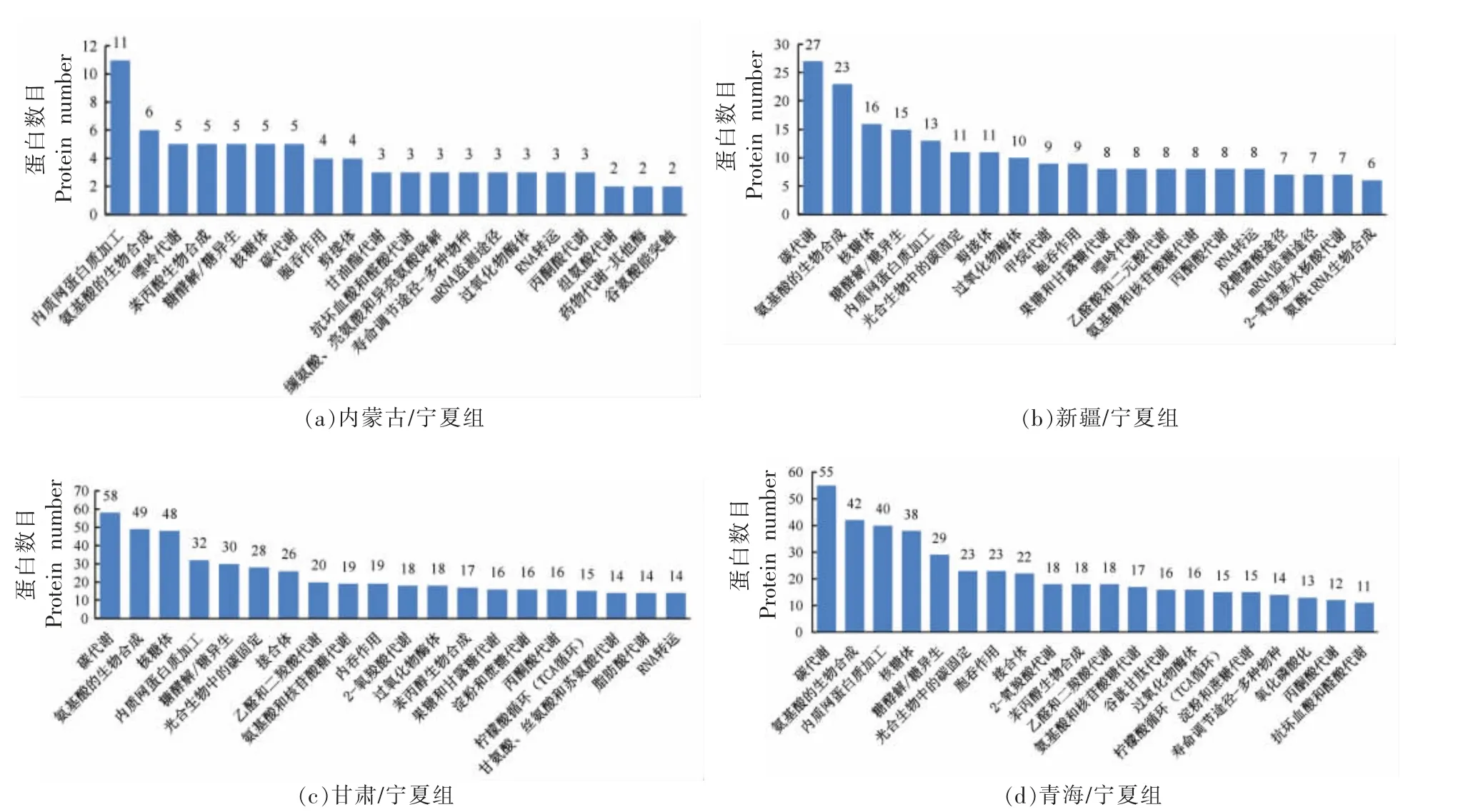
图3 差异蛋白KEGG 通路注释Fig.3 KEGG pathway annotation of protein expression
2.4 枸杞中多糖相关DEPs 筛选
筛选与枸杞多糖合成代谢相关的DEPs,共160 个。结果如图4 所示,青海/宁夏组得到的相关差异蛋白最多,共102 个;内蒙古/宁夏组得到的相关差异蛋白最少,共11 个。

图4 各个比较组蛋白筛选结果Fig.4 Screening results of proteins in each comparison group
进一步筛选后,除去未表征蛋白和在KEGG通路中无法注释的外,与枸杞多糖相关的DEPs共23 个,得到的多数表达蛋白与植物多糖合成代谢有直接关系。而这23 个DEPs 大多表征在甘肃/宁夏组和青海/宁夏组中,且在新疆/宁夏组和内蒙古/宁夏组中多不显著表达(P>0.05),因此剔除这两个比较组,只比较甘肃/宁夏组和青海/宁夏组,得到的结果如表1 所示。
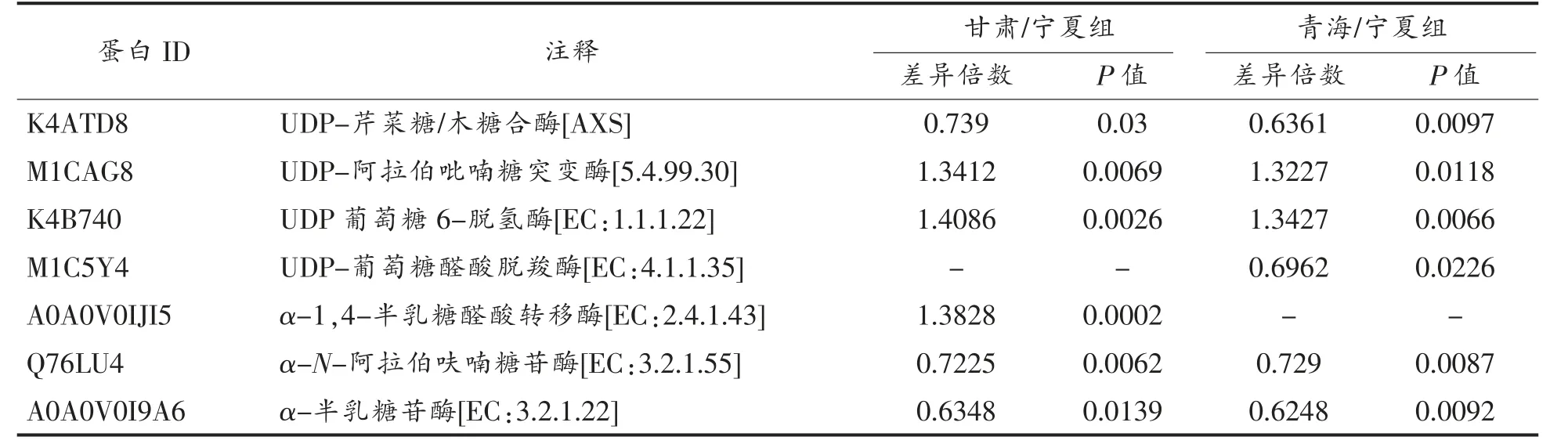
表1 不同产地枸杞果实多糖相关差异蛋白筛选Table 1 Screening of wolfberry polysaccharide related proteins from different habitats
2.5 蛋白质互作网络(PPI)的构建
由于缺乏枸杞及其近边缘物种的蛋白质互作,故而通过茄科的同源性蛋白构建蛋白质互作网络(图5)。利用160 个与多糖相关的DEPs 制作蛋白质互作互交作用最明显的一组由21 个DEPs组成,包括:糖基转移酶家族(K4CPX6、K4CMS0)、己糖激酶家族(K4C7S0)、ATP 依赖的6-磷酸果糖激 酶(K4CES3)、α -1,4 -葡聚糖 磷酸化 酶(K4CSQ2)及一些尚未被验证的蛋白(annotation not available)。另一组由6 个DEPs 组成,包括β-半乳糖苷酶(E3UVW7),α -半乳糖苷酶(K4BP29)、α-甘露糖苷酶(E0XN34)及一些尚未被验证的蛋白(annotation not available)。

图5 筛选后差异表达蛋白的相互作用网络Fig.5 Interaction network of differentially expressed proteins after screening
2.6 枸杞多糖相关蛋白通路分析
植物中的多糖主要分为纤维素、半纤维素和果胶三大类[18],并利用这23 个多糖相关蛋白与KEGG 通路分析结合,初步预测枸杞多糖合成代谢相关通路,主要有5 个过程。这些过程并非单独存在,而是由UDP-葡萄糖连接在一起的,UDP-葡萄糖通过一系列反应参与果胶物质、半纤维素、糖脂和其它糖基化分子的合成[19],因此多糖的合成是通过UDP-葡萄糖池的通量进行碳分配和循环[20]。在多糖合成代谢的过程中,当不同产地的同一个蛋白的表达倍数存在差异时,可能导致其多糖合成代谢也存在差异。
2.6.1 蔗糖合成分解代谢过程 蔗糖合成和分解代谢的过程如图6 所示,蔗糖磷酸合成酶(EC:2.4.1.14,SPS)先催化果糖-6-磷酸和UDP-葡萄糖转化为蔗糖-6-磷酸。通过对不同淀粉叶物种茄科植物番茄、马铃薯和烟草等植物的SPS 过表达的分析得到证实,SPS 活性与这些物种叶片的蔗糖合成率呈正比关系[21]。青海和甘肃枸杞中SPS 的表达量低于宁夏枸杞(表1),推测宁夏蔗糖合成率可能高于青海和甘肃。郑国琦[22]研究发现不同发育期枸杞果实中枸杞多糖含量的积累与蔗糖含量呈负显著相关,表明宁夏中宁产地枸杞的多糖含量可能会低于青海和甘肃,但这与课题组前期试验结果并不一致[12]。前期枸杞多糖含量测定结果表明,青海和宁夏产地微高于甘肃产地,导致这一结果的原因可能是SPS 的活性与蔗糖积累量并不总是密切相关,葡萄柚汁囊中蔗糖含量增加时,SPS 活性趋于稳定[23]。
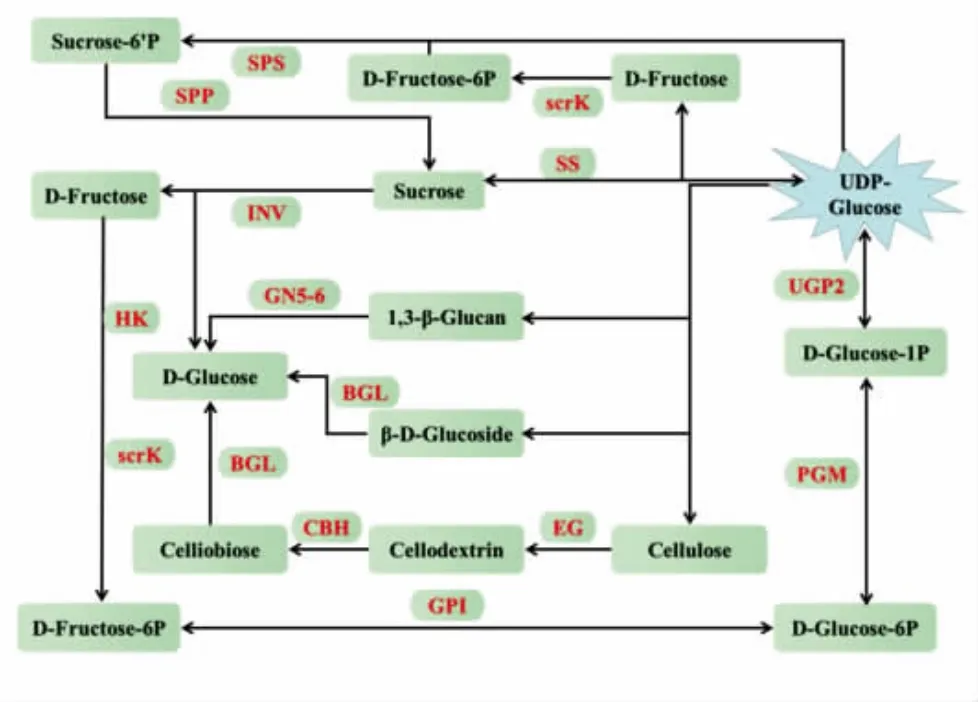
图6 蔗糖与纤维素合成代谢过程Fig.6 The synthesis and metabolism of sucrose and cellulose
蔗糖分解代谢具有复杂的生理生化过程,主要调控因子是蔗糖代谢酶,包括蔗糖合成酶(EC:2.4.1.13,SS)和细胞壁转化酶(EC:3.2.1.26,INV),二者活性的变化明显影响了总碳水化合物的积累状态,其中SS 的作用是双向的,促进蔗糖和UDP-葡萄糖的平衡[24]。UDP-葡萄糖作为纤维素合成的底物,通过SS 被引导到纤维素合成酶复合物,催化蔗糖裂解生成UDP-葡萄糖和果糖[25]。SPS(果糖-6-磷酸+UDP-葡萄糖)通过循环使果糖生成蔗糖,为SS 提供连续的底物,以UDP-葡萄糖的形式的进行纤维素的生物合成,同时限制了细胞内果糖的数量[26]。如表1 所示,青海枸杞蛋白中的SS表达量低于宁夏,可能会导致青海枸杞中纤维素的前体底物UDP-葡萄糖较少,使纤维素含量较少,影响枸杞多糖合成。
2.6.2 纤维素合成代谢过程 纤维素合成代谢的过程如图6 所示,一部分UDP-葡萄糖通过一系列反应生成纤维素后,纤维素需要一个酶联合体来逐渐将纤维素分解,最终代谢为葡萄糖;另一部分UDP-葡萄糖生成1,3-β-葡聚糖和β-葡萄糖苷,并分别由β-1,3-葡聚糖酶(EC:3.2.1.39,GN5-6)和β-葡萄糖苷酶(EC:3.2.1.21,BGL)最终代谢为葡萄糖[27]。研究表明纯化后的野生杏β-葡萄糖苷酶可以将纤维二糖糖化成葡萄糖,β-葡萄糖苷酶(EC:3.2.1.21,BGL)对纤维素材料的糖化具有高亲和力和催化能力[28]。纤维素的底物UDP-葡萄糖通过一系列酶的作用转化为纤维素是利用一个高效的酶联合体来水解纤维素,转化为葡萄糖通常需要3 种酶:内切葡聚糖酶(EC:3.2.1.4,EG)、外切葡聚糖酶(EC:3.2.1.91,CBH)和BGL。如表1 所示,在酶联合体中,除青海和甘肃枸杞中BGL 的表达量高于宁夏枸杞外,未发现其它两种酶有差异表达,推测BGL 可能是导致青海和甘肃与宁夏枸杞的纤维素水解效果速率产生差异的主要原因。在纤维素水解过程中,产物葡萄糖在很多情况下会抑制BGL 的活性[29],因而青海和甘肃产地枸杞多糖中的葡萄糖含量可能会低于宁夏产地,这一结果与前期研究一致[12]。
2.6.3 半乳聚糖合成代谢过程 如图7 所示,UDP-葡萄糖-4-表异构酶(EC:5.1.3.2,galE)催化UDP-葡萄糖和UDP-半乳糖相互转化。UDP-半乳糖在半乳糖醇合成酶(EC:2.4.1.123,GOLS)的作用下生成半乳糖醇,半乳糖醇作为半乳糖基供体,分别由棉子糖合成酶(EC:2.4.1.82,E2.4.1.82)和水苏糖合成酶(EC:2.4.1.67,E2.4.1.67)这两种专门的合成酶合成棉子糖和水苏糖;随后由β-呋喃果糖苷酶(EC:3.2.1.26,INV)将两种糖分别水解成蜜二糖和甘露三糖;最后由α-半乳糖苷酶(EC:3.2.1.22,GLA)水解棉子糖、水苏糖、甘露三糖和蜜二糖最终生成半乳糖和葡萄糖[30]。在拟南芥中,棉子糖和半乳糖醇在冷适应条件下会增加,而棉子糖的合成降解会受到半乳糖醇合成酶和棉子糖合成酶的作用[31]。在矮牵牛花中GLA 下调会导致整个植株的耐寒性增加,因此认为GLA 基因的过度表达会导致内源性棉子糖含量降低,从而减低植物抗冻性[32]。由表1 可知甘肃和青海地区枸杞GLA 和INV 与宁夏地区相比表达下调,推测甘肃和青海地区枸杞耐寒性高于宁夏,宁夏地区枸杞棉子糖家族寡糖含量可能低于甘肃和青海地区。
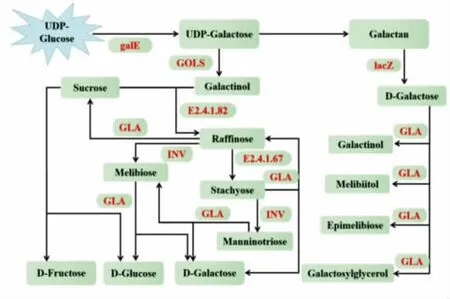
图7 半乳聚糖合成代谢过程Fig.7 The synthesis and metabolism of galactan
2.6.4 半纤维素合成代谢过程 半纤维素主要为阿拉伯木聚糖,如图8 所示,UDP-葡萄糖通过UDP-葡萄糖脱氢酶(EC:1.1.1.22,UGDH)不可逆地反应生成UDP-葡萄糖醛酸,并在UDP-葡萄糖醛酸脱羧酶(EC 4.1.1.35,UXS)、UDP-木糖/木糖合酶(AXS)和其它一系列酶的作用下一部分转化为UDP-D-芹菜糖和UDP -D-木糖[33],UDP-木糖通过一些与阿拉伯聚糖合成代谢相关的酶作用下进行分解代谢。UDP-葡萄糖作为转换UDP-糖的重要分支节点在UGDH、UXS 及AXS 和UDP-阿拉伯糖-4-表异构酶(EC 5.1.3.5,UXE)的催化下分别转换为UDP-葡萄糖醛酸、UDP-木糖和UDP-L-阿拉伯糖。
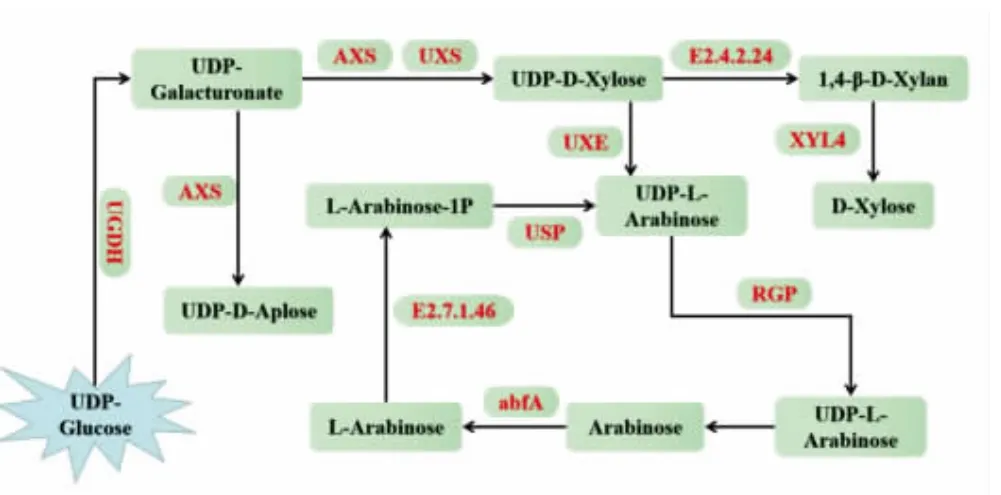
图8 半纤维素合成代谢过程Fig.8 The synthesis and metabolism of hemicellulose
有研究表明,高表达的AXS 和低表达的UXE会导致UDP-木糖的积累[34]。前期研究发现[12],宁夏产地枸杞多糖中木糖含量高于青海,而阿拉伯糖含量低于青海。可能因为青海枸杞中UXS 和AXS 的表达量均低于宁夏,青海枸杞中UGDH 的表达量高于宁夏而导致木糖和阿拉伯糖积累发生变化。
2.6.5 果胶合成代谢过程 果胶是存在所有植物初级细胞壁中的多糖家族,属于酸性植物细胞壁多糖,(1,4)-链接的β-D-吡喃半乳糖醛酸作为骨架结构的一部分。如图9 所示,UDP-葡萄糖-4-表异构酶(EC:5.1.3.2,galE)催化UDP-葡萄糖和UDP-半乳糖相互转化,UDP-半乳糖醛酸在α-1,4-半乳糖醛酸转移酶(EC:2.4.1.43,GAUT)的作用下生成果胶,而PG(EC 3.2.1.15)和果胶酯酶(EC:3.1.1.11,E3.1.1.11)是最佳的果胶修饰酶,可降解果胶[35-36]。

图9 果胶合成代谢过程Fig.9 The synthesis and metabolism of pectin
果胶裂解酶(EC:4.2.2.2,PLY)主要通过降解原代细胞壁中的果胶在植物生长发育过程中发挥重要作用,能够促进细胞的扩张和分化[38-39]。在植物中,已经证实,在香蕉等水果的成熟和软化过程中PLY 参与果胶多糖主链的降解[37]。果胶酯酶(EC:3.1.1.11,E3.1.1.11)是一种羧酸酯酶,属于水解酶类,该酶通过使细胞壁中存在的多半乳糖醛酸果胶主链中的甲基化羧基脱酯化,促进果胶的降解,从而提高了多半乳糖醛酸酶的效率[40]。甘肃和青海地区枸杞中PLY 和E3.1.1.11 的表达量与宁夏产地有差异,PLY 和果胶酯酶可能对枸杞果实中的果胶多糖具有一定的降解作用,从而影响不同产地枸杞多糖差异。
3 结论
本文基于iTRAQ 结合2D LC-MS/MS 的技术研究不同产地“宁杞1 号”枸杞的蛋白质差异,共筛选到1 437 个DEPs,进行KEGG 通路注释,进一步筛选发现与枸杞多糖相关的差异表达蛋白共23 个,推测枸杞多糖合成代谢通路,主要分为蔗糖合成代谢、纤维素合成代谢、半乳聚糖合成代谢、阿拉伯木聚糖合成代谢及果胶合成代谢5 个过程,主要参与其中的酶为蔗糖磷酸合成酶、蔗糖合成酶、UDP-葡萄糖醛酸脱羧酶、β-葡萄糖苷酶、α-半乳糖苷酶、果胶酯酶和果胶裂解酶等,这些酶可能是影响不同产地枸杞多糖差异的重要蛋白。本文为深入了解不同产地枸杞多糖差异变化机理提供了一定的参考,下一步可针对不同成熟期的枸杞进一步分析,以探究不同产地枸杞多糖变化规律。
