温度处理对冷藏猕猴桃后熟品质和细胞壁代谢的影响
2023-11-26王敏雁杨帆谭佳伟索江涛闫金姣马艳萍
王敏雁,杨帆,谭佳伟,索江涛,闫金姣,马艳萍*
(1 西北农林科技大学林学院 陕西杨凌712100 2 陕西佰瑞猕猴桃研究院有限公司 西安710054 3 西北农林科技大学园艺学院 陕西杨凌 712100)
猕猴桃富含维生素、膳食纤维、多种氨基酸和矿物质等营养物质,口味酸甜且风味独特,深受广大消费者喜爱[1]。冷藏是保障猕猴桃长期供应最为常见的贮藏技术。出库时果实质地仍然坚硬,需经一段时间的后熟达到可食硬度时才能食用。出库后自然后熟变软的猕猴桃果实风味及品质质量参差不齐,显著影响消费者的购买欲,进而制约猕猴桃产业的发展。目前新西兰推出即食猕猴桃商品果,其核心是将采摘成熟后的猕猴桃果实经人为后熟软化处理达到即食程度,让消费者可以放心购买,赢得对果实品质的信赖[2]。探寻能够快速催熟冷藏出库后的猕猴桃果实,同时维持其品质的处理是促进猕猴桃产业发展的有效途径。
温度和乙烯是影响果蔬后熟进程的重要因素[3]。目前,产业中常用果蔬催熟方式为乙烯利催熟[4]。乙烯利是一种低毒性的植物生长调节剂,已在大量呼吸跃变型果实催熟中应用[5],然而常导致成熟度不可控、商品质量差、货架期缩短和过熟腐烂等问题[6]。短期高温处理的温度通常为30~55 ℃,处理时间在几秒到几小时不等[7]。短期高温处理对果蔬采后品质的影响在商业化应用方面日趋成熟,其中普遍应用的热激处理包括热空气和热水浸泡两种[8]。与热水处理相比,热空气具有成本低、操作简单和装备易获得等优点[9-10]。
果实品质和细胞壁代谢变化是衡量猕猴桃果实后熟技术的重要方面,涉及硬度、可溶性固形物、可滴定酸、淀粉、果胶含量和细胞壁代谢酶活性等相关指标。短期高温处理可以提高果实细胞壁水解酶的活性,从而引起细胞壁物质降解,破坏细胞壁结构,最终导致果实质地软化[8]。目前热激处理已在苹果[11]、草莓[12]、芒果[13]、枇杷[14]等果蔬中应用。热激处理能有效控制猕猴桃果实采后灰霉病[15]和冷害[16]的发生。而对冷藏后通过高温热空气处理使猕猴桃果实可以即食,以及对比不同温度处理对细胞壁代谢的影响鲜见研究报道。
本试验以1 ℃冷藏“海沃德”出库后猕猴桃果实为材料,分别以10 ℃模拟超市冷藏柜温度,20℃常温处理和(40+20)℃热空气处理,研究果实后熟期间品质、细胞壁代谢和贮藏等相关指标的变化规律和差异,探讨温度调控猕猴桃果实后熟品质的内在机制,对即食猕猴桃的生产提供技术参考。
1 材料与方法
1.1 材料与试剂
“海沃德”猕猴桃果实可溶性固形物含量达到7.2%时,人工采收至陕西佰瑞猕猴桃研究院有限公司,采收时选择大小和成熟度一致的无病虫害果实,置于塑料筐运回后常温放置24 h,散去田间热。然后于相对湿度(95±5)%、(1±0.5)℃冷库中继续贮藏。在硬度52 N 时移至室温,平铺散去水蒸气后待用。
三氯乙酸,上海山浦化工有限公司;乙二胺四乙酸、乙酰水杨酸、碘化钾、淀粉,广东光华科技股份有限公司;3,5-二硝基水杨酸,上海鼓臣生物技术有限公司。
1.2 仪器与设备
GY-4 型台式硬度计,乐清市艾德堡仪器有限公司;Eppendorfa AG22331 型低温离心机,德国Eppendorf 公司;PAL-BX/ACID3 型手持糖酸仪,日本爱拓公司;Tel-7001 型CO2分析仪,美国TIR公司;Trace GC Ultra 型气相色谱仪,美国Thermo Scientific 公司;RXZ 型智能人工气候箱,宁波江南仪器厂;Titrette瓶口滴定器,德国BRAND GMBH+CO KG 公司;A11 型研磨分析仪,德国IKA 公司。
1.3 试验方法
1.3.1 样品处理 将出库后的猕猴桃果实分成3组,分别移至10,20 ℃和(40+20)℃的3 个培养箱中,相对湿度为70%~80%。每处理3 个重复,每重复135 个果实。每处理固定45 个果实,每15 个为1 个重复,用于呼吸速率和乙烯释放速率的测定。
1.3.2 取样 依据不同温度处理果实不同软化进程预测,10 ℃处理每8 d、20 ℃处理每4 d、(40+20)℃处理于0,4,6,8 d 时进行取样。每处理3 个重复,每重复15 个果实。取样时,每处理每重复测定果实果肉硬度、可溶性固形物含量(SSC)和可滴定酸(TA)含量,然后去皮取果实赤道部位果肉样品,立即投入液氮速冻后置于-80 ℃冰箱,备用测定其它相关指标。
1.3.3 指标测定
1.3.3.1 硬度和腐烂率 采用硬度计测定。测定时在果实赤道部垂直两个点去皮测定,以两个点的平均值作为果实硬度值。腐烂率参考胡苗等[17]的研究方法测定,贮藏硬度达到15N 左右时,统计腐烂果个数。腐烂率计算公式为:
1.3.3.2 呼吸速率和乙烯释放速率 呼吸速率和乙烯释放速率参照董晓庆等[18]的方法。每重复的15 个果实先测定呼吸速率,然后吸取气体,采用气相色谱仪测定乙烯释放速率。
1.3.3.3 营养品质 猕猴桃果实的SSC 测定时用手持榨汁器榨汁后采用手持糖酸仪测定;TA 含量参照曹建康等[19]的方法测定;固酸比以SSC 和TA的比值计算;原果胶和水溶性果胶含量参考He等[20]的方法;淀粉含量参考Lu等[21]的方法。
1.3.3.4 软化相关酶活性 α-淀粉酶活性参照曹建康等[19]的方法稍作更改进行测定;PE 和活性β-Gal 活性参照Ban等[22]的方法稍作更改进行测定;PG 活性参照Salvador等[23]的方法稍作更改进行测定。
1.4 数据统计分析
采用Microsoft Excel2016 和Origin2017 软件分别进行数据处理和作图,应用SPSS22.0 对数据进行显著性和多重比较分析,采用Duncan 多重极差检验比较平均值在P=0.05 水平的差异显著性。所有指标测定均设置3 个重复,数据以均值±标准差表示。
2 结果与分析
2.1 不同温度处理对冷藏后猕猴桃果实后熟品质的影响
2.1.1 硬度和腐烂率 硬度是反映猕猴桃果实后熟进程的重要指标。随着处理温度的升高,“海沃德” 猕猴桃果实的硬度下降速度加快(图1a)。(40+20)℃处理,贮藏6 d 时达到可食硬度16 N 完成后熟,贮藏8 d 时果实硬度下降至7 N,下降率高达84.2%,显著高于20 ℃和10 ℃处理;20 ℃处理,贮藏12 d 时达到可食硬度12 N 完成后熟,贮藏14 d 时,果实的硬度下降至8 N,而10 ℃处理果实贮藏40 d 时硬度仍然高达约20 N。当果实硬度达到15 N 左右时,统计其腐烂率(图1b)。(40+20)℃处理果实腐烂率为8%,20 ℃处理腐烂率为4%,表明高温处理加速了猕猴桃果实的软化,但果实腐烂率仍然较低。

图1 不同温度处理对冷藏后猕猴桃果实硬度(a)和腐烂率(b)的影响Fig.1 Effects of different temperature treatments on fruit firmness(a)and decay rate(b)of kiwifruit after cold storage
2.1.2 SSC 和TA 含量 SSC 和TA 含量是影响猕猴桃果实风味的重要因素。不同温度处理猕猴桃果实贮藏后熟期间的SSC 均呈现上升趋势(图2a),10 ℃果实的SSC 高于其它处理。贮藏期间,10,20 ℃和(40+20)℃处理的SSC 均值分别为12.49%,11.77%和11.54%。果实TA 含量在贮藏期间以(40+20)℃处理下降最快(图2b),3 种处理的TA 含量均值分别为1.55%,1.37%和1.29%,平均固酸比分别为7.90,8.19,8.39。可见,(40+20)℃果实的平均固酸比最高,表明该处理口感较好。
2.2 不同温度处理对冷藏后猕猴桃果实细胞壁代谢的影响
2.2.1 呼吸速率和乙烯释放速率 猕猴桃为呼吸跃变型果实,呼吸速率和乙烯释放速率是果实后熟衰老进程的重要指标。果实在20 ℃和(40+20)℃贮藏期间,其呼吸强度分别于12 d 和6 d 时达到峰值(图3a),但前者呼吸峰显著高于后者(P<0.05);10 ℃贮藏果实在贮藏期间未出现呼吸高峰。3 种处理果实贮藏期间,(40+20)℃处理果实的乙烯释放速率持续增加;20 ℃果实的乙烯释放速率12 d 时达到峰值,且显著高于其它处理(P<0.05);贮藏期间10 ℃处理果实未出现乙烯高峰(图3b)。20 ℃果实乙烯峰值出现时间和10 ℃果实的乙烯变化趋势分别与该温度下的呼吸速率变化趋势一致。

图3 不同温度处理对冷藏后猕猴桃果实呼吸速率(a)和乙烯释放速率(b)的影响Fig.3 Effects of different temperature treatments on fruit respiration rate(a)and ethylene release rate(b)of kiwifruit after cold storage
2.2.2 原果胶和水溶性果胶含量 贮藏期间,猕猴桃果实原果胶含量整体均呈现下降趋势,且前期下降速率较快后期变化平缓(图4a)。20 ℃处理果实的原果胶含量下降最快,贮藏末期下降至0.37%,较贮藏初期相比下降率为47.02%。3 个温度处理果实的水溶性果胶含量均呈现上升趋势(图4b),10 ℃果实的水溶性果胶含量贮藏32 d 时达到峰值(0.45%);(40+20)℃处理的水溶性果胶含量贮藏期间迅速上升,至8 d 时最高(0.54%);20 ℃果实的水溶性果胶含量缓慢上升至12 d 时下降。表明(40+20)℃处理促进了“海沃德”猕猴桃果实水溶性果胶含量的上升,进而导致果实软化。

图4 不同温度处理对冷藏后猕猴桃果实原果胶含量(a)和水溶性果胶含量(b)的影响Fig.4 Effects of different temperature treatments on fruit ASP content(a)and WSP content(b)of kiwifruit after cold storage
2.2.3 淀粉含量和α-淀粉酶活性 贮藏期间,各温度处理猕猴桃果实的淀粉含量均呈现下降趋势(图5a)。贮藏期间,10,20 ℃和(40+20)℃果实淀粉含量的下降速率分别为24.60%,25.42%和24.70%;10 ℃果实的淀粉含量贮藏16 d 时与0 d相比下降率为20.09%,之后趋于平稳;贮藏结束时,3 个温度贮藏果实的淀粉含量差异不显著(P>0.05)。贮藏期间,10 ℃和20 ℃果实的α-淀粉酶活性分别在32 d(8.80 mg/g/min)和12 d(9.08 mg/g/min)达到峰值后下降,(40+20)℃处理果实的α-淀粉酶活性持续上升,贮藏8 d(8.15 mg/g/min)时达到最高值。
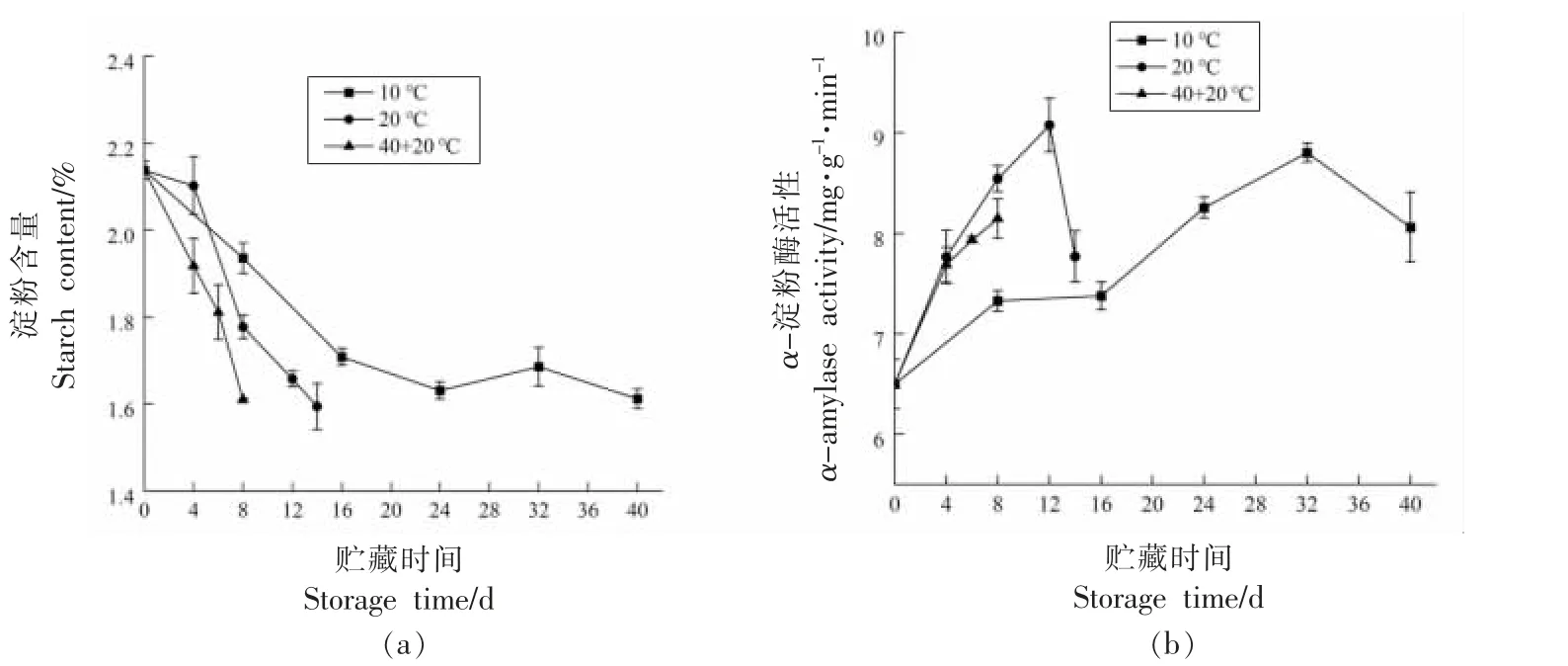
图5 不同温度处理对冷藏后猕猴桃果实淀粉含量(a)和α-淀粉酶活性(b)的影响Fig.5 Effects of different temperature treatments on fruit starch content(a)and α-amylase activity(b)of kiwifruit after cold storage
2.2.4 PE、PG 和β-Gal 活性 PE、PG 和β-Gal 在果实贮藏期间共同作用降解细胞壁物质导致果实软化。贮藏期间,10 ℃和20 ℃处理猕猴桃果实的PE 活性分别在贮藏40 d(18.46 μmol/min/g)和12 d(12.83 μmol/min/g)达到最高值;(40+20)℃处理的PE 活性贮藏期间持续增加(图6a)。10 ℃和20℃处理猕猴桃果实的PG 活性均呈现先上升后下降趋势,分别在贮藏16 d 和8 d 时达到峰值,20℃处理果实贮藏期间的PG 活性均值(1.25 mg/h/g)高于其它两个温度处理。3 个温度处理猕猴桃果实贮藏期间的β-Gal 活性均呈现先上升后下降趋势(图6c),40 ℃处理果实的酶活性显著(P<0.05)低于其它两个处理;20 ℃果实的β-Gal 活性均值最高,其次为10 ℃处理。表明高温处理仅增加了果实的PE 活性,但对PG 和β-Gal 活性的影响不明显。

图6 不同温度处理对冷藏后猕猴桃果实PE(a)、PG(b)和β-Gal(c)活性的影响Fig.6 Effects of different temperature treatments on fruit PE activity(a),PG activity(b)and β-Gal activity(c)of kiwifruit after cold storage
3 讨论
猕猴桃是典型的呼吸跃变型果实,温度和乙烯是影响猕猴桃果实采后成熟和品质的重要因素。前人研究认为,低温贮藏时温度和乙烯共同调控猕猴桃果实的成熟[24],但也有学者发现低温对于猕猴桃果实软化的调控具有独立于乙烯的通路[24-25]。本研究发现,20 ℃和(40+20)℃贮藏的猕猴桃果实均出现明显的呼吸和乙烯高峰,果实后熟较早,但10 ℃处理果实贮藏期间未出现乙烯的大量合成,然而果实仍然能够正常成熟,这可能是通过猕猴桃内部的低温调节成熟机制促进果实的成熟,这与在“海沃德”上的研究一致[26]。说明乙烯并非猕猴桃果实成熟的关键必须因子,温度和乙烯可以共同调控果实的成熟,同时也具有独立调控果实成熟的通路,二者调控果实成熟的机制应该不同。温度可能是决定二者之间协调还是独立的主要因素,不同品种猕猴桃果实对温度的敏感性不同,当贮藏温度低于响应温度时,低温可独立调控果实完成后熟;当温度高于响应温度时,内源乙烯将大量释放,二者共同促进果实软化。
果实质地变化与果胶代谢密切相关。一般在后熟软化过程中,细胞壁原果胶逐渐降解,会引起细胞壁的结构完整性遭到破坏,使果实质地出现软化[27]。本研究结果显示,猕猴桃果实后熟期间,10 ℃处理果实随着硬度的降低,其原果胶含量和水溶性果胶含量呈极显著负相关(P <0.01,r=-0.60**),硬度与原果胶含量和水溶性果胶分别呈现极显著正相关(P<0.01,r=0.82**)和负相关(P<0.01,r=-0.79**)关系,表明原果胶转化为水溶性果胶导致果实的质地软化。20 ℃处理中,果实的水溶性果胶含量先上升后下降,这可能是因为果实在细胞壁酶的作用下原果胶先降解成水溶性果胶,随后水溶性果胶聚集形成螯合可溶性果胶,进而导致水溶性果胶含量降低[28]。(40+20)℃处理中,水溶性果胶含量高于其它两个温度处理,这可能是果实硬度低于其它两个温度处理的主要原因。
PE、PG 和β-Gal 是导致果实成熟软化的主要细胞壁降解酶[29]。果实中细胞壁降解酶的活性与果胶类物质的含量和组分变化密切相关[30]。PE 和PG 协同催化果胶降解,β-Gal 通过去除果胶多聚醛酸侧链的半乳糖残基使果胶解聚或溶解[30-31]。本研究中,(40+20)℃处理的PE 活性在贮藏8 d 内高于20 ℃处理,PG 活性此时却低于20 ℃处理,这应该是因为热激处理分别上调了PE 和下调了PG 相关基因表达所致[32];(40+20)℃处理在贮藏中水溶性果胶含量与PE、PG 活性均呈现极显著正相关(r=0.78**和r=0.87**),表明高温热激处理中PE 和PG 共同作用促进猕猴桃果实的软化。10 ℃处理果实贮藏期水溶性果胶含量逐渐升高,同时PE 活性也升高,二者呈现极显著正相关(P<0.01,r=0.63**),但PG 活性降低,说明PE 和PG 活性变化的不一致可能是影响果实缓慢软化的原因,温度处理通过影响PG 活性来影响果胶和水溶性果胶之间的转化。(40+20)℃处理的β-Gal 活性低于10 ℃和20 ℃处理,同时原果胶含量高于这两个处理,表明高温处理的β-Gal 活性降低可能有助于延迟原果胶的降解[33]。3 个温度处理猕猴桃果实的原果胶含量与PE 和β-Gal 活性均呈现极显著负相关,说明PE 和β-Gal 共同作用导致了果实中原果胶含量下降。
4 结论
冷藏“海沃德”猕猴桃果实出库后采用10,20℃和(40+20)℃贮藏,以(40+20)℃处理维持了果实固酸比,加速了果实硬度、TA 和淀粉含量的下降,提高了水溶性果胶含量,果实软化速度最快;20 ℃贮藏加快了果实原果胶的降解,提高了呼吸强度和乙烯释放速率及PG、β-Gal 和α-淀粉酶活性的峰值;10 ℃处理果实贮藏40 d 时仍然未达到可食硬度。因此,确定(40+20)℃可作为冷藏出库猕猴桃果实短期软化的适宜后熟温度,10 ℃可作为延长其货架期的贮藏温度。
