圈养孟加拉虎脂肪间充质干细胞的分离培养和生物学特性
2023-11-25冼伟杭张天佑赖健仪王丙云董贵信陈志胜陈胜锋白银山刘璨颖计慧琴
冼伟杭,张天佑,赖健仪,王丙云,董贵信,3,陈志胜,陈胜锋,白银山,刘璨颖,张 晖,计慧琴
(1.佛山科学技术学院生命科学与工程学院,佛山,528200;2.广东长隆集团有限公司,广州,511430;3.广东华南珍稀野生动物物种保护中心,珠海,519031)
孟加拉虎(Panthera tigris tigris)是一种珍稀野生动物,保护这一珍稀动物除恢复栖息地外,还可通过圈养维持物种数量。目前圈养的孟加拉虎常发肾炎[1],常规治疗方法是使用抗菌消炎药物以及调节电解质和水盐平衡,但并不能修复受损器官组织结构,即不能完全恢复肾脏功能,可能导致孟加拉虎死亡。因此,为保护孟加拉虎,需要找到一种新型且有效地用于孟加拉虎肾炎治疗的方法。在这种情况下,一种涉及间充质干细胞(mesenchymal stem cells,MSCs)的疗法——再生疗法逐渐进入人们的视野。从中胚层起源的干细胞称为间充质干细胞,具备自我更新和多向分化潜能[2-4]。脂肪间充质干细胞(adipose derived mesenchymal stem cells,AD-MSCs)来源于脂肪,大量研究发现其在肾损伤治疗上具有疗效[5-12],并且具有来源丰富、操作简便、容易获取、体外增殖能力强等特征[13-15],目前已经从人、马、猪和牛等物种中成功分离[16-23]。ADMSCs 能通过分化途径分化为受损组织细胞[5,7-10]及通过旁分泌途径分泌因子发挥干细胞募集、血管再生、减轻炎症反应和抗细胞凋亡等作用[5-10,12],促进受损组织的修复,进而起到有效治疗肾损伤的效果[5-12]。
基于AD-MSCs 在治疗肾损伤方面的作用,认为其具备治疗虎肾病的潜能,但目前缺乏标准化的分离、培养和鉴定虎AD-MSCs 的方法。本试验拟研究虎AD-MSCs 的分离方法、培养体系以及生物学特性,为虎的肾病等疾病治疗提供种子细胞。
1 材料与方法
1.1 实验动物
长隆野生动物园1岁雌性孟加拉虎。
1.2 脂肪采集及原代AD-MSCs的分离和培养
对孟加拉虎进行腹部增生物切除手术时,在距离患处5 cm 处采集脂肪,然后结节缝合,将采集到的脂肪储存在含有10%双抗的1×phosphate buffered saline(PBS)中,冷藏保存运输到实验室。用含10%双抗的PBS 洗去组织上的血液,清洗干净后将组织放进50 mL 离心管中,用无菌器械将组织剪碎,加入0.1%Ⅰ型胶原酶消化1 h 至无明显组织块后终止消化;将消化好的组织过滤并离心,弃上清,用完全培养基将细胞重悬;进行细胞计数,然后将细胞密度调整到1×106个/mL 并转移到培养皿中,放置于培养箱37 ℃、5% CO2培养,24 h 后观察细胞贴壁情况。
1.3 细胞传代培养、生长特性观察及生长曲线的绘制
待细胞在培养皿生长面积达到80%,吸去上清,用PBS 清洗。加入胰酶消化,40 s 后加入终止液终止消化。离心弃上清,传代扩增培养。显微镜下观察细胞生长状态和活性,拍照记录。依次选取P3、P6、P9 代孟加拉虎AD-MSCs,调整细胞密度并接种于96 孔板,培养24 h 后,每天同一时间段选取5 孔,加入CCK8 孵育30 min,利用酶标仪测量并记录对应OD 值,每孔测量3 次取平均值,持续8 d。以横坐标为培养时间,纵坐标为OD 值绘制生长曲线。
1.4 细胞形态学观察
使用倒置显微镜对原代及传代细胞的形态进行观察并记录。
1.5 AD-MSCs成脂诱导分化试验
选取生长状态良好的P3 代细胞,调整细胞密度接种到24 孔板中培养,各选取3 个孔作为对照组和试验组。对照组用完全培养基培养,试验组加入诱导分化A 液,诱导分化A 液由88.5%基础培养基、10.0%胎牛血清、1.4%成脂诱导分化添加物A-Ⅰ和0.1%成脂诱导分化添加物A-Ⅱ构成。培养3 d后加入B 液培养1 d 为1 个循环,诱导分化B 液由90.0%基础培养基、9.8%胎牛血清和成脂诱导分化添加物B构成。试验组在培养3个循环后,弃上清,清洗,用多聚甲醛固定30 min,弃去多聚甲醛并清洗。用油红O 染色30 min,染色结束清洗多余染液,利用倒置显微镜观察并拍照记录。
1.6 AD-MSCs成骨诱导分化试验
选取生长状态良好的P3 代细胞,调整细胞密度接种到24 孔板中培养,各选取3 个孔作为对照组和试验组。对照组用完全培养基培养,试验组用成骨诱导分化培养基培养,培养14~21 d可见细胞表面有明显粗糙样物质,弃上清并清洗细胞,用多聚甲醛固定30 min,弃多聚甲醛并清洗,加入茜素红染液染色30 min,染色结束清洗多余染液置于倒置显微镜下观察并拍照记录。
1.7 总RNA提取及cDNA合成
将虎AD-MSCs 接种于6 孔板上,待细胞长满弃上清并用DEPC-H2O 清洗,然后按照以下步骤进行:(1)用TRIzol 液裂解细胞后离心。(2)离心结束弃上清加入氯仿,混合静置离心。(3)离心结束吸取上层水层至新的EP 管中,加入异丙醇混合离心。(4)离心结束后弃上清,加入乙醇,混合离心。(5)离心结束弃上清,沉淀室温干燥后加入RNase-free ddH2O溶解沉淀并检测浓度,结果显示A260/A280值为1.867,可用于cDNA 合成。(6)cDNA 合成使用TaKaRa 反转录试剂盒,依据试剂盒说明书操作,-20 ℃保存合成的cDNA。
1.8 PCR基因检测
将cDNA 全组基因作为模板进行PCR 体系扩增,电泳检测扩增产物,引物设计见表1。因产物大小在200~3 000 bp,所以需配制1.5% 的电泳胶,取0.75 g 琼脂粉加热溶解在60 mL 的1×TAE 缓冲液中,然后加入4 µL 核酸染液搅拌均匀,倒板并冷却30 min,冷却后依次加入DL2000 DNA Marker及PCR 产物,在电压120 V、电流200 mA 的条件下电泳20 min,电泳结束后在照胶仪下观察记录电泳结果。

表1 MSCs相关基因的引物序列Tab.1 Primer sequences of MSCs related genes
2 结果
2.1 细胞形态学观察
通过Ⅰ型胶原酶消化法得到原代培养的细胞呈圆形,部分贴壁细胞呈梭状,胞体透亮(图1A);培养48 h 后,大量细胞开始贴壁,细胞形态为长梭形,胞质较大,折光性强(图1B);培养72 h 后,细胞生长面积为70%~80%,可进行传代扩增培养(图1C);传代细胞形态为均匀梭形(图1D);传代培养至P6代细胞生长稳定(图1E);细胞形态没有发生改变(图1F)。
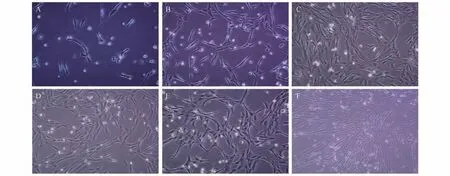
图1 孟加拉虎AD-MSCs生长状况Fig.1 Growth of AD-MSCs in Bengal tiger
2.2 AD-MSCs生长曲线
图2显示,P3、P6和P9代虎AD-MSCs的生长曲线均为S型,P3、P6和P9培养至第4天进入对数生长期,P3、P6代细胞培养至第7天进入平台期,P9代细胞培养至第8天进入平台期。与P3、P6代细胞比,P9代细胞增殖能力下降。符合MSCs生长曲线规律。
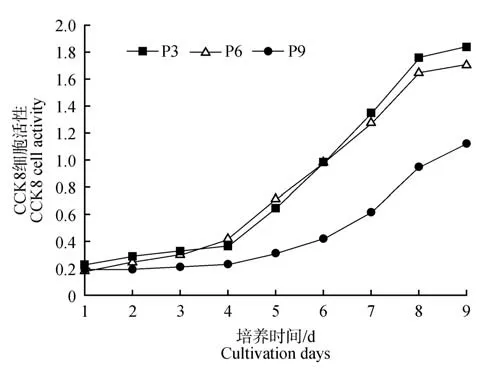
图2 孟加拉虎AD-MSCs生长曲线Fig.2 Growth curve of AD-MSCs of Bengal tiger
2.3 AD-MSCs成脂诱导分化
取生长状态良好的P3 代细胞进行成脂诱导分化,对照组细胞形态上没有明显变化,试验组细胞在加入诱导分化培养基4 d 后,胞体变大变圆,部分细胞发生融合,且可见胞质内出现大小不一的脂质颗粒,培养6 d 后脂滴增多变大。培养8 d,脂滴明显,用油红O 染色结果显示试验组的脂滴能红染(图3B),对照组不被染色(图3A),表明虎AD-MSCs具有脂向分化能力。

图3 孟加拉虎AD-MSCs成脂诱导分化结果(100×)Fig.3 Adipogenic differentiation of Bengal tiger AD-MSCs(100×)
2.4 AD-MSCs成骨诱导分化
取生长状态良好的P3 代细胞进行成骨诱导分化鉴定,对照组细胞形态上没有发生明显变化。试验组加入成骨诱导培养液培养7 d后,细胞形态发生明显变化,由长梭状变为鳞片状,细胞成片状堆积;诱导培养14 d 细胞表面可见粗糙样物质,此时利用茜素红进行成骨染色。显微镜下观察试验组可见细胞融合生长,视野内可见明显红染区域(图4B),表明成骨诱导条件下细胞形成钙结节。对照组视野下无明显红染区域(图4A)。
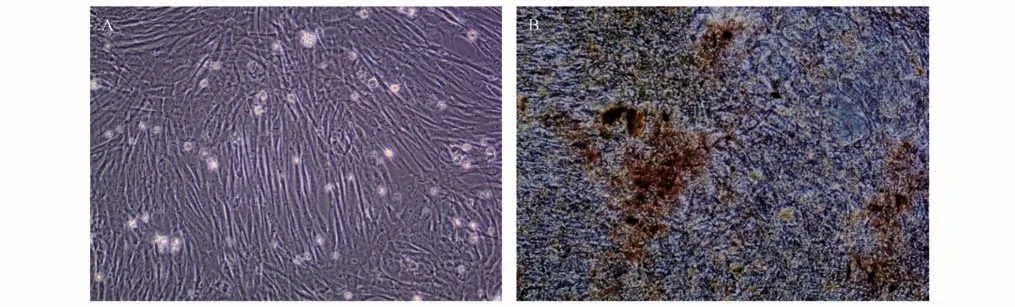
图4 孟加拉虎AD-MSCs成骨诱导分化结果(100×)Fig.4 Bone induced differentiation of Bengal tiger AD-MSCs(100×)
2.5 AD-MSCs表面标记物基因检测
PCR 基因检测结果如图5 所示,表面标记物CD90、CD105、CD29 和CD44 在相应范围有明显条带,CD34 在相应范围无条带,表明该细胞阳性表达CD90、CD105、CD29 和CD44,不表达CD34,结果符合间充质干细胞表面标记物特性。
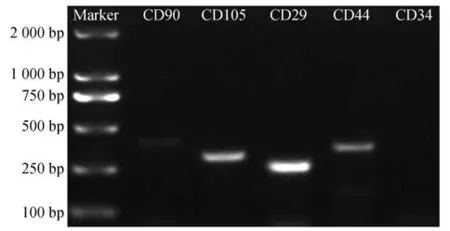
图5 孟加拉虎AD-MSCs表面标记物基因检测结果Fig.5 Detection results of AD-MSCs surface marker genes in Bengal tiger
3 讨论
圈养孟加拉虎常发肾炎疾病[1],恢复受损组织的再生疗法成为新的治疗选择。再生疗法是以MSCs 为基础的治疗方式[24]。MSCs 是一种起源于中胚层的干细胞,具有自我更新能力和多向分化能力[2-4],在体外培养能连续传代且保持细胞的形态和特性。诱导培养条件下,能分化为脂肪细胞、骨细胞和软骨细胞等多种细胞。MSCs 具有免疫原性低、趋化归巢、旁分泌和免疫调节等能力[2-3],因此广泛应用于再生医学的研究。AD-MSCs 与其他来源的MSCs 相比,具有来源丰富、供体创伤轻、易获得和体外增殖能力强的特点[13-15]。目前已经成功从多种动物上分离培养AD-MSCs,但虎脂肪来源的MSCs分离培养没有研究报道。在多种疾病的治疗上,ADMSCs被大量使用,其中在肾损伤治疗的研究中也取得进展,如犬、猫及小鼠的急性肾损伤、缺血性灌注肾损伤模型的治疗中具备效果[5-12]。不同种属的同种MSCs能表达相同表面标记物,相同表面标记物表达表明细胞具有相似的潜能[25-26],因此虎AD-MSCs的分离方法、培养体系的建立具有重要意义,为后续虎AD-MSCs 的应用建立基础,为虎肾病的治疗提供新式疗法。
AD-MSCs分离方法主要为胶原酶消化法。本研究采取Ⅰ型胶原酶消化法从脂肪组织分离得到虎的AD-MSCs。在显微镜下可见细胞形态为长梭形,生长方式为旋涡状生长,与已有研究[16-23]分离的ADMSCs 形态描述结果相符。对细胞进行多次传代培养,细胞形态保持不变,均为长梭形,P3、P6 和P9 细胞生长曲线符合MSCs 生长曲线规律。P3、P6 代细胞增殖能力差异小,与P3、P6代细胞比,P9代细胞增殖能力下降。有研究表明,MSCs 在体外培养条件下,P3 至P6 MSCs 增殖速度快、形态良好、活性强。MSCs传代至P9后,MSCs会出现空泡化、胞体变大及增殖缓慢等细胞老化现象[27]。根据MSCs 体外培养的特点可以为后续临床应用细胞代数的选择提供参考,同时也要求完善体外培养体系,延缓细胞老化。
本研究使用PCR 检测AD-MSCs 表面标志物,通过PCR 扩增得到相应MSCs 特定表面标记物基因片段。结果显示在区间范围内有CD90、CD44、CD105及CD29条带,无CD34条带。在诱导培养基条件下,AD-MSCs 可向脂肪、骨和软骨等方向分化。本试验分别对孟加拉虎AD-MSCs 进行成骨和成脂诱导分化,检测虎AD-MSCs 的多向分化能力。成骨诱导培养基主要成分为地塞米松、抗坏血酸和β-甘油磷酸,其中地塞米松和抗坏血酸有利于骨成熟和细胞外基质胶原的合成,而β-甘油磷酸钠有利于细胞内钙盐沉积和钙化形成。沉积的钙盐可用茜素红染液染成深红色以便在显微镜下观察。成脂诱导分化液中主要诱导因子有胰岛素、IBMX、罗格列酮和地塞米松,能够促进MSCs 向脂肪方向诱导分化。上述结果均符合国际MSCs 标准定义,即:表达CD44、CD90、CD105和CD29等MSCs表面标记物,不表达CD34等造血细胞表面标志物;在特定条件下可诱导分化为骨细胞和脂肪细胞[16-23,28-29]。
本研究不提供细胞流式鉴定结果,原因是目前可以获取的流式抗体因种属特异性,无法在虎ADMSCs 上表达,不适用于虎AD-MSCs 的流式细胞术鉴定。
综上所述,本研究成功建立虎AD-MSCs 原代分离培养方法,该方法操作简单方便,具有获得大量虎AD-MSCs的优势,同时通过诱导分化、表面标记物表达等鉴定试验,表明所获取细胞为虎AD-MSCs,为虎AD-MSCs的后续研究和临床应用提供稳定的细胞分离和培养方法。
