基于ERA-CRISPR/Cas12a-LFD的犀牛特异性检测技术
2023-11-25蔡一村王鑫杰林颖峥冯之航潘良文
王 瑛,张 冲,蔡一村,王鑫杰,林颖峥,冯之航,潘良文
(1.上海科技大学免疫化学研究所,上海,201210;2.昆明海关技术中心,昆明,650100;3.上海海关动植物与食品检验检疫技术中心,上海,200135;4.岭南现代农业科学与技术广东省实验室深圳分中心,农业农村部农业基因数据分析重点实验室,中国农业科学院(深圳)农业基因组研究所,深圳,518120)
犀牛隶属于哺乳纲(Mammalia)奇蹄目(Perissodactyla)犀科(Rhinocerotidae),包括白犀(Ceratotherium simum)、黑犀(Diceros bicornis)、印度犀(Rhinoceros unicornis)、爪哇犀(Rh.sondaicus)和苏门答腊犀(Dicerorhinus sumatrensis),目前均被列入CITES 附录Ⅰ,白犀指名亚种(Ceratotherium simum simum)(仅南非和斯威士兰种群)被列入附录Ⅱ。犀牛种群目前面临的主要威胁是人类的开发活动导致其栖息地减少和碎片化,同时因其角制品在传统医学[1-3]和工艺品[4-5]市场上具有重要价值,假冒[6]、盗猎和走私行为[7]屡禁不止。为保护犀牛,提高打击非法活动的有效性,开发一种能够快速检测犀牛DNA 的技术非常必要。目前,基于遗传信息的物种鉴定技术[8]一般需要在有较高环境和仪器条件的分子生物学实验室中进行,而新兴的酶促重组等温扩增(enzymatic recombinase amplification,ERA)[9]和基于CRISPR/Cas12a 系统的核酸检测技术[10-13]提供了一种全新的检测策略,甚至可以在野外条件下完成特异性物种检测鉴定。基于这一策略,本研究建立了一种基于ERA-CRISPR/Cas12a-LFD[14-16]的犀牛特异性核酸快速鉴定技术,能够快速准确地鉴定犀牛DNA。该技术基于3 个严格相互制约的特异性限制,包括ERA的引物特异性、crRNA特异性识别靶基因序列及外源DNA 上的特殊PAM 位点与crRNA 匹配[17-18]机制。这种“三位一体”的特异性要求增加了物种特异性识别限制,从而提高了检测的准确性和有效性。
1 材料与方法
1.1 样品准备
使用包括从本地超市或电商平台购买的肉类样本及保存在上海海关动植物与食品检验检疫技术中心实验室的野生动物核酸样本,均经过一代测序鉴定确认物种信息(表1)。核酸提取试剂使用美国OMEGA公司的Mag-Bind®Viral DNA/RNA 96 Kit,核酸纯化使用普洛麦格(北京)生物技术有限公司的Wizard®Genomic DNA Purification Kit,普通PCR 采用宝生物工程(大连)有限公司的PremixTaq™(ExTaq™ Version 2.0),核酸定量使用美国通用医疗公司的GE NanoVue Plus 超微量分光光度计和赛默飞世尔科技(中国)有限公司的Qubit dsDNA BR Assay Kit 核酸定量试剂盒,测序选择Illumina MiSeq 高通量测序平台和相关试剂[19]。人工合成了白犀(Y07726.1)、苏门答腊犀(FJ905816.1)、黑犀(FJ905814.1)、爪哇犀(FJ905815)[20]和印度犀(X97336.1)[21]的靶基因片段,并克隆至pUC57 载体。为了使用数字PCR 精确定量质粒的绝对拷贝数,在人工合成时加入标签序列。

表1 特异性动物物种核酸样本Tab.1 Species-specific animal nucleic acid samples
1.2 试剂与仪器
核酸释放剂(NR201)、ERA 基础型核酸扩增试剂盒(KS101)、侧向流试纸条(CRISPR,TS104)均购自苏州先达基因科技有限公司;EnGen®Lba Cas12a(Cpf1)购自美国New England Biolabs公司。
快速等温扩增仪Genie Ⅲ,英国OptiGene 公司;VeritiTM96 梯 度PCR 仪,美 国Applied Biosystems 公司;NanoVue Plus 超微量分光光度计,英国GE 公司;Invitrogen Qubit®2.0 荧光定量仪,赛默飞世尔科技(中国)有限公司;Life ViiATM7 实时荧光定量PCR仪,美国Applied Biosystems 公司;Illumina MiSeq 高通量测序仪,美国Illumina公司。
1.3 ERA引物和crRNA设计
选择犀牛12S 核糖体RNA 基因(12S ribosomal RNA,GenBank:MF066643.1)作为ERA 扩增靶基因[22]。首先,通过序列比对确定了一个283 bp(654~937 bp)的特定区域,并在该区域内寻找候选PAM 位点(TTTV,V=G or C or A),利用在线设计软件Cas-Designer(http://rgenome.net/cas-designer/)[23-24]设 计与PAM 位点匹配的crRNA。根据ERA 引物设计原则,使用Applied Biosystems 公司的Primer Express v3.0 在PAM 位点和crRNA 的上下游区域设计犀牛特异性ERA 引物。引物和crRNA 均由生工生物工程(上海)股份有限公司合成,序列见表2。
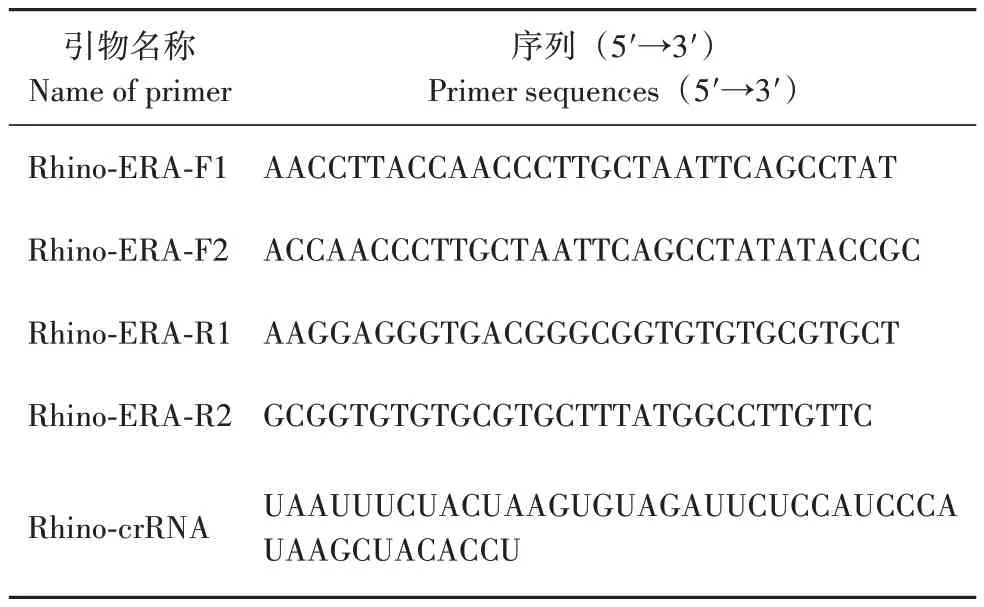
表2 ERA引物和crRNA序列Tab.2 ERA primers and crRNA sequences
1.4 ERA-CRISPR/Cas12a-LFD
采用基于ERA 技术的核酸扩增试剂盒(苏州先达基因科技有限公司)扩增靶基因片段。ERA 反应在50.0 µL的体系中进行,包括20.0 µL溶解剂,正、反向引物(10 µmol/L)各2.5 µL,2.0 µL DNA 模板,并用ddH2O补足48.0 µL混匀后,在反应管盖上加入2.0 µL激活剂(同步激活反应),小心关闭管盖,离心使激活剂进入预混液中,快速将反应管置于等温扩增仪中或腋下,孵育5 min。取2.0 µL ERA 扩增产物加入到CRISPR/Cas12a-LFD 检测反应体系。各组分含量:250.0 nmol/L Cpf1 1.0 µL,25.0 pmol/L ss-DNA(FAM-Biotin)探针1.0 µL,1.0 µmol/L crRNA 1.0 µL 和2.0 µL NEBufer 3.1(100 mmol/L NaCl,50.0 mmol/L Tris-HCl,10.0 mmol/L MgCl2,100.0 µg/mL BSA,pH7.5),总反应体系20.0 µL。在等温扩增仪(40 ℃)或腋下孵育15 min 后,在20.0 µL 的反应产物中加入80.0 µL 杂交检测分析缓冲液(先达)。在室温条件下,将侧向流试纸条直立插入反应液。当对照条带(C 条带,试纸条顶端)完全显色后,测试带(T 条带,试纸条底端)上的信号可以用肉眼观察并记录。
1.5 特异性检测
为评估检测方法的特异性,使用ERA-CRISPR/Cas12a-LFD对上海海关动植物与食品检验检疫技术中心实验室物种样本库中保存的18 种不同动物的特异性核酸(表1)进行检测。对1种犀牛组织中提取的核酸(印度犀)和4种人工合成的含有犀牛靶基因序列的质粒DNA进行5种犀牛通用性检测,以确保5种犀牛均可以检出。核酸样本浓度大于20.0 ng/µL,质粒样本大于1×106拷贝/孔。每组试验独立重复3次,以最终确认结果。
1.6 最低检测下限(LOD95%)测定
在本研究中,最低检测下限(LOD95%)定义为超过95%的重复检测样本产生阳性结果的最低DNA拷贝数。以5 个人工合成的含有犀牛靶基因的核酸样本为检测模板,用QX200 微滴式数字PCR(ddPCR)系统(Bio-Rad,Hercules,CA,USA)进行定量检测。反应体系:上、下游引物各1.8 µL(终浓度为900 nmol/L),0.5 µL 探针(终浓度为250 nmol/L),10.0 µL ddPCR Master Mix(Bio-Rad,Hercules,CA,USA),4.0 µL 模板DNA(人工合成犀牛靶基因)和1.9 µL 双蒸水(Thermo Scientific,Salt Lake City,UT,USA)。使用QX200 ddPCR 液滴发生器(Bio-Rad,Hercules,CA,USA)将反应混合物分成大约2×104个独立液滴。常规PCR 在伯乐T100™热循环仪(Bio-Rad,Hercules,CA,USA)中进行:95 ℃预变性10 min;94 ℃变性30 s,60 ℃退火1 min,98 ℃延伸10 min,40个循环。最后使用微滴分析仪对阳性液滴进行分析和计算,通过泊松分布分析确定样本DNA 的绝对拷贝数[25]。精确定量的核酸样本进行稀释,从每个反应1×104个拷贝数开始进行连续10倍稀释,最低拷贝数约为每个反应1拷贝。使用5个浓度梯度,每个稀释梯度做1 个反应,分别进行3 次独立的ERACRISPR/Cas12a-LFD 检测,同时设置阴性对照。完成后对数据进行统计分析。
1.7 环境条件变化的稳定性验证
与在分子生物学实验室应用的检测方法稳定的应用环境不同的是,本检测方法的应用场景可能更为复杂且影响因素也可能更多。需要考虑几个常见的影响因素,包括扩增设备、试剂用量(包括引物和扩增试剂),以及扩增条件(包括温度和时间)。为了确定这些因素对检测结果的不确定性变化或叠加影响,在标准检测体系中进行如下改变:将引物添加量由标准的2.50 µL增加到2.75 µL或减少到2.25 µL;将溶解剂由20.0 µL增加到25.0 µL或减少到15.0 µL;将等温扩增温度由40 ℃增加到42 ℃或减少到38 ℃;在标准的5 min 扩增时间基础上,将扩增时间增加或减少1 min。考虑到实验在野外环境中应用时无法使用电加热设备,设计并测试了人体腋下温度叠加试剂添加量变化和扩增时间的变化对检测结果的影响程度。腋下温度使用水银体温计连续测量3 次记平均值(每次腋下放置3 min 稳定后读数)。
1.8 现场条件应用性测试
实验室检测和野外现场检测场景存在许多差异,因此应用该检测方法对实际样本进行全流程应用测试,以评估其现场适用性。检测使用的核酸样本均源于海关口岸截获的可疑动物角粉、血液、毛皮和药品等。为了制备适用于等温扩增反应的DNA,利用商业化试剂盒,从犀牛角粉等样品中提取DNA,即将20 mg 犀牛角粉或其他固体样品(约芝麻粒大小)加入200 µL 的DNA 释放剂NR201(苏州先达基因科技有限公司),混匀后在95 ℃水浴中震荡浸泡5 min。如果样本为液体(如组织液、血液等),则需取15 µL 加入1.5 mL 的离心管中,再加入150 µL 的核酸释放剂,振荡混匀,95 ℃水浴3 min,产物直接用于后续的ERA-CRISPR/Cas12a-LFD 检测。在4 个不同地点让4 位检测人员进行实际操作,以尽可能模拟真实应用场景。实验操作人员均未接受过系统分子生物学实验技术培训,实验操作地点在分子生物学实验室外,并未刻意提前清洁操作环境。此外,对盲样、操作说明和试剂耗材进行打包分发。实验结束时,操作人员使用智能手机拍照并独立填写实验报告,及时反馈实验结果。
1.9 统计和再现性
由至少3 个独立实验产生的结果取均值,使用GraphPad Prism 7.0进行统计分析和绘图。
2 结果
2.1 犀牛特异性ERA引物和crRNA设计验证
使用在线生物信息学分析软件(http://blast.ncbi.nlm.nih.gov/Blast.cgi)对5 种现生犀牛和其他哺乳动物的核酸序列进行比对分析,选择以犀牛线粒体12S核糖体RNA 基因作为检测靶点设计犀牛特异性ERA引物和crRNA(图1)。
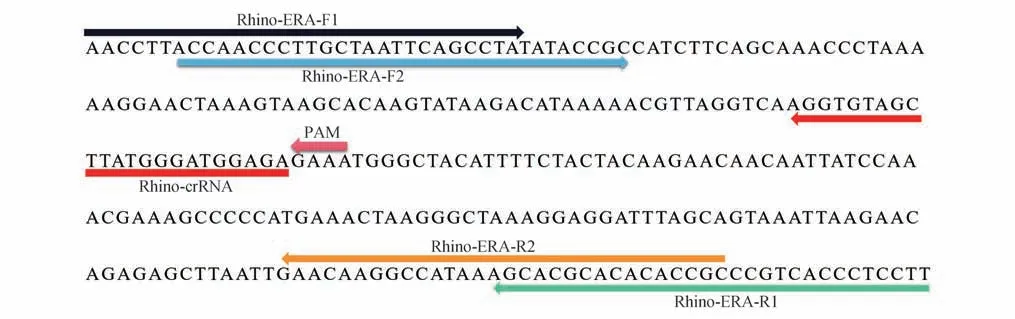
图1 犀牛特异性ERA引物和crRNAFig.1 Rhinoceros-specific ERA primers and crRNA
由于CRISPR/Cas12a 检测信号的强弱依赖于crRNA 引导的靶向切割效率,这可能会受到crRNA二级结构和匹配序列的影响[26]。序列比对分析显示,ERA 引物和crRNA 的靶向区域在5 种犀牛中高度保守(表3),存在少量突变位点(表3 中红色字体)。
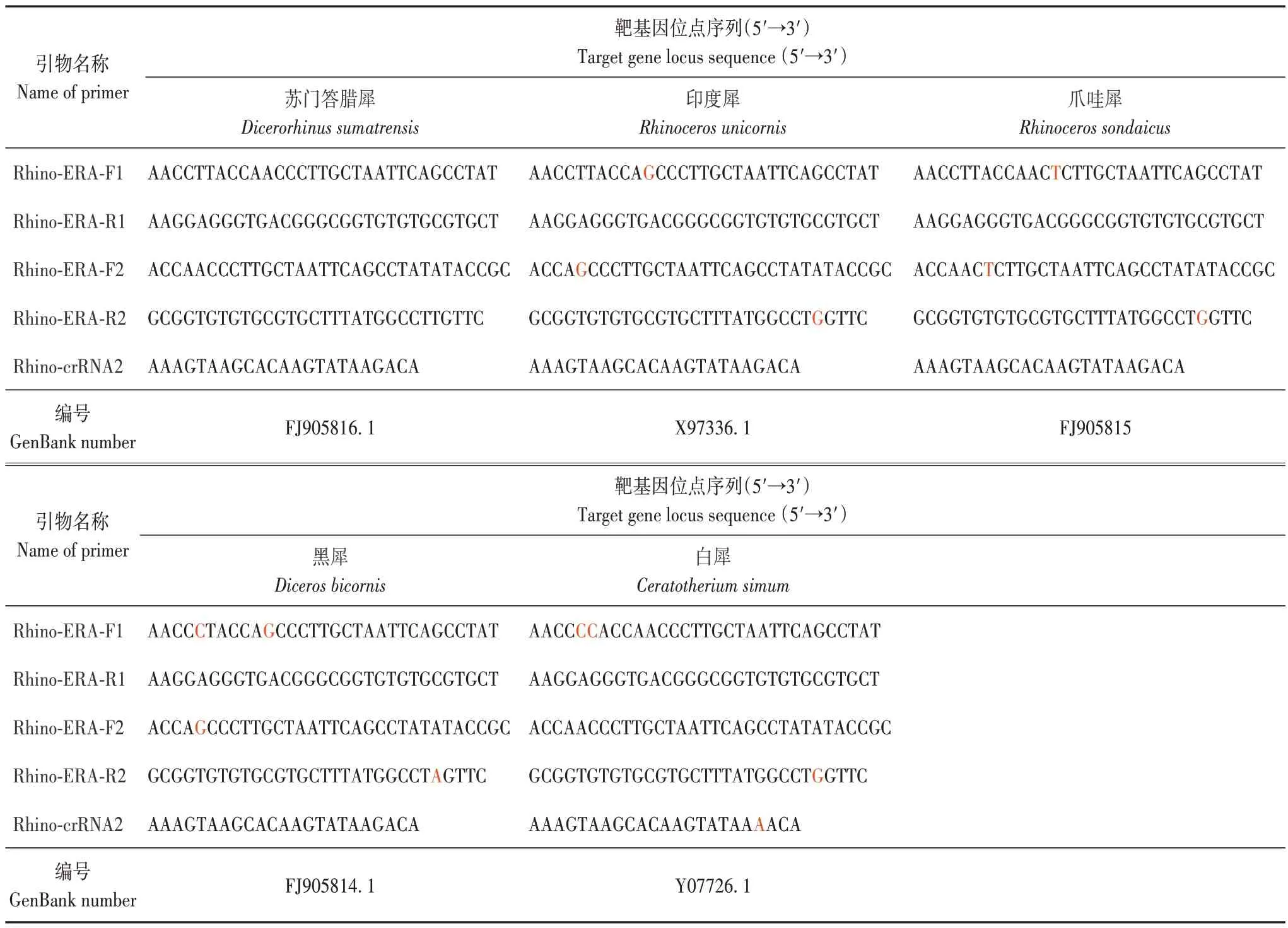
表3 犀牛特异性ERA引物和crRNA突变位点Tab.3 Rhinoceros-specific ERA primers and crRNA mutant loci
2.2 特异性检测
特异性验证使用5 种现生犀牛特有的核酸样本和其他13 种哺乳动物核酸样本(表1)进行ERACRISPR/Cas12a-LFD 检测。结果显示,本研究设计使用的犀牛特异性检测方法针对5 种现生犀牛核酸样本均出现了检测带而没有出现控制带或控制带显示微弱的情况;其他13 种哺乳动物核酸样品均没有出现检测带而只出现了控制带(图2)。在每次测试中,样品都加入基本相同量的模板DNA,每个反应孔中加入大约1 000个拷贝的DNA,所有特异性和非特异性样品都产生了预期的条带信号。结果说明本研究所设计、优化和建立的特异性ERA-CRISPR/Cas12a-LFD 检测方法可以准确识别5 种现生犀牛成分。

图2 ERA-CRISPR/Cas12q-LFD特异性检测Fig.2 ERA-CRISPR/Cas12q-LFD specificity assay
2.3 最低检测下限(LOD95%)测定
利用数字PCR技术和预先添加的标签基因对人工合成的5 种犀牛质粒进行核酸拷贝数的绝对定量检测。经过换算和稀释,绝对拷贝数从1.00×104拷贝/孔到1 拷贝/孔,共5 个浓度。采用该检测方法对这5个浓度核酸样本的检测结果显示(图3),在10拷贝/孔的浓度水平,除了苏门答腊犀和印度犀检出阳性条带,其他3 种犀牛核酸在这一浓度水平上均无法稳定检出。在100 拷贝/孔的浓度水平,5 种犀牛核酸都可以稳定检出阳性条带。这些结果说明,该检测方法在100拷贝/孔浓度水平可以做到全部阳性样本的稳定检出。因此,该检测方法的最低检测限(LOD95%)是10拷贝/孔。
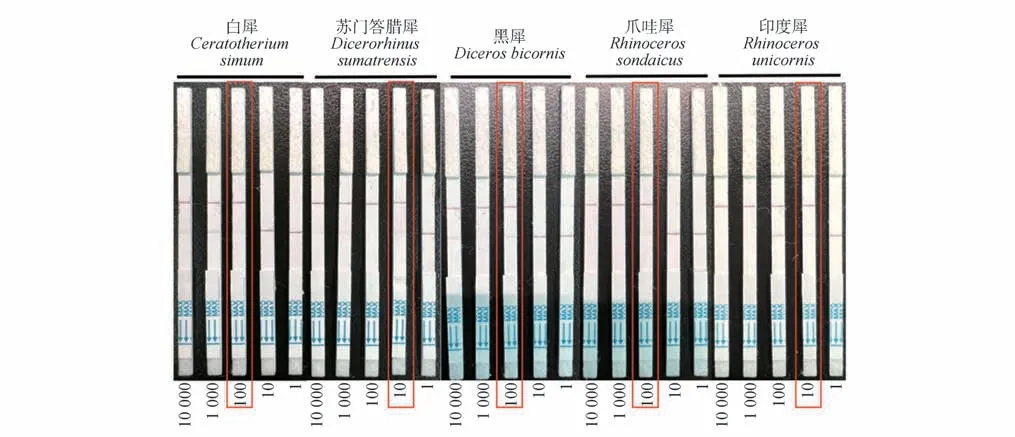
图3 最低检测下限检测结果Fig.3 Lowest detection limit test results
2.4 稳定性验证结果
将引物和扩增试剂的添加量在标准值的基础上进行适当增减,并将扩增温度增加或减少2 ℃。8组实验的检测结果均为阳性(表4)。结果表明,即使在野外环境、实验操作中出现一定范围内的变化,导致实验体系中一些试剂添加量出现增减或者温度出现一定变化的情况下,该检测方法仍能够完成犀牛特异性核酸检测。验证实验说明该检测技术具有较好的稳定性。

表4 不同影响因素对检测结果的影响Tab.4 Effect of different influencing factors on the test results
2.5 现场应用性测试结果
为了进一步缩短现场检测时间,使用商业化的一步法DNA 快速释放剂代替传统的DNA 提取步骤,使该方法更适合在现场应用,在30 min的测试期间,4 名操作人员在4个不同地点进行了独立检测,结果一致,盲样的检测结果均正确。阳性信号的确认时间集中在27~30 min(表5),没有出现超时。这些实验结果初步证明了犀牛特异性ERA-CRISPR/Cas12a-LFD检测方法可以成功地应用于野外环境中动物样本现场检测。

表5 犀牛特异性ERA-CRISPR/Cas12a-LFD现场应用检测结果Tab.5 Rhinocerose-specific ERA-CRISPR/Cas12a-LFD field application test results
3 讨论
本研究的目标是为了解决野生动物资源保护工作中野生动物物种的现场鉴定技术问题。传统的分子生物学鉴定技术,特别是常用的实时荧光定量PCR(qPCR)技术[8],虽然具有高特异性和高灵敏度,但对现场应用存在一定的限制,需要专业技术人员、高水平的实验环境和复杂精密的检测仪器[27]。因此,提出了基于ERA-CRISPR/Cas12a-LFD 技术的检测方法以实现对犀牛源性成分的现场鉴定。
本研究建立、优化和验证的物种特异性ERACRISPR/Cas12a-LFD 检测方法具备现场应用所需的多项关键要素,突破了依赖传统分子生物学实验室的技术限制。与传统的分子生物学鉴定技术相比,该检测方法具有多项技术优势。最突出的是对模板DNA 数量的低要求,利用CRISPR 技术的非特异性剪切活性,只需少量的模板DNA 来触发反应并释放信号完成识别。该方法对模板DNA 的低要求使得不需要精密变温仪器的等温扩增技术得以顺利应用。较高的特异性也是该技术的优势,扩增阶段ERA 引物可以在反应初始就对样本进行一次特异性筛选扩增,识别阶段引入的特异性crRNA 序列不但特异性识别扩增产物上特异性靶序列,还对与其匹配的PAM 位点进行识别。这就从多个角度提供了靶基因特异性识别的多重限制,是其他检测方法不具备的。读取信号阶段,利用LFD 技术可以在非实验室环境中快速完成特异性信号的识别。这些新技术的创新性结合使用为现场物种鉴定提供了有力的支持,并为相关领域的研究提供了新的思路和方法。
在实际应用中,野生动物资源走私是海关日常工作中面临的一个重要问题,特别是与濒危野生动物有关的产品的物种鉴定,是工作中一个较大的难点。海关的分子生物学鉴定实验室通常位于远离海关监管的一线港口和查验点。采样、送样和检测全流程周期较长,直接影响人货通关效率。犀牛角及其制品的走私是其中一个具有典型代表的问题。针对这一问题,快速、准确、灵敏的物种识别技术至关重要。本研究建立的犀牛特异性ERA-CRISPR/Cas12a-LFD检测技术可以在实验室外完成犀牛源性成分的现场鉴定。与传统的实验室实时定量PCR相比,该技术不仅降低了成本,还通过简化检测过程降低了对实验条件的要求,展现了在野外物种鉴定方面的潜力。实验结果表明,在较低的实验环境下,5 个现生犀牛的核酸样本可以被准确地显示在试纸条上,其他哺乳动物没有阳性条带出现;非专业人员可以在非实验室环境中对样品的物种信息进行准确鉴定;全流程检测时间是传统实验室检测鉴定技术所需时间的1/4,这还不包括样本从口岸查验点流转到实验室的时间。
综上所述,本研究成功建立了基于ERACRISPR/Cas12a-LFD 的犀牛特异性现场检测技术,并证明其在非实验室环境中快速灵敏地识别犀牛成分的能力。该技术具备实时检测所需的关键要素,并在现场验证实验中展示了良好的效果;具有广泛应用的潜力,可以应用于海关缉私、生态环境监测、生物多样性监测和生物遗传材料的现场筛选等领域,实现高速、高灵敏度和高精度的犀牛物种遗传信息识别。
