脲类细胞分裂素诱导尾叶桉愈伤组织分化过程中活性及基因表达变化1)
2023-11-24李丽纯许漫琪黄惠紫陈裕婷李观玲黄真池
李丽纯 许漫琪 黄惠紫 陈裕婷 李观玲 黄真池
(岭南师范学院,湛江,524048)
桉树(Eucalyptus)因生长速度快、抗性强,经济效益好,已成为我国南方造林的战略性树种,种植面积高达546万hm2[1]。桉树多用于造纸木浆原料、建筑和林副产品生产等方面,对我国推动经济发展和生态监测等具有突出作用[2]。桉树产业的可持续发展迫切需要解决改良材质、提升木材蓄积量、增强病虫害抗性等诸多难题。转基因育种是解决这些难题的有效途径之一,但其受愈伤组织易褐化、不定芽难分化及转化率低等因素制约[3]。探讨桉树再生与分化的机理,寻找合适的培养条件,突破育种技术瓶颈可加快优良种质的选育过程。
高效再生体系的建立是转基因育种的前提。细胞分裂素(CTK)在干细胞分裂分化、不定芽形成、维管组织发育等方面起着关键的作用[4]。根据化学结构差异,CTK有嘌呤类和脲类细胞分裂素(UCTK)两大类[5]。嘌呤类CTK有6-苄氨基嘌呤、激动素、玉米素等。UCTK有N-苯基-N-噻唑基脲(PBU),氯吡苯脲(CPPU)和苯基噻二唑脲(TDZ)等。
UCTK是新型植物生长调节剂。CPPU可促进植物细胞分裂和增大,可促进植物细胞分化形成愈伤组织及不定芽[6]。TDZ具有较强的细胞分裂素活性,诱导桉树细胞分裂分化效果较好[7]。PBU可通过抑制尾叶桉愈伤组织分化初期rboh1基因的转录,减轻褐变、促进不定芽分化[8]。PBU有减轻桉树愈伤组织褐化,促进不定芽分化的独特效果[9-10]。PBU影响愈伤组织超氧化物歧化酶(SOD)、过氧化物酶(POD)等活性氧(ROS)代谢相关基因的表达,调节酶活性,维持ROS平衡,减轻褐变、促进分化[11-12]。
ROS代谢与植物细胞分裂、分化及生理变化等有重要关系。外植体在切伤刺激和离体培养时使得ROS过度积累,ROS代谢失衡对植物细胞膜系统等细胞结构造成氧化损伤,导致生物大分子功能紊乱或丧失,是引起外植体褐化的重要因素之一[13]。为确保氧自由基在各种环境均被有效清除,SOD作为植物抗氧化系统的第一道防线,能与POD、过氧化氢酶(CAT)协同运作将有害的超氧自由基转化成完全无害的水和分子氧,以维持ROS代谢平衡[14]。
目前,有关UCTK抑制褐化促进分化作用机理的报道较少,不同种类的UCTK有无相互作用尚不明确。实验研究UCTK诱导尾叶桉愈伤分化过程中SOD活性、ROS水平及SOD基因表达的变化,探讨UCTK间的相互作用,为桉树高效再生体系的建立积累资料。
1 材料与方法
本研究采用国家林草局速生树木所提供的尾叶桉U6(Eucalyptusurophylla)种子。
无菌苗培养:将尾叶桉种子置于蒸馏水浸泡2 h,再用体积分数0.2% Triton-100浸泡25 min,用蒸馏水除去表面油渍后于超净工作台中进行消毒。先用无菌水漂洗5次后用体积分数70%的乙醇消毒30 s,用无菌水漂洗2次以清除残留乙醇。接着用体积分数10%的NaClO溶液消毒7 min,用无菌水漂洗3次,再用体积分数10%的NaClO溶液消毒7 min,最后用无菌水漂洗7次。将种子播种到大量元素减半的0.5倍浓度的MS培养基,置于25 ℃暗处萌发。
愈伤组织诱导:取8 d苗龄的无菌健壮幼苗,置于20 μmol·m-2·s-1光下处理1 d,切取8 mm长的下胚轴茎段作为外植体,等量接种于含0.57 μmol/L 6-BA+0.57 μmol/L IAA,添加不同类型细胞分裂素的SPCa培养基中(PBU+CPPU组合为2 μmol/LPBU+2 μmol/LCPPU;PBU+TDZ组合为2 μmol/L PBU+2 μmol/L TDZ;CPPU+TDZ组合为2 μmol/L CPPU+2 μmol/L TDZ;PBU组合为4 μmol/L PBU;CPPU组合为4 μmol/L CPPU;TDZ组合为4 μmol/L TDZ)。外植体经暗处理2周后,置于16 h光/8 h暗、光合有效辐射50 μmol·m-2·s-1、温度(25±2)℃的人工气候培养箱培养10周,每2周统计愈伤组织的生长情况。
酶液提取、蛋白质质量分数测定及SOD活性检测:以6周龄愈伤组织为材料,称取0.1 g材料,加100 mg交联聚乙烯吡咯烷酮(PVPP),1 mL酶提取液(50 mmol/L pH为7.0 Tris-HCl缓冲液,1 mmol/L EDTA,5 mmol/L MgCl2,1 mmol/Lβ-巯基乙醇),冰浴匀浆后4 ℃,8 000 r/min离心10 min,所得上清即为酶提取液。用考马斯亮蓝法[15]测定酶液蛋白质质量分数;采用四氮唑蓝(NBT)光化还原法[16]测定SOD活性,在560 nm下测定试验组的吸光度,反应被抑制50%所需酶量为1个酶活力单位(U)。所有测定3个生物学重复。
超氧阴离子清除速率和过氧化氢质量摩尔浓度检测:以6周龄愈伤组织为材料,按南京建成抑制与产生超氧阴离子自由基检测试剂盒说明书检测超氧阴离子清除速率,用二甲酚橙法[9]检测过氧化氢质量摩尔浓度。所有测定3个生物学重复。
基因选择及引物设计:检索NCBI数据库(https://www.ncbi.nlm.nih.gov)找到已知的桉树SOD基因,将能以尾叶桉愈伤组织cDNA作模板有效扩增的6个SOD基因编号为SOD1至SOD6,选择RTEF为内参基因[17]。将基因的CDS序列输入Primer3Plus软件设计qPCR引物。内参基因RTEF和6个SOD基因的编号和引物序列见表1。

表1 内参基因和SOD基因编号、对应酶类型、qPCR引物序列
总RNA提取、反转录及qPCR扩增:称取30~50 mg材料(每种样品重复3次),根据Fruit-mateTMfor RNA Purification试剂盒(TaKaRa)说明书配合使用RNAiso Plus的方法提取总RNA,再用Nanodrop 2000c检测总RNA的质量和浓度。按照PrimeScriptTMRT reagent Kit with gDNA Eraser说明书完成反转录得到cDNA。qPCR反应体系为25 μL(SYBR Premix TaqTMⅡ 12.5 μL,10 μmol/L Primer F和Primer R各1 μL,ddH2O 8.5 μL,cDNA模板2 μL);扩增仪器为CFX-96Touch(Bio-Rad);扩增程序:94 ℃,10 s;55 ℃,10 s;72 ℃,15 s。采用相对定量的Pfaffl法[18],计算各基因用不同类型细胞分裂素处理后的相对表达值。
2 结果与分析
2.1 不同激素组合处理对愈伤组织分化的影响
切取8 mm长的无菌幼苗下胚轴茎段,等量接种在添加不同激素组合的SPCa愈伤诱导培养基中。培养8周后,尾叶桉愈伤组织分化形成白色、红色和绿色愈伤组织(图1A、B、C)等类型,部分愈伤组织褐化、细胞坏死。白色愈伤组织表面较为光滑、细胞团质地疏松;红色愈伤组织细胞团质地稍致密、呈粉红色至红色;绿色愈伤组织表面有光泽、细胞团质地致密,呈浅绿色至深绿色。后续培养中绿色愈伤组织可分化形成绿色芽点(图1D),芽点逐渐长成不定芽(图1E)。两两组合脲类CTK诱导出的再生型愈伤组织比例均高于49.27%,显著高于单种脲类CTK的不到29%。PBU+CPPU和CPPU+TDZ组合褐化率明显低于其他组合,分别为8.92%、10.22%(表2)。CPPU+TDZ处理2周后,愈伤组织转绿速度较其他组合快。6周时PBU+TDZ组合的愈伤组织转绿速度加快,逐渐接近其他组合。10周时PBU+CPPU组合的愈伤组织转绿效果最佳,且褐化率显著低于其他组合。推测不同UCTK组合使用时有协同作用,可显著降低褐化率,促进再生型愈伤组织分化。

A.白色愈伤;B.红色愈伤;C.绿色愈伤;D.带芽点的绿色愈伤组织;E.不定芽(图中标线长5 mm)。
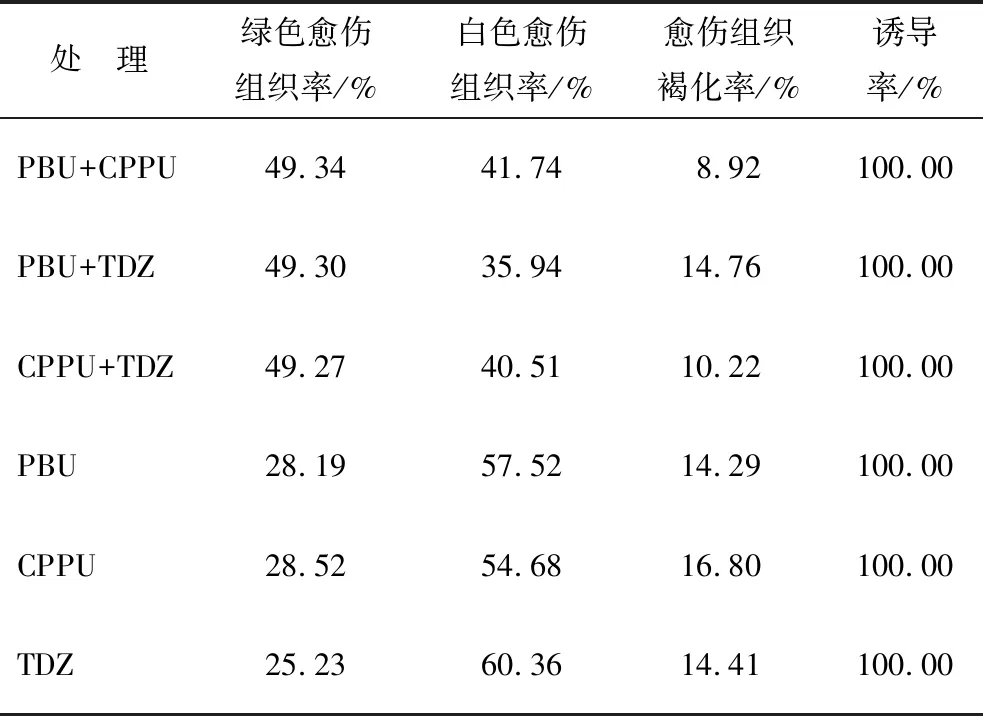
表2 不同激素组合诱导8周后尾叶桉愈伤组织的生长情况
2.2 不同激素组合诱导形成的愈伤组织SOD活性及ROS水平
长期观察发现,外植体接种后的4~6周是愈伤组织分化形成不同类型愈伤组织的关键期,6周后部分愈伤组织开始褐变。检测不同激素组合诱导所得的6周龄愈伤组织的SOD活性及ROS水平(表3),PBU处理组SOD活性显著高于其他处理组。
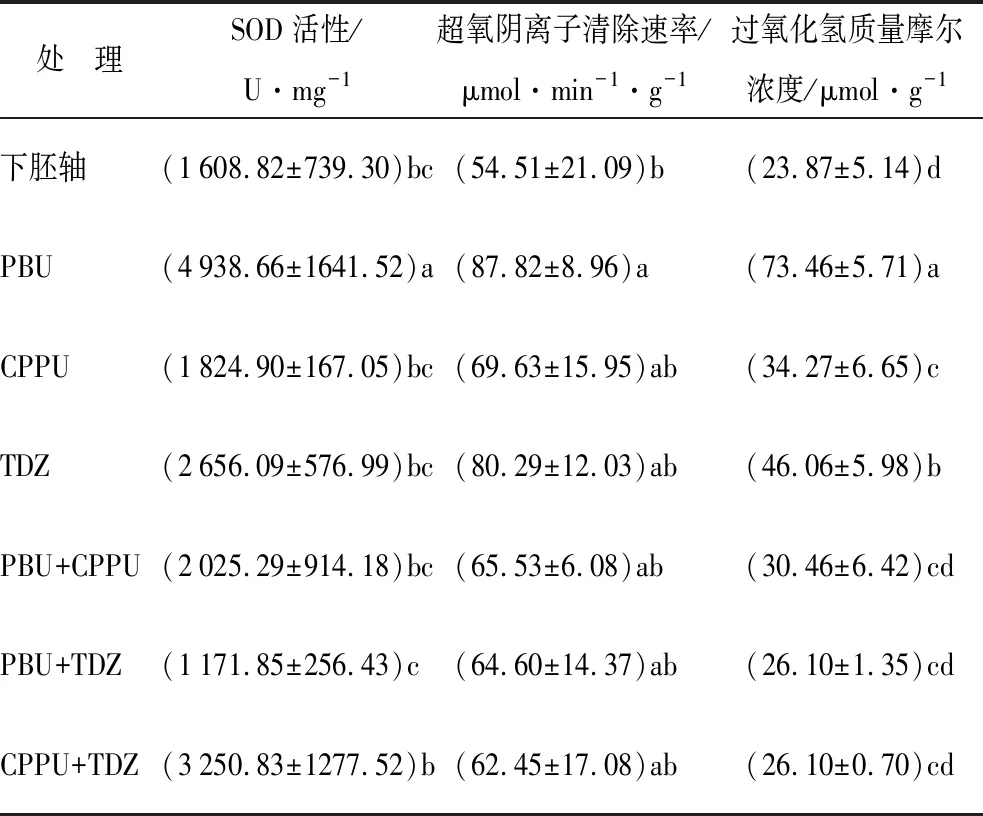
表3 不同激素组合处理6周后诱导所得尾叶桉愈伤组织SOD活性及ROS水平
从第6周开始,愈伤组织向不同类型分化,推测分化方向与ROS水平有关。比较超氧阴离子清除速率和过氧化氢质量摩尔浓度(表3)。超氧阴离子清除速率由大到小表现为PBU、TDZ、CPPU、PBU+CPPU、PBU+TDZ、CPPU+TDZ、下胚轴。过氧化氢质量摩尔浓度由大到小表现为PBU、TDZ、CPPU、PBU+CPPU、PBU+TDZ、CPPU+TDZ、下胚轴。6种愈伤组织的超氧阴离子清除速率高低与过氧化氢质量摩尔浓度多少完全对应,即超氧阴离子清除速率越高,过氧化氢质量摩尔浓度越高。UCTK组合诱导所得愈伤组织过氧化氢质量摩尔浓度显著低于单种UCTK激素诱导的愈伤组织。PBU诱导所得愈伤组织SOD酶活性最高,超氧阴离子清除速率最高,其过氧化氢质量摩尔浓度也显著高于其他激素组合。
2.3 不同激素组合处理6周后SOD基因表达变化
以不同激素组合处理的6周龄尾叶桉愈伤组织为材料,比较各组合6个SOD基因的表达水平(表4)。设PBU诱导所得6周龄愈伤组织的相对表达量为1,PBU+TDZ和CPPU+TDZ组合诱导所得愈伤组织中6个SOD基因全部表达上调,PBU+CPPU组合仅SOD6表达下调。其中,PBU+CPPU诱导的愈伤组织中SOD2、SOD3、SOD4和SOD5表达显著增强;PBU+TDZ诱导的愈伤组织中6个SOD基因表达都显著增强;CPPU+TDZ诱导的愈伤组织中SOD1和SOD3表达显著增强。结果分析可知,不同脲类细胞分裂素对SOD同工酶的表达的影响不同,使得不同细胞部位活性氧的种类等出现差异,影响细胞分化。
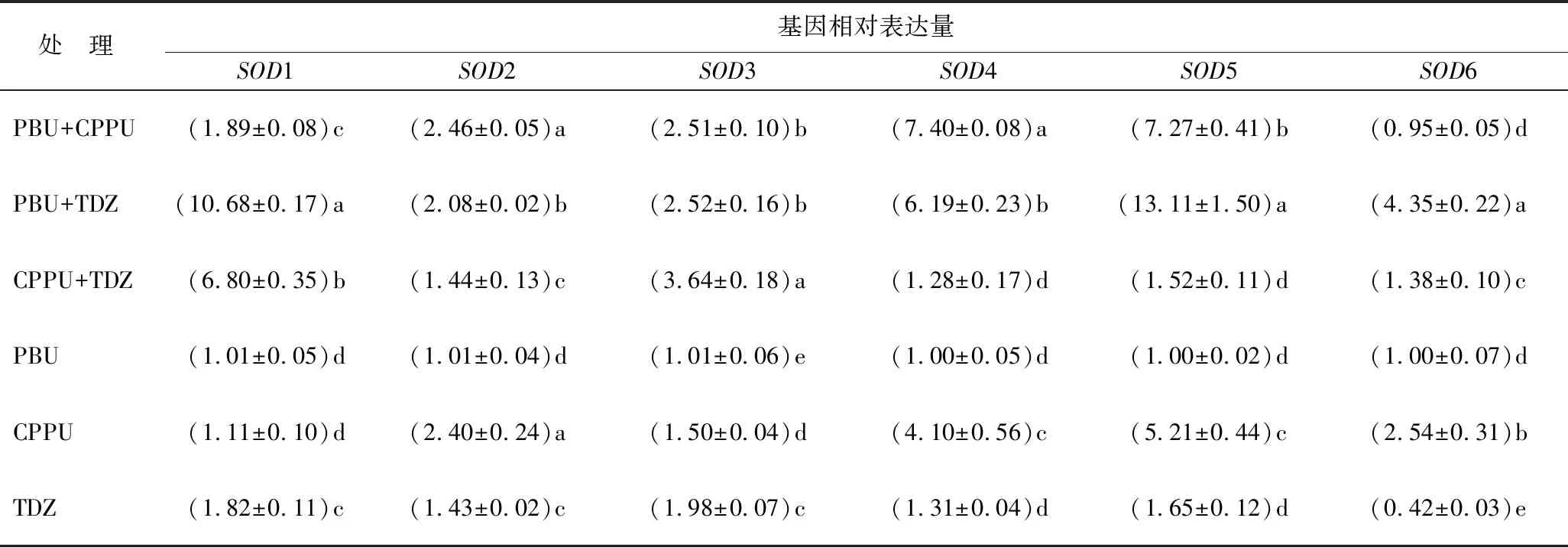
表4 不同激素组合处理6周后诱导所得绿色愈伤组织的6个SOD基因的表达水平
2.4 两两组合脲类CTK诱导愈伤组织SOD基因表达变化
2.4.1PBU+CPPU组合诱导愈伤组织SOD基因表达变化
不同激素组合中,PBU+CPPU组合的褐化率最低、再生型愈伤组织率最高,分别为8.92%和49.34%(表2)。检测PBU+CPPU组合诱导所得的愈伤组织2、4、6、10周时的6个SOD基因相对表达量的变化(表5)。
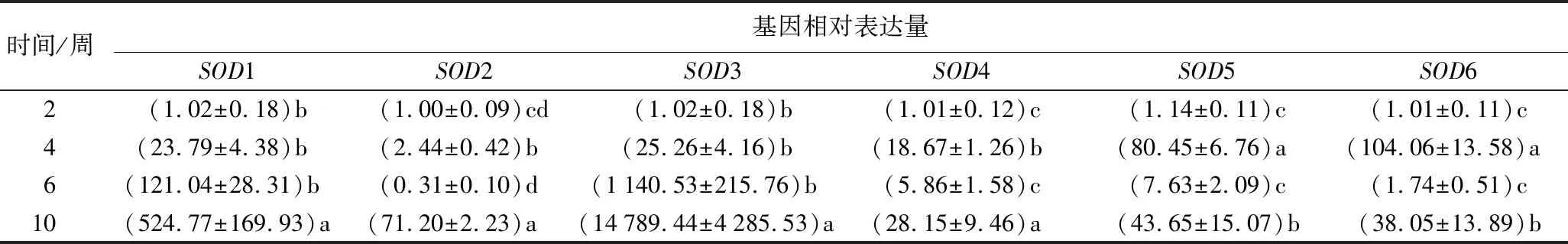
表5 PBU+CPPU诱导不同时间的尾叶桉愈伤组织SOD基因相对转录水平变化
SOD1、SOD2基因编码Mn-SOD,主要存在线粒体基质中。白色愈伤组织中SOD1基因转录呈上升趋势。10周龄的绿色愈伤组织中SOD1和SOD2的转录水平显著升高,分别为524.77和71.20。SOD3、SOD4基因编码Fe-SOD,主要存在叶绿体中。白色愈伤组织中SOD3基因转录呈上升趋势。10周龄的绿色愈伤组织中的SOD3和SOD4转录水平显著升高,分别为14 789.44和28.15。SOD5、SOD6基因编码Cu/Zn-SOD,SOD5基因主要存在叶绿体和细胞质基质中,SOD6基因定位尚未明确。SOD5、SOD6基因在4周龄白色愈伤组织中的转录水平最高,分别为80.45和104.06。推测SOD基因的表达调控与其类型、生理作用和细胞定位有关。
2.4.2PBU+TDZ组合诱导愈伤组织SOD基因表达变化
以PBU+CPPU组合诱导出的2周龄愈伤组织为对照,检测PBU+TDZ组合诱导所得的愈伤组织2、4、6、10周时的6个SOD基因相对转录水平的变化(表6)。发现SOD1、SOD2、SOD3、SOD4基因表达水平在2周后均下降,在4~6周期间逐渐升高,6周后SOD1、SOD2、SOD3、SOD4基因表达值则整体下降,且6周龄的白色愈伤组织中SOD1、SOD3基因的相对表达量为最高,分别为1 501.81和7 086.52,显著高于其他时间的愈伤组织。SOD5、SOD6基因在4周龄白色愈伤组织中的转录水平最高,分别为1 002.43和27.29。推测SOD基因表达变化与其生理作用和细胞定位有关。

表6 PBU+TDZ诱导不同时间的尾叶桉愈伤组织SOD基因相对表达变化
2.4.3CPPU+TDZ组合诱导愈伤组织SOD基因表达变化
以PBU+CPPU组合诱导出的2周龄愈伤组织为对照,比较CPPU+TDZ组合诱导所得的尾叶桉愈伤组织2、4、6、10周时的6个SOD基因的表达水平变化(表7)。SOD1、SOD2、SOD3、SOD4基因表达水平在2周后均下降,4周后检测愈伤组织中SOD1、SOD2、SOD3、SOD4的表达量,则均呈上升趋势。愈伤组织分化过程中仅SOD5随着愈伤组织的膨大相对表达量升高,在10周龄绿色愈伤组织中表达水平最高,为8.08。SOD6基因表达水平在6周龄愈伤组织中最低,其他时间无明显差异。

表7 CPPU+TDZ诱导不同时间的尾叶桉愈伤组织SOD基因相对表达变化
3 讨论与结论
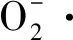
CTK有嘌呤类结构和脲类结构两大类[2,5]。常用的UCTK有PBU、CPPU和TDZ等。本研究中PBU、CPPU和TDZ都表现出抗褐变与促分化的作用。与单种UCTK处理相比,UCTK组合诱导的愈伤组织H2O2质量摩尔浓度降低,超氧阴离子清除速率下降,SOD活性则是PBU处理组最高、单种UCTK和UCTK组合间无明显规律(表3)。推测UCTK组合使用时有协同效应,通过影响愈伤组织ROS代谢,减轻褐化,诱导其向再生型愈伤组织的方向分化。
我们检测发现UCTK诱导后尾叶桉愈伤组织中定位于线粒体,属于Mn-SOD的SOD1、SOD2基因在绿色愈伤分化形成过程的转录水平显著升高,推测SOD1、SOD2基因的表达量升高对清除线粒体ROS有利,可维持植物的非光合组织的正常结构和生理功能,有利于再生型愈伤组织的分化。定位于叶绿体中的SOD3、SOD4和SOD5基因的转录水平在愈伤组织分化前期呈逐渐上升趋势,且UCTK组合诱导下明显上调。推测UCTK组合的协同效应诱导叶绿体SOD保持较高表达水平,促进叶绿体的发育和愈伤组织转绿。
分析UCTK组合诱导愈伤组织膨大和分化过程中SOD基因的表达变化,发现SOD1和SOD3基因的转录变化最为显著。CPPU+TDZ处理2周后,SOD1和SOD3的转录达最大值,分别为762.53和1 119.82;PBU+TDZ处理6周后,SOD1和SOD3的转录达最大值,分别为1 501.81和7 086.52;PBU+CPPU处理10周后,SOD1和SOD3的转录达最大值,分别为524.77和14 789.44。结合愈伤组织形态观察,UCTK组合诱导愈伤组织膨大和分化过程,发现CPPU+TDZ处理2周后,愈伤组织转绿速度较其他组合快。6周后,PBU+TDZ组合愈伤组织转绿速度加快,逐渐接近其他组合。10周时,PBU+CPPU组合愈伤组织转绿效果最佳,且褐化率显著低于其他组合。UCTK组合处理后,SOD1和SOD3的转录水平变化极为显著,且与愈伤组织转绿直接相关,说明其与愈伤组织分化密切相关。后续通过qPCR转录分析、同工酶电泳和活性氧定位分析有望进一步明确SOD1和SOD3在愈伤组织分化和不定芽形成中的作用机理。Hothorn et al.[25]发现,脲类细胞分裂素TDZ虽然与嘌呤类细胞分裂素化学结构明显不同,但是可与嘌呤类细胞分裂素一样与细胞分裂素受体CRE1/AHK4建立非常相似的极性接触。CPPU和PBU如何与细胞分裂素受体结合,尚无报道。不同UCTK处理后,SOD1和SOD3的转录峰值在不同发育阶段出现,推测UCTK种类和浓度的不同所对应的信号转导途径并不完全相同,引起的细胞应答发育有明显差异。
总之,研究发现不同UCTK间存在协同效应,可诱导细胞定位不同的SOD基因在不同时期的高表达,从而影响SOD活性,调节ROS代谢,有效减轻褐变,促进再生型愈伤组织形成和不定芽分化。本研究可为深入探讨UCTK的作用机理和桉树SOD与愈伤分化的关系提供参考。
