欧前胡素抑制人肾癌786-O细胞增殖并促进其凋亡
2023-11-24景红梅樊海燕黄小勇慕明涛史海燕
景红梅,樊海燕,黄小勇,杜 娟,张 静,慕明涛,史海燕*
(1延安大学医学院医学研究实验中心,延安 716000;2延安市宝塔区人民医院儿科;3榆林市第一医院检验科;*通讯作者,E-mail:shihaiyan@yau.edu.cn)
肾细胞癌(renal cell carcinoma, RCC),又称为肾腺癌,起源于肾小管上皮,大约70%的肾癌是由透明细胞构成的[1]。肾癌分别占男性和女性所有成人恶性肿瘤的5%和3%,是男性第七大常见癌症,女性第十大常见癌症,是泌尿系统恶性肿瘤患者死亡的第二大原因[2]。在过去10年中,大多数国家的RCC发病率呈上升趋势,在我国平均年变化百分比达到了7.6%,其中约四分之一患者初诊时已有转移,而转移患者的5年生存率不足10%[3,4]。目前临床肾细胞癌的主要治疗方法包括根治性肾切除术或部分肾切除术及热消融技术,而对于发生转移的肾癌患者,疗效欠佳[5]。近年来有研究表明,我国传统药物在肿瘤防治方面具有独特的优势[6]。欧前胡素(imperatorin)是一种具有抗菌、抗炎、平喘及抗过敏等多种生物活性的呋喃香豆素,来源广泛,在一些中草药中含量丰富,主要用于散风除湿、消脓排肿[7,8]。有研究报道,欧前胡素抗肿瘤作用较显著,并且对改善肿瘤耐药有着积极的作用[9,10]。但目前,欧前胡素在肾癌中的研究报道较少见。
随着大数据时代的到来,网络药理学被广泛应用在中医药研究中。基于网络药理学的方法和整合策略,可以初步预测中药潜在靶点及其可能的作用机制[11]。本研究拟采用生物学实验与网络药理学方法相结合,从细胞分子水平初步探索欧前胡素治疗肾癌的作用机制。
1 材料与方法
1.1 材料
1.1.1 细胞系 人肾透明细胞腺癌细胞(786-O)购自北京北纳创联生物技术研究院,并保存于延安大学医学院医学实验研究中心。

1.2 方法
1.2.1 细胞培养 肾癌细胞786-O常规培养于含10%胎牛血清、100 U/ml青链霉素混合液的RPMI-1640培养基中。
1.2.2 CCK-8实验检测细胞增殖活力及药物IC50786-O细胞以每孔3×103细胞数接种于96孔板中,在37 ℃,5% CO2培养箱中培养,24 h后加入不同浓度的欧前胡素(0,20,40,60,80,100,120,140,160,180,200 μmol/L),同时设置空白组(仅含有溶剂、细胞培养液和试剂),分别培养24,48,72 h后每孔加入10 μl的CCK-8试剂,37 ℃,5% CO2避光培养1 h,使用酶标仪在450 nm处检测各处理组OD值,以0 μmol/L为对照组计算细胞存活率。细胞存活率%=[(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)]×100%。使用GraphPad Prism7分别计算作用24,48 h欧前胡素对786-O细胞的半数抑制浓度(half inhibitory concentration,IC50)。以log10[欧前胡素浓度(μmol/L)]为横坐标,细胞抑制率为纵坐标,绘制IC50曲线图。细胞抑制率(%)=100%-细胞存活率(%)。
1.2.3 细胞形态学观察 收集处于对数生长期的786-O细胞,用无血清培养基重悬,计数,以每孔1×104细胞数接种到12孔板中,37 ℃培养24 h后分别加入0,40,80 μmol/L欧前胡素,以0 μmol/L为对照组,继续培养24 h后,在明场条件下,使用倒置生物学显微镜放大100倍观察各组细胞形态变化,并拍照。
1.2.4 细胞克隆形成实验检测细胞增殖 收集处于对数生长期的786-O细胞,用无血清培养基重悬,计数,以每孔800个细胞数接种到12孔板中,37 ℃培养24 h后分别加入不同浓度欧前胡素(0,40,80 μmol/L),每2 d换液一次。2周后,用PBS洗涤,4%聚合甲醛固定细胞20 min,并用0.1%结晶紫染色15 min,PBS洗涤后拍照。加入二甲基亚砜处理细胞,并在570 nm处测量上清液的吸光度。
1.2.5 流式细胞术检测细胞凋亡 收集处于对数生长期的786-O细胞,用无血清培养基重悬,计数,以每孔1×104个细胞接种到12孔板中,37 ℃培养24 h后分别加入0,40,80 μmol/L欧前胡素,培养48 h后,用不含EDTA的胰酶消化细胞,收集细胞悬液,使用Annexin Ⅴ/PI双染色试剂盒进行染色,2 h内于流式细胞仪检测各组细胞凋亡情况。
1.2.6 实时荧光定量PCR分析Fas、Caspase-8、Caspase-3、Bcl-2 mRNA的表达 收集处于对数生长期的786-O细胞,用无血清培养基重悬,计数,以每孔1×104细胞数接种到12孔板中,37 ℃培养24 h后分别加入0,40,80 μmol/L欧前胡素,培养24 h后,Trizol法提取各组总RNA,按照Removal and cDNA Synthesis实验操作流程将RNA逆转录成cDNA,以该cDNA为模板,使用KAPA SYBR FAST Universal荧光定量试剂盒及Cobas z 480操作手册进行扩增检测,反应采用两步法,第一步:95 ℃,10 min,1个循环;第二步:95 ℃ 15 s,60 ℃ 1 min,40个循环,各组均设3个复孔,结果采用相对定量法2-ΔΔCt进行分析。各引物由西安奥科鼎盛生物公司合成,引物序列见表1。

表1 实验中所用到的引物序列
1.2.7 Western blot检测Fas、Caspase-8、Caspse3、Bcl-2的蛋白表达情况 用含有1%全蛋白酶抑制剂的裂解液冰上裂解细胞,提取上清,采用BCA法测定各组蛋白质浓度。分别取20 μg蛋白样品经SDS-PAGE电泳后转至PVDF膜,与特异性一抗(抗人Fas、Caspase-8、Caspase-3、Bcl-2,比例均为1∶1 000)孵育,4 ℃过夜。洗膜后与二抗室温孵育1 h,洗膜后与ECL化学发光剂作用,进行曝光和显影。GAPDH为内参蛋白,用Image J软件进行蛋白印记的定量分析。
1.2.8 欧前胡素相关靶点及药物-疾病共同靶点获取 利用中药系统药理学数据库与分析平台(TCMSP,http://tcmspw.com/tcmsp.php/)及中药高通量实验和参考数据库(HERB,Herb.ac.cn)收集欧前胡素主要作用靶点[12]。通过UniProt(https://www.uniprot.org/)数据库将靶点蛋白名称转化为相应的基因名称,并去除重复项。通过GeneCards数据库(https://www.genecards.org/),以“renal cell carcinoma”为关键词检索肾癌相关疾病靶点,并删除重复项。将肾癌疾病靶点与欧前胡素作用靶点取交集后,导入Bioinformatics &Evolutionary Genomics(http://bioinformatics.psb.ugent.be/Webtools/Venn/)系统,绘制韦恩图,获得欧前胡素治疗肾癌的潜在作用靶点。
1.2.9 蛋白相互作用网络构建 利用STRING数据库(https://stringdb.org/)将筛选得到的欧前胡素治疗肾癌的潜在作用靶点进行PPI网络构建。其中参数Organism选择“Homo sapiens”,“Minimum required interaction score”选择“Medium confidence(0.400)”,并隐藏网络中未连接的节点,其他参数保持默认数值,筛选PPI网络中的核心作用靶点。
1.3 统计学分析
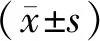
2 结果
2.1 欧前胡素作用786-O细胞的IC50
欧前胡素作用786-O细胞24 h和48 h的IC50分别为94.36 μmol/L和65.66 μmol/L(见图1)。

A.欧前胡素作用24 h B.欧前胡素作用48 h
2.2 欧前胡素对肾癌细胞形态的影响
欧前胡素对肾癌细胞作用24 h后,结果显示,随着药物浓度的增加,细胞体积变小、皱缩,形态由梭形变得细长,同时细胞密度减少(见图2)。

图2 倒置显微镜观察欧前胡素对786-O细胞形态学的影响 (×100)
2.3 欧前胡素可抑制肾癌细胞786-O的增殖
CCK-8实验结果显示,在同一时间点,随着欧前胡素浓度的增加,786-O细胞活力降低;在同一浓度作用下,随着时间的延长,786-O细胞活力降低,呈现浓度依赖性和时间依赖性(见图3A)。细胞克隆形成实验结果显示,与对照组相比,实验组786-O细胞的克隆形成能力降低,差异具有统计学意义(P<0.01,见图3B)。

图3 欧前胡素对786-O细胞增殖能力的影响
2.4 欧前胡素促进肾癌细胞786-O凋亡
流式细胞术检测细胞凋亡结果显示,与0 μmol/L组相比,40 μmol/L组和80 μmol/L组细胞凋亡率均升高(P<0.01);与40 μmol/L组相比,80 μmol/L组细胞凋亡率升高(P<0.01,见图4)。
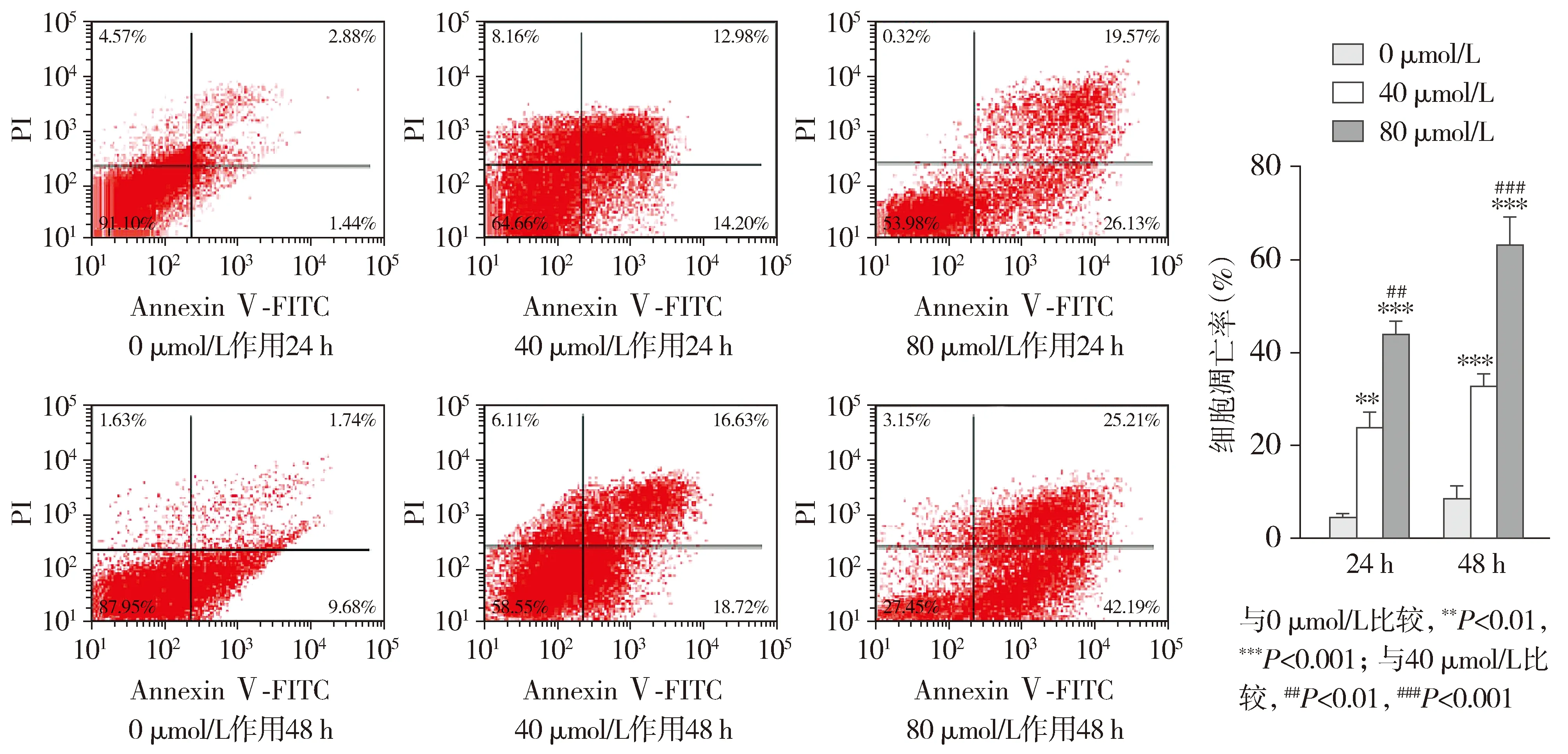
图4 欧前胡素对786-O细胞凋亡的影响
2.5 欧前胡素对肾癌细胞786-O凋亡相关分子mRNA表达水平的影响
RT-qPCR实验结果表明,与0 μmol/L组相比,40 μmol/L组和80 μmol/L组Fas、Caspase-8、Caspase-3在mRNA水平相对表达量均升高(P<0.01),而Bcl-2表达水平上无明显变化(见图5)。Western blot实验结果表明,与0 μmol/L组相比,40 μmol/L组和80 μmol/L组Fas、Caspase-8、Caspase-3在蛋白水平相对表达量均升高(P<0.05),而Bcl-2表达水平上无明显变化(P>0.05,见图6)。

与0 μmol/L组相比,**P<0.01,***P<0.001
与0 μmol/L组相比,*P<0.05,**P<0.01,***P<0.001
2.6 欧前胡素治疗肾癌靶点的获取
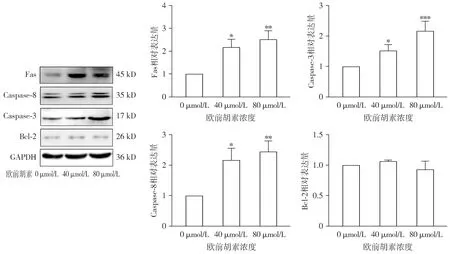
通过TCMSP数据库共检索欧前胡素(MOL001941)作用于8个靶点蛋白。HERB数据库中检索欧前胡素作用于15个靶点。整合2个数据库平台筛选得到的所有靶点,删除重复靶点,共获得欧前胡素17个靶点基因,结果见表2。利用GeneCards数据库获得肾癌的靶点2 406个。将欧前胡素作用靶点与肾癌疾病靶点通过韦恩图取交集,得到14个交集靶点,即为欧前胡素治疗肾癌的潜在作用靶点(见图7)。
图7 欧前胡素作用肾癌潜在靶点

表2 TCMSP及HERB获得欧前胡素靶点基因
2.7 欧前胡素治疗肾癌潜在作用靶点的PPI网络图及核心靶点筛选
将欧前胡素与肾癌的14个共同靶标导入STRING数据库,限定物种为“Homo sapiens”,并以置信度≥0.4进行筛选。PPI网络共有14个节点,35条边。该网络节点连接度的中位数是5,因此选择“Degree≥5”的节点作为候选靶点。共筛选出7个核心靶点,分别为GSK3β、CDK2、PPARG、ESR1、MAPK14、AR、PTGS2(见图8),提示其可能是欧前胡素治疗肾癌的关键靶点。
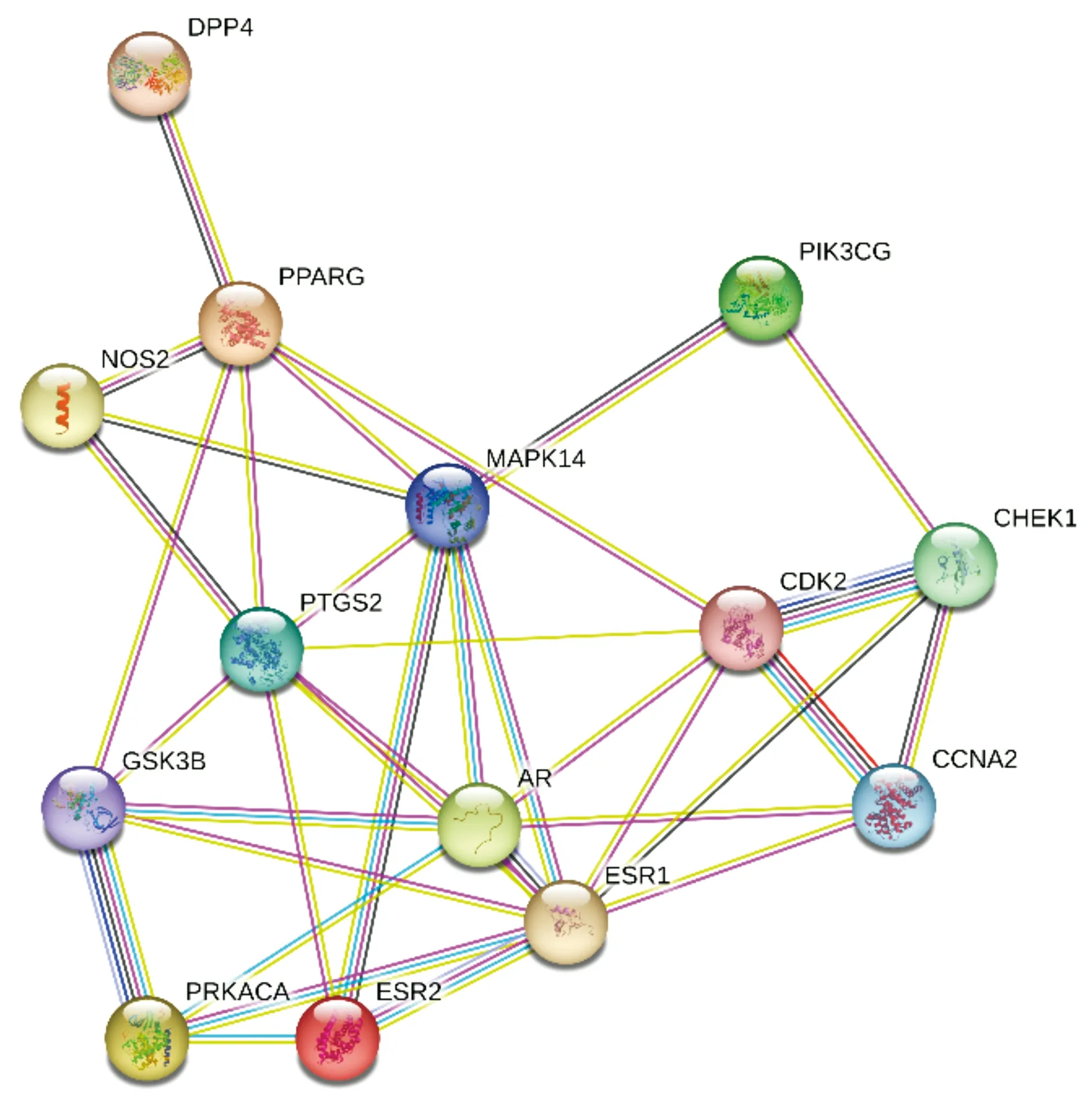
浅蓝色线条代表来源精选的数据库;粉色线条代表经实验确认;绿色代表相邻基因;红色线条代表融合基因;蓝色代表共生基因;浅黄色代表文本挖掘基因;黑色代表共表达基因;紫色代表同源性蛋白质
3 讨论
在治疗癌症中,中医药的使用日益广泛。大量研究表明,中医不仅能缓解癌症患者的症状(如疲劳、慢性疼痛、厌食/恶病质、失眠等),提高生活质量,还可以减少化疗、放疗或靶向治疗引起的不良反应和并发症,提高患者生存质量,而且相对于化疗药物,其具有不良反应小、费用低等优势[6]。中药白芷具有祛病除湿、消肿排脓、活血止痛等功能,其中含有大量欧前胡素[15],国内外多项研究表明欧前胡素在抗肿瘤方面具有巨大潜力,例如,欧前胡素可以逆转肝癌细胞对顺铂类药物的耐药性[16];在结肠癌中,欧前胡素可以通过抑制缺氧诱导因子HIF-1的活化,引起人结肠癌细胞周期的阻滞,进而抑制肿瘤细胞生长,并阻断肿瘤血管形成[17]。抑制肿瘤细胞增殖,诱导其凋亡一直是肿瘤治疗的一个重要思路[18]。本研究发现,不同浓度的欧前胡素干预后均能抑制肾癌细胞株786-O细胞的增殖,并呈浓度和时间依赖性。同时本研究发现,40 μmol/L和80 μmol/L的欧前胡素作用24 h后786-O细胞的凋亡率分别达到了27.18%和45.7%,说明欧前胡素可以诱导786-O细胞凋亡,这与Yi等[19]在结肠癌细胞中的研究结果一致。本研究的发现可为欧前胡素在肾癌中的应用提供一定的理论依据。
细胞凋亡主要有线粒体和死亡受体两条途径,死亡受体途径起始于外部凋亡信号,受跨膜受体的调节[20],Fas作为Ⅰ型跨膜糖蛋白,属于肿瘤坏死因子受体家族成员,具有信号传递功能,当与其配体FasL结合后,由死亡受体介导的细胞凋亡通路被激活[21],与Fas相关的死亡结构蛋白(FADD)通过死亡效应结构域与Caspase-8前体结合,形成死亡诱导信号复合物(death-inducing signaling complex,DISC),Caspase-8被激活,紧接着凋亡的效应因子Caspase-3被激活,触发凋亡执行[22]。本研究发现经欧前胡素作用后,786-O细胞中Fas、Caspase-8和Caspase-3表达均增强,而Bcl-2却没有明显变化。所以我们认为欧前胡素可能是通过Fas/Caspase-8/Caspase-3信号通路诱导786-O细胞凋亡。但有文献报道,由枳壳中提取的欧前胡素和柠檬苦素联合作用肝癌细胞和结肠癌细胞,可下调其抗凋亡基因Bcl-2,促进肝癌细胞和结肠癌细胞的凋亡[23]。这与本研究的结果不一致,猜测原因可能是欧前胡素的提取原材料不同,也有可能是在不同肿瘤细胞中欧前胡素通过不同凋亡途径发挥作用。
系统生物学的快速发展衍生出了网络药理学以及多种算法、工具、平台和软件[12]。这些基于网络药理学的方法在中医药相关研究中得到了广泛的应用。本研究利用TCMSP和HERB数据库收集欧前胡素作用靶点。通过GeneCards数据库获取肾癌相关靶点。筛选共同靶点后,使用STRING数据库构建蛋白互作网络,并筛选出欧前胡素治疗肾癌的7个核心靶点,分别是GSK3β、CDK2、PPARG、ESR1、MAPK14、AR、PTGS2。有文献报道,高剂量GSK3β抑制剂可通过上调Caspase-8、p38α和Fas-Daxx的表达,促进小鼠运动神经元-神经母细胞瘤杂合细胞(NSC-34)凋亡[14]。基于生物学实验、网络药理学结果及文献支持,得出以下结论,欧前胡素可能通过靶向GSK3β调控死亡受体途径,进而抑制肾癌细胞增殖,并促进其凋亡。
综上所述,本实验提示了欧前胡素具有诱导肾癌细胞凋亡的生物活性,为肾癌的治疗提供了新的途径和理论依据。然而,对于欧前胡素诱导调控肾癌凋亡的具体作用机制仍未完全阐明。未来研究中我们将会对欧前胡素抗癌的作用机制进行深入的探究。
