不同受体激动剂诱发大鼠去内皮尾动脉环的收缩反应
2023-11-24邓童甘璐李璐钟聪敏范建辉
邓童,甘璐,李璐,钟聪敏,范建辉
(1.河北大学附属医院麻醉科,河北 保定 071000;2.河北大学临床医学院,河北 保定 071000;3.保定市第一医院老年医学科,河北 保定 071000;4.保定市满城区第四医院麻醉科,河北 保定 072150)
高血压是全球性的公共卫生问题,2018年中国高血压患病率已达到27.5%,高血压所导致的心血管疾病已成为中国人口死亡的首要原因[1]。由于其发病的多因性及复杂性,尤其是难治性高血压和青少年高血压的发病机制尚未完全阐明[2],所以进一步探讨血管张力及调节机制仍有指导意义。嘌呤能受体与肾上腺素能受体在心血管系统广泛表达,具有调节心脏功能、血管张力、血管生成和炎症等作用[3]。分布在血管的嘌呤受体有P1 和P2受体的多种亚型。P1受体四种亚型中A1R和 A3R 介导血管收缩,A2AR 和 A2BR 介导血管舒张[4]。P2受体对血管张力调节与其所在位置有关:分布在内皮细胞上的 P2 受体(P2Y1R、P2Y2R、P2Y4R 和 P2Y11R)介导血管舒张,而平滑肌细胞上的 P2 受体(P2X1R、P2X2R、P2X4R)介导血管收缩[5],其中P2X1受体是介导嘌呤能信号诱发动脉平滑肌收缩反应的重要靶点[6]。
尿苷腺苷四磷酸盐(uridine adenosine tetraphosphate,Up4A)作为一种由内皮细胞释放的、同时含有嘌呤和嘧啶部分的内皮源性血管收缩因子,主要通过作用于嘌呤能受体发挥生物学效应[7]。青少年高血压患者血浆Up4A浓度升高,并且与血压呈正相关。外源性Up4A可诱发高血压大鼠肾动脉、股动脉和基底动脉血管收缩增强,但Up4A对无预收缩的猪冠状动脉无收缩作用[8]。文献证实,外周阻力血管的重塑在高血压的发生发展中起到了关键作用,外周阻力动脉的变化高度预测高血压进展程度[9];大鼠尾动脉作为主要的外周阻力血管,其P2X1受体密度明显高于其他血管组织[6]。研究[8]指出,Up4A可以同时作用于动脉血管的内皮细胞和平滑肌细胞,介导血管的舒张和收缩,因此,为排除血管内皮细胞对血管张力的影响,选用去内皮大鼠尾动脉血管环测定去甲肾上腺素(noradrenaline,NA)、Up4A和α,β-亚甲基ATP(α,β-MeATP)三种受体激动剂诱发的收缩反应,比较不同受体激动剂对外周阻力血管张力的调节,为进一步分析血管嘌呤受体在高血压病中的相关研究提供基础实验依据。
1 材料与方法
1.1 实验动物
选择清洁级 Wistar大鼠12只,8周龄,体质量300~350 g。购置于北京维通利华实验动物技术有限公司,动物生产许可证[SCXK(京)2021-0006]。大鼠购入后,在 (22 ± 3)℃,相对湿度 45%~60%的 SPF级动物房环境下进行分笼饲养,每日提供足够食物,自由饮水。适应性饲养一周,排除有潜在疾病的大鼠。
1.2 药品与试剂
乌拉坦、NA、α,β-MeATP和乙酰胆碱(ACh)购于德国Sigma-Aldrich公司;Up4A购于美国Biolog Life Science Institute 公司;氯化钾(KCl)购于天津市永大化学试剂开发中心;Krebs-Ringer缓冲液购于北京雷根生物技术有限公司。
1.3 仪器与设备
数字酸度计 (型号pHS-3C,杭州东星仪器设备厂);ERT-884 四道生理记录仪、张力换能器(河南开封友林电子有限公司);电子分析天平(型号FA2004,上海良平仪器仪表有限公司);压力换能器(型号MLT0380/D,ADInstruments Pty Ltd)。
1.4 离体动脉环的制备
采用25%乌拉坦1.5 g/kg对大鼠进行腹腔注射麻醉,股动脉放血处死,纵向切开大鼠尾部腹侧皮肤显露尾动脉两侧筋膜,沿尾骨动脉沟纵向切开两侧的筋膜,用镊子轻柔挑起远心端处尾动脉,剪取尾动脉近心端1/3部位的标本。使用当日配制的K-H营养液,营养液 pH值经盐酸调节至7.2~7.4。每个标本取出后,均放入以95%O2和5%CO2混合气体预先饱和的4 ℃ K-H溶液中,并仔细去除标本周围结缔组织,在血管内腔中插入表面粗糙的聚乙烯管(外径略小于血管内径),小心摩擦以去除内皮,并截取3~4 mm动脉血管环。两根钨丝环分别从血管的管腔中平行穿入,标本置于K-H液中。通过钨丝环将动脉环的一侧固定在浴槽的下端,另一侧与张力换能器连接;张力换能器传输信号,ERT-884四道生理记录仪记录其收缩产生的机械能。施于0.75 g静息张力,持续通以95% O2和5% CO2的混合气体,在K-H液 (37 ± 0.5)℃ 中平衡1 h。平衡期间,营养液每15 分钟更换一次。
1.5 标本内皮完整性和血管收缩反应性检测
平衡1 h后,各动脉血管环加入EC50浓度的NA,使其产生预收缩,待张力稳定后,再加入1 μmol/L ACh,以ACh不产生任何舒张反应作为完全去除内皮的指标来检验内皮的完整性。对血管内皮完全去除的标本,反复冲洗并休息30 min后,逐一建立NA(0.001、0.003、0.01、0.03、0.1、0.3、1、3、10、30、100 μmol/L)累积给药的收缩反应曲线,以检查标本的收缩反应性。再反复冲洗并休息1 h后将血管环随机分为三组,分别进行NA、α,β-MeATP和Up4A三种药物诱发的收缩实验。
NA组仍采用累积给药的方式,测定 NA (0.001、0.003、0.01、0.03、0.1、0.3、1、3、10、30、100 μmol/L)的第二轮收缩反应曲线,观察 α1受体介导的血管收缩反应。
α,β-MeATP组和Up4A组采用单个标本单个浓度的间断给药方法,以防止受体脱敏现象对收缩反应的影响。α,β-MeATP组和Up4A组均采用0.1、1.0、10 μmol/L三个浓度,以单个标本单个浓度间断给药的方法加入浴槽,测定药物诱发的最大收缩反应,将每个浓度α,β-MeATP和Up4A诱发的最大收缩反应建立浓度-反应量效曲线。每个浓度给药间隔都需要立即冲洗标本,使药物充分洗脱。
各血管标本在结束上述反应后,反复冲洗并休息30 min,使血管张力恢复到基础水平,再建立KCl (10、30、60、90、120 mmol/L)累积给药的收缩反应曲线,记录KCl诱发的最大收缩反应。然后取出标本,去除多余水分,称量标本湿重。
1.6 统计学方法
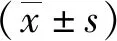
2 结果
2.1 血管环湿重及血管反应性测定
三组大鼠尾动脉标本的湿重和KCl诱发的最大收缩反应差异无统计学意义(P>0.05),见图1和表1。NA(0.001、0.003、0.01、0.03、0.1、0.3、1、3、10、30、100 μmol/L)累积给药诱发的三组大鼠去内皮尾动脉的收缩反应曲线,经双因素方差分析差异无统计学意义 (P>0.05),见图2和表2。提示三组尾动脉血管的收缩反应性差异无统计学意义,可以进行第二轮血管收缩反应实验。
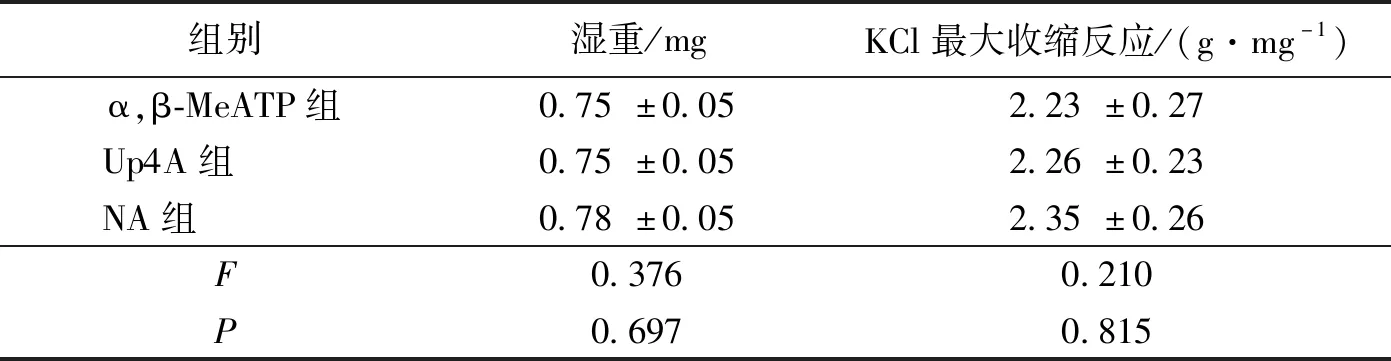
表1 三组大鼠尾动脉标本湿重以及KCl诱发的最大收缩反应比较 (n=4)
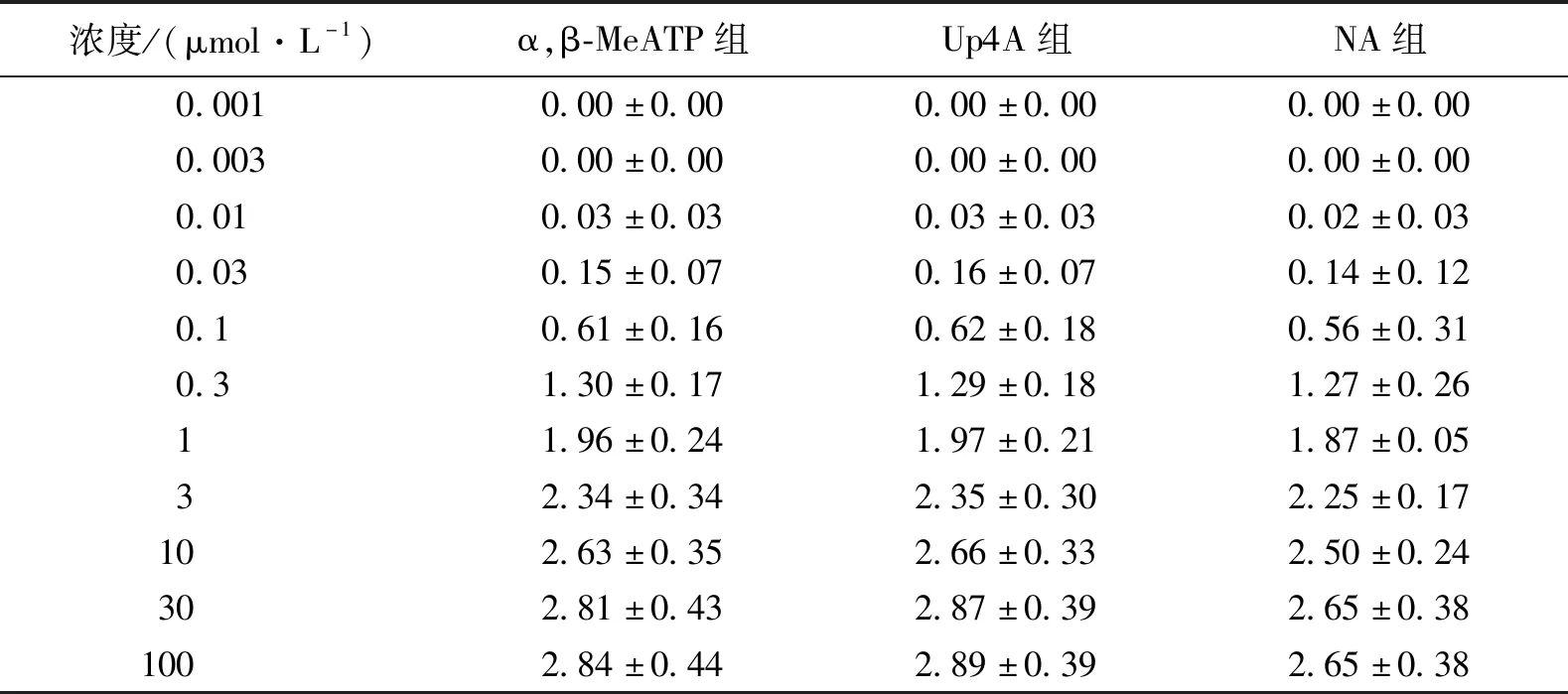
表2 NA诱发的三组血管收缩反应性比较 (n=4) g·mg-1

A 标本湿重;B KCl诱发的最大收缩反应图1 三组大鼠尾动脉标本湿重以及KCl诱发的最大收缩反应比较 (P>0.05,n=4)
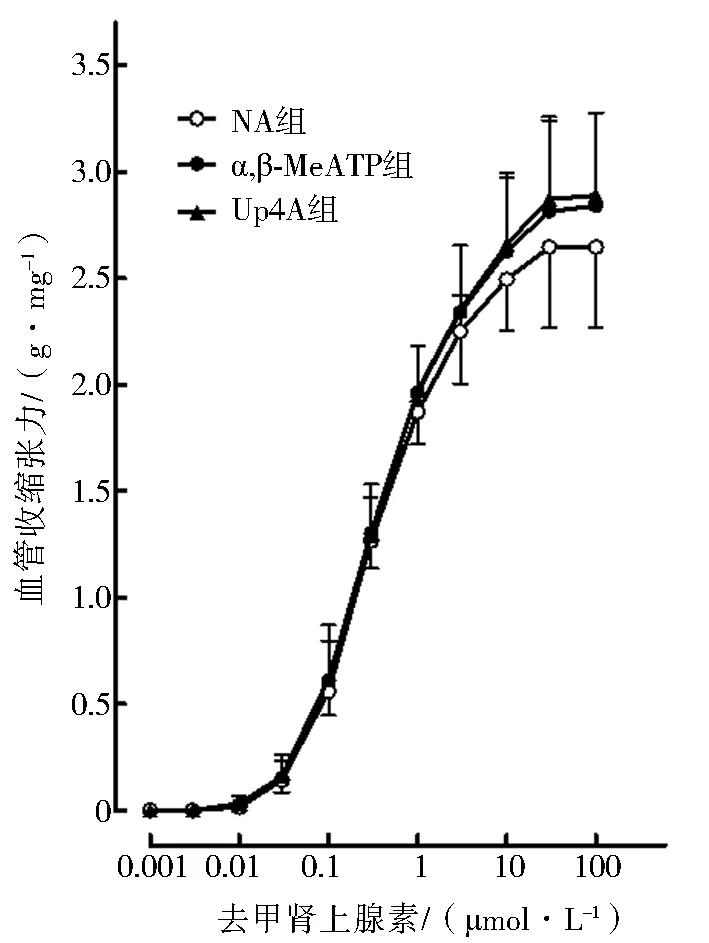
图2 NA诱发的三组血管收缩反应性比较 (P>0.05,n=4)
2.2 NA、α,β-MeATP和Up4A诱导大鼠离体去内皮尾动脉血管收缩反应比较
NA、α,β-MeATP和Up4A三种药物均可产生浓度依赖性收缩反应。双因素方差分析显示,以标本湿重和KCl最大收缩反应标化后的三条收缩反应曲线差异均具有统计学意义,收缩反应强度为NA>α,β-MeATP>Up4A。与NA(0.1、1、10 μmol/L)诱发血管收缩反应的值进行比较,同浓度α,β-MeATP和Up4A诱发收缩反应差异均具有统计学意义 (均P<0.01),见图3、表3—4。10 μmol/L NA、α,β-MeATP和Up4A诱导尾动脉血管收缩反应的值分别为KCl最大收缩反应的(95.26±14.57)%、(62.28±6.98)%和(12.16±2.19)% (P<0.01),10 μmol/L α,β-MeATP和Up4A诱发的尾动脉收缩反应分别占同浓度NA诱发收缩反应的65.4%和12.8%。
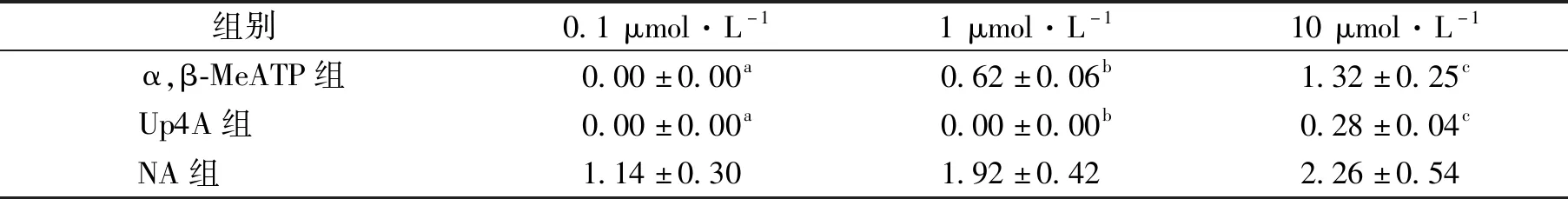
表3 不同浓度NA、α,β-MeATP和Up4A诱发大鼠去内皮尾动脉环的收缩反应比较(n=4) g·mg-1

表4 不同浓度NA、α,β-MeATP和Up4A诱发大鼠去内皮尾动脉环的收缩反应(血管收缩张力 /KCl最大收缩张力)比较(n=4) %
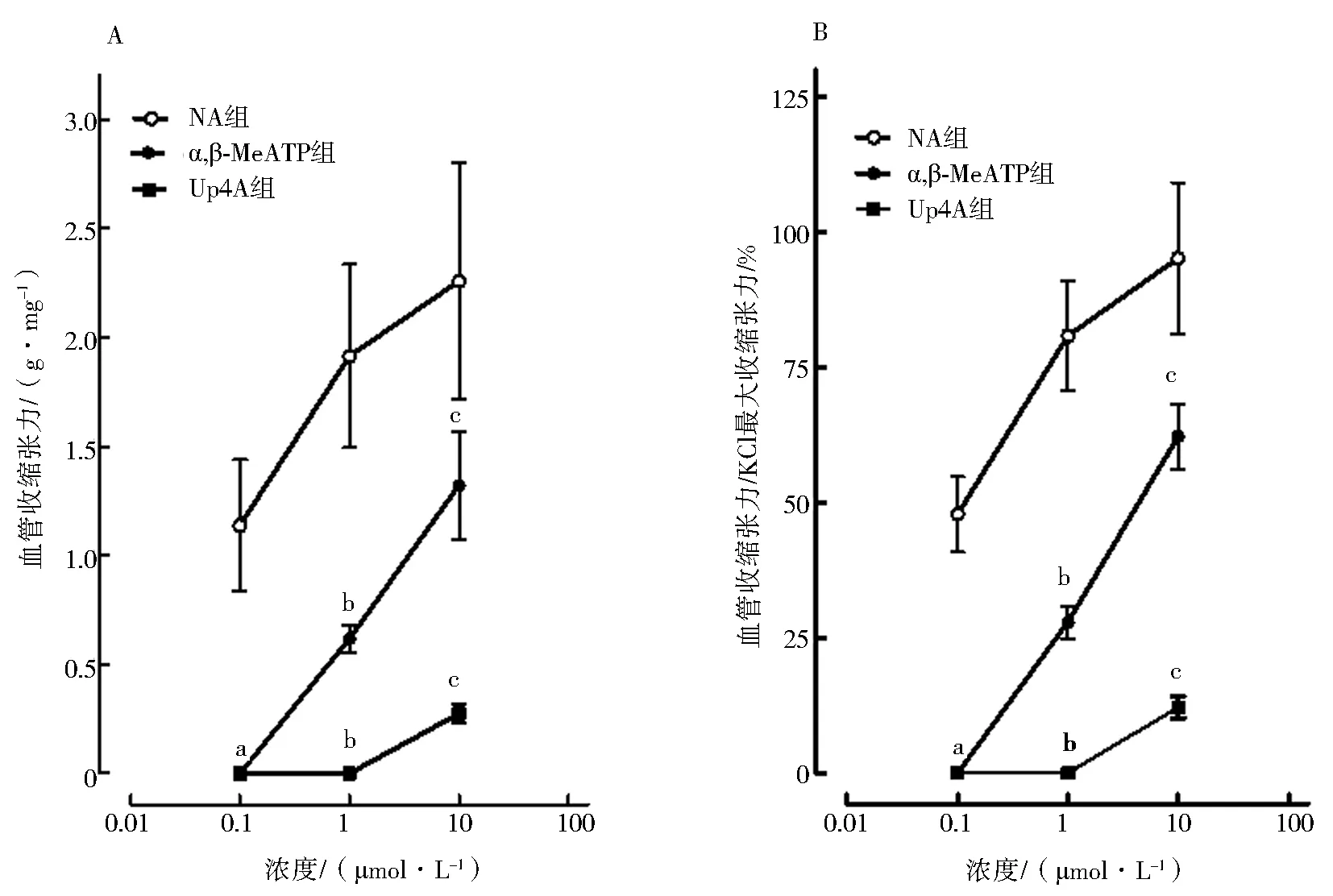
与0.1 μmol·L-1 NA比较,aP<0.01;与1 μmol·L-1 NA比较,bP<0.01;与10 μmol·L-1 NA比较,cP<0.01图3 不同浓度NA、α,β-MeATP和Up4A诱发大鼠去内皮尾动脉环的收缩反应比较(n=4)
3 讨论
Up4A是第一个在生物活体中发现的同时含有嘧啶和嘌呤结构的二核苷酸,可通过激活 P1 和 P2 受体发挥血管调节作用。其嘌呤和嘧啶结构引起的反应因所研究的物种、品系和组织的不同而有很大差异,这可能由于不同部位嘌呤能受体亚型在血管平滑肌或内皮细胞的表达具有差异性所致,使Up4A在不同类型动脉中的作用难以预测。外周阻力血管的重塑在高血压的发生发展中起关键作用[9],外周阻力血管的收缩和舒张在血容量不足或休克等病理状况下保证重要脏器血液供应方面发挥重要作用。既往研究发现,核苷酸对于血管舒缩功能的实现有内皮细胞和平滑肌细胞的 P2 受体参与,平滑肌细胞的P2受体尤其是P2X1,主要介导血管的收缩,大鼠尾动脉作为主要的外周阻力血管,其P2X1受体密度明显高于其他血管组织[6]。另一方面,血管内皮具有分泌多种血管活性因子(NO、内皮素、前列腺素、PGI2等)的能力,内皮功能障碍分泌血管舒缩物质的比例失调也是高血压的重要因素,所以实验中为了排除内皮功能对血管张力的影响,选择去内皮大鼠尾动脉血管环进行实验,观察不同受体激动剂对大鼠尾动脉平滑肌的收缩作用。结果显示,NA通过肾上腺素能受体在介导去内皮大鼠尾动脉血管收缩方面仍占有绝对优势;10 μmol/L P2X1受体特异性激动剂α,β-MeATP诱发的尾动脉收缩反应接近NA的65.4%,说明P2X1受体对维持血管张力以及血压调节方面也具有重要意义。
本研究结果显示,在标本湿重和血管收缩性基本相同的情况下,与NA和α,β-MeATP相比,Up4A在低浓度时未能诱发去内皮尾动脉环收缩反应,以往研究也发现低浓度(0.1 μmol/L 和1.0 μmol/L)Up4A不能诱发去氧肾上腺素预收缩的小鼠胸主动脉[10]和大鼠去内皮胸主动脉环[11]的收缩反应,本实验和文献结果一致。本实验10 μmol/L Up4A诱导的大鼠去内皮尾动脉环收缩反应为同浓度NA的12.8%,以往发现10 μmol/L Up4A可使去氧肾上腺素预收缩的小鼠胸主动脉进一步收缩(19±6)%后,继而发挥舒张作用(46±6)%[10];可使大鼠去内皮胸主动脉环收缩(20±5)%,也可使去氧肾上腺素预收缩的内皮完整的大鼠胸主动脉环舒张25%,但对去内皮血管环则无任何舒张作用[11],这些结果表明,Up4A在不同血管、不同血管张力情况下发挥的作用具有明显差异,这对特殊情况下血液再分布以保障重要脏器血液供应具有重要意义。有研究[12]表明,非选择性 P2YR 拮抗剂可减弱Up4A在无预收缩的完整内皮大鼠肺动脉的收缩反应,而非选择性 P2XR 拮抗剂或 P2X1R 激动剂α,β-MeATP使P2X1受体预先脱敏情况下,均不能减弱Up4A的缩血管作用。此外在内皮完整的肺动脉血管环中,Up4A的缩血管作用强度大于 UTP(P2Y2R和P2Y4R的配体)和UDP(P2Y6R的配体),而三者对去内皮肺动脉环诱发的收缩程度相当,在AngⅡ诱导型高血压小鼠中发现血管紧张素受体1型(angiotensin type 1 receptor,AT1R)和P2X1受体蛋白质表达有所上调[13],表明Up4A可能通过P2YR和P2XR 共同调节血管的张力参与高血压病的发生发展,维持血压平衡。
综上所述,大鼠尾动脉作为主要的阻力血管,肾上腺素能受体和P2X1嘌呤受体在血管张力调节方面具有重要作用;具有嘧啶和嘌呤结构的二核苷酸Up4A在介导外周阻力血管平滑肌收缩方面效果较小;外周阻力血管平滑肌不同受体介导血管张力的不同可能对血液再分配、保障重要脏器血液供应方面具有重要意义。本课题组将进一步进行实验,观察不同受体激动剂对内皮完整血管的张力调节作用、Up4A对血管内皮细胞和平滑肌细胞P2Y受体和P2X受体介导血管舒张和收缩的影响。除此之外,嘌呤受体拮抗剂对正常血压和高血压大鼠血管张力的影响也将进一步完善,以期为分析嘌呤受体在高血压发生发展中的作用及机制提供实验依据。
