甘肃部分地区苹果褐腐病病原分离鉴定及拮抗细菌筛选
2023-11-23蒋晶晶周昭旭杜蕙吕昭龙王春明郭建国张新瑞李继平1
蒋晶晶 周昭旭 杜蕙 吕昭龙 王春明 郭建国张新瑞 李继平1,,3
(1. 甘肃省农业科学院植物保护研究所,兰州 730070;2. 甘肃农业大学植物保护学院,兰州 730070;3. 农业农村部天水作物有害生物科学观测试验站,天水 741299)
苹果在我国北方广泛种植,甘肃的苹果种植面积达44.13万hm2,是全国苹果的主产省份之一[1]。病虫害导致的检疫问题是我国苹果国际市场准入的重要挑战[2]。苹果褐腐病是美国、加拿大、澳大利亚等国的检疫对象,是严重危害苹果生产的一种世界性病害,该病不仅在果树生长期进行危害,造成花腐、果腐、枝条溃疡等,还能引起储藏期烂果,对苹果产业造成严重威胁[3]。
苹果褐腐病病原菌主要有6种,其中有性态3个种[4]:实生链核盘菌(M. fructicola)、核果链核盘菌(M. laxa)和果生链核盘菌(M. fructigena);未发现有性态的3个丛梗孢属种[5-7]:梅生链核盘菌(M.mumecola)、云南链核盘菌(M. yunnanensis)和多子座链核盘菌(M. polystroma)。虽然不同的褐腐病菌种群都能侵染果树引起褐腐病,但其分布及寄主偏好有一定差异。目前,世界上报道的能侵染苹果并引起褐腐病的病原菌种类主要有:M. fructicola[8]、M. laxa、M. fructigena[9]、M. polystroma[10]和M.yunnanensis[11],其中陕西、河北、北京、云南、新疆等苹果产区的优势致病菌为(M. yunnanensis),甘肃地区苹果褐腐病的致病菌种类报道较少。因此,明确苹果褐腐病致病菌种类对甘肃地区苹果病害防治具有重要指导意义。
对苹果褐腐病的防治,生产上主要采用化学杀菌剂,如波尔多液、甲基托布津等[12]。化学杀菌剂的长期大量使用,导致病原菌产生抗药性,同时农药残留会污染生态环境,影响苹果的品质与安全。生物防治是一种高效、无毒、无污染的防治策略,且不易使病原菌产生抗药性。近年来,越来越多的生物农药被开发应用,毛壳菌是一种极具生防潜力的真菌,能够产生大量的纤维素酶[13],可以抑制病原菌生长,如球毛壳菌(Chaetomium globosum)可用于防治苹果褐腐病并开发为防治苹果采后病害的生防制剂[14];芽孢杆菌属的菌株因其营养需求简单、繁殖生长快、代谢产物丰富、可产抗逆性芽孢等特点而具有显著的生防潜力,成为研发生防菌剂的理想菌株[15]。目前报道的对褐腐病菌有显著抑制作用的芽孢杆菌有死谷芽孢杆菌(Bacillus vallismortis)、高地芽孢杆菌(B. altitudinis)和特基拉芽孢杆菌(B.tequilensis)[16-17],但国内外对于拮抗M. yunnanensis的生防芽孢杆菌筛选研究较少。
本研究从甘肃苹果主产区(静宁及榆中县)采集褐腐病病果,分离并鉴定病原菌。以其为供试靶标菌,从本实验室已保存的内生拮抗菌库中筛选优良拮抗菌,测定其对褐腐病防病效果,明确拮抗菌种类与特性,旨在探明引起甘肃静宁县及榆中县苹果褐腐病的病原菌种类,以期获得对苹果褐腐病有较强生防作用的拮抗菌。
1 材料与方法
1.1 材料
1.1.1 供试菌株 供试病原真菌:苹果褐腐病病果采集于甘肃省静宁县和榆中县,品种为‘秦冠’和‘红富士’,并于同地区采集‘秦冠’和‘红富士’健康果实若干作为离体接种试验用材料。
供试拮抗细菌:健康葡萄植株的根、茎、叶中分离筛选得到的5株具有广谱性的内生拮抗菌,由甘肃省农业科学院植物保护研究所经济作物病害研究室保存。
1.1.2 供试培养基 马铃薯葡萄糖琼脂培养基(PDA):马铃薯200 g,葡萄糖20 g,琼脂15 g,蒸馏水1 000 mL,pH自然;牛肉膏蛋白胨琼脂培养基(NA):牛肉膏5 g,蛋白胨10 g,NaCl 5 g,琼脂15 g,蒸馏水1 000 mL,pH 7.0;牛肉膏蛋白胨培养基(NB):牛肉膏5 g,蛋白胨10 g,NaCl 5 g,蒸馏水1 000 mL,pH 7.0。
1.2 方法
1.2.1 病原菌的分离纯化 采用常规组织分离法[18],在超净工作台内选取发病中期的褐腐病病果,在病健交界处用手术刀切取约为5 mm×5 mm的组织,用75%的酒精浸泡30 s,再用1%次氯酸钠溶液处理3 min,灭菌水冲洗3次后,在灭菌干燥滤纸上自然风干,然后置于PDA培养基中,25℃恒温培养箱黑暗培养3-4 d,待长出菌落后挑取菌丝尖端进行纯化,转接至PDA斜面4℃保存。对分离所得的菌株依据病害缩写(HF)+字母原则对其进行命名。
1.2.2 病原菌回接(柯赫氏法则) 采用室内离体果实打孔接种菌饼和孢子悬浮液的方法进行致病性测定。选择大小均匀、成熟度一致无病虫斑和机械损伤的‘秦冠’和‘红富士’苹果作为接种材料。试验前将果实用75%酒精擦洗,随后用灭菌水冲洗3次,待果实表皮自然风干后备用。
打孔接种菌饼法:先用灭菌打孔器(直径5 mm)在果实赤道部位打孔,深度为3 mm,用灭菌打孔器(直径5 mm)在事先活化5 d的新鲜菌落边缘打取菌饼,菌丝面紧贴于孔内,以空白PDA菌饼为对照。
打孔接种孢子悬浮液法:用移液器吸取浓度约为1×105个/mL的孢子悬浮液15 μL注于孔内,以接种灭菌水为对照。以上每处理3个果实,每个果实设3个接种点,共9个重复。将处理后的果实置于铺有保湿纱布的密封15 L塑料盒中,25℃ 12 h光暗交替培养,第5天观察并统计果实发病情况,对发病果实进行病原菌再分离。
1.2.3 病原菌形态鉴定 将分离纯化的病原菌转接于PDA平板上,置于25℃恒温培养箱中黑暗培养。6 d后进行菌落形态、生长速率、孢子大小等观察和测定。参照Lane[19]形态学鉴定方法和《真菌鉴定手册》[20]进行供试菌株的形态学鉴定。
1.2.4 病原菌分子生物学鉴定 将菌株接种在铺有灭菌玻璃纸的PDA平板上进行培养,25℃恒温黑暗培养5 d后收集菌丝,采用CTAB法[21]提取菌株基因组DNA。选取真菌通用引物ITS1(5′‑TCCGTAG‑GTGAACCTGCGC‑3′)和ITS4(5′‑TCCTCCGCTTATT‑GATATGC‑3′)进行扩增。25 μL PCR反应体系为2×PCR Master Mix 12.5 μL、正反向引物(10 μmol/L)各0.5 μL、DNA模板1.0 μL,ddH2O补至25 μL。PCR扩增程序为94℃ 2 min;94℃ 45 s,55℃ 30 s,72℃ 45 s,35个循环;72℃ 10 min,4℃保存。用1.5%琼脂糖凝胶电泳检测,并将阳性条带的样送生工生物工程(上海)有限公司测序,所测序列在NCBI网站进行BLAST同源性比对分析比对。下载GenBank中的相似性较高的序列用MEGA 5.0程序中的邻接法构建系统发育树,共循环1 000次。
1.2.5 拮抗细菌的筛选与鉴定
1.2.5.1 拮抗细菌的筛选 以苹果褐腐病病原菌为靶标菌,采用平板对峙法[22]筛选拮抗细菌。将病原菌置于PDA培养基25℃活化培养7 d后打成直径0.5 cm的菌饼,接种在PDA培养基中央,5株拮抗菌经NA培养基28℃,48 h活化后点接在距菌饼2.5 cm处,每平板4点,以不接生防菌为对照,重复3次。置于25℃培养,待对照病菌长满培养皿时,测量菌落直径,计算抑制率。
1.2.5.2 离体果实防效测定 参考Sadeghian等[23]方法,用红富士苹果测定拮抗菌对褐腐病菌的抑制活性。拮抗菌菌悬液的制备:将拮抗菌接种于150 mL的NB培养基,在28℃,转速150 r/min摇培48 h,到达稳定期得到菌悬液。选取大小均一的红富士苹果果实,用75%酒精擦洗,灭菌水冲洗后晾干,用灭菌打孔器(直径5 mm)在果实赤道部位打5 mm(宽)×3 mm(深)的伤口,用于接种。设置3个处理:(1)预防组,接种M. yunnansis菌饼前24 h往孔口内接种15 μL菌悬液。(2)治疗组,接种M. yunnansis菌饼时接种菌悬液及接种M. yunnansis菌饼24 h后接种菌悬液。(3)对照组,仅接种M.yunnansis菌饼。以上每处理3个果实,每个果实设3个接种点,共9个重复。将处理后的果实置于铺有保湿纱布的密封15 L保鲜盒中,25℃ 12 h光暗交替培养,接种生防菌液5 d后测量病斑大小。
1.2.5.3 拮抗菌形态学及生理生化指标测定 将拮抗菌株于NB和PDA平板上划单菌落,37℃培养24 h,参照东秀珠《常见细菌系统鉴定手册》[24]进行菌落形态观察和生理生化特性鉴定,并对菌株进行革兰氏染色,在油镜下观察形态特征。
1.2.5.4 拮抗菌分子生物学鉴定 采用天根细菌基因组提取试剂盒,按照说明方法提取菌株基因组DNA。根据16S rRNA两端的保守序列,采用细菌鉴定通用引物27F(5′‑AGAGTTTGATCCTGGCTCAG‑3′)和1492R(5′‑GGTTACCTTGTTACGACTT‑3′)及gyrA基因引物gyrA‑F(5′‑CAGTCAGGAAATGCG‑TACGTCCTT‑3′)和gyrA‑R(5′‑CAAGGTAATGCTC‑CAGGCATTGCT‑3′)进行扩增。引物由生工生物工程(上海)股份有限公司合成。50 μL PCR反应体系为10×buffer(含2.5 mmol/L Mg2+)5.0 μL、Taq聚合酶(5 U/μL)1.0 μL、dNTP(10 mmol/L)1.0 μL、正反向引物各0.5 μL、基因组DNA 1.0 μL和ddH2O 41.0 μL。16S rRNA扩增程序为94℃ 5 min;94℃ 30 s,56℃45 s,72℃ 1 min,30个循环;72℃ 10 min。gyrA扩增程序为94℃ 5 min;94℃ 1 min,60℃ 1 min,72℃1 min,30个循环;72℃ 10 min。用1%琼脂糖凝胶电泳检测,确认PCR扩增片段,并送生工生物工程(上海)股份有限公司进行测序。用NCBI网站将所得序列与GenBank数据库进行同源性比对分析,用MEGA 5.0程序中的邻接法构建系统发育树。
1.2.6 数据处理 数据用Excel 2007处理后,采用统计学软件SPSS 17.0对各组数据进行单因子方差分析,结果以“平均值±标准差”表示,组间采用t检验法多重比较其差异显著性,以P<0.05作为判断其显著性的标准。
2 结果
2.1 苹果褐腐病病原菌分离鉴定及致病性测定
2.1.1 苹果褐腐病病原菌的分离 苹果褐腐症状主要表现为果实黄褐色软腐并在表面形成褐色圆形斑点,后期病斑蔓延至全果,褐色圆形斑点变为蓝黑色并凹陷致使果实皱缩,提前黄化形成畸形僵果(图1‑A),部分病果上出现点状灰色霉层(图1‑B)。从自然发病的苹果果实上分离纯化得到5个形态一致的培养物,命名为HF‑A-HF‑E。

图1 苹果褐腐病果实自然发病症状及病原菌接种症状Fig. 1 Disease characteristics of brown rot of apple and symptoms of pathogenic inoculation
2.1.2 病原菌致病性测定 将分离的真菌回接于健康苹果上进行致病性测定。接种2 d后接种部位附近出现褐色病斑,5 d后接种部位褐色软腐状严重,已经完全覆盖果实的一侧,果实表面陆续出现蓝黑色菌丝斑块,有少量白色菌丝及分生孢子产生,且菌饼接种后病斑扩展速率为7.3 mm/d,快于孢子悬浮液接种的病斑扩展速率6.9 mm/d;菌饼接种的腐烂病斑上更容易长出菌丝和分生孢子;病原菌在‘红富士’品种上的致病力明显强于‘秦冠’(图1‑CF);发病症状与自然条件下发病症状一致且对照均未发病。
2.1.3 病原菌的形态特征 分离得到的5株病原菌在PDA平板上生长良好[(8.5±0.59)mm/d],菌落最初为灰白色,后逐渐加深,最后变为灰褐色。菌落中间颜色较深,边缘整齐,气生菌丝贴近培养皿生长,呈灰褐色纤维絮状或绒毡状,背面可见黑色的基质或黑环。分生孢子梗不分枝,或二叉状分枝,分枝多呈锐角,产孢梗长短不一。分生孢子无色,单孢[(10-21)μm×(7-12)μm],链状排列,卵圆形、长椭圆形和柠檬形,产孢量较少(图2)。结合Lane[19]的褐腐病菌形态鉴定方法和魏景超《真菌鉴定手册》[20],5个分离株形态特征均与(M.yunnanensis)模式菌相似。
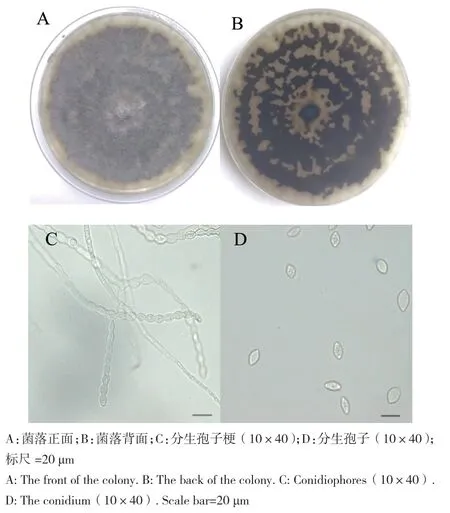
图2 苹果褐腐病菌的菌落形态及分生孢子形态Fig. 2 Colony and conidial morphology of apple brown rot bacteria
2.1.4 ITS序列扩增与系统发育分析 5个分离菌株的ITS片段大小均为482 bp,且比对后只有1个碱基存在差异,因此,将5个分离物视为同一种菌,序列上传至GenBank,获得登录号为OL440404。在NCBI中进行BLAST分析,分离株ITS序列与M.yunnanensis相似度在99%以上。从GenBank数据库中下载相似性最高的同种和近似种褐腐病菌菌株的若干序列,以核盘菌科蜡盘菌属(Rutstroemia paludosa)为外群,用MEGA 5.0软件,采用邻接法构建系统发育进化树。结果(图3)表明,代表菌株HF‑A与M. yunnanensis聚在同一分支,与M.fructigena归在同一个大分支,表明甘肃静宁县及榆中县苹果褐腐病的病原菌为M. yunnanensis,与M.fructigena亲缘关系较为接近。

图3 基于rDNA-ITS序列采用邻接法构建的系统发育树Fig. 3 Phylogenetic tree constructed using the neighbourjoining based on rDNA-ITS sequences
2.2 拮抗菌的抑菌效果与鉴定
2.2.1 拮抗菌对苹果褐腐病菌的抑制作用 从5株广谱性较好的拮抗菌中筛选得到3株对M.yunnanensis具有较好抑制效果的菌株。其中,拮抗菌X2‑2和Zyx‑3对褐腐病菌的抑制效果最好,抑菌率分别为(81.29±0.57)%和(80.08±0.66)%,抑菌带宽度分别达(7.42±0.17)mm和(5.42±0.51)mm,各处理间差异均达显著水平(P<0.05)(表1)。因X2‑2菌株对褐腐病菌的抑制效果最好,后续对其进行离体果实上抑菌效果测定(图4)。

图4 拮抗菌X2-2对苹果褐腐病菌的拮抗效果Fig. 4 Effect of antagonistic bacteria X2-2 against M. yun‑nanensis
2.2.2 拮抗菌在果实上的抑菌效果 在25℃光暗交替条件下,第5天时处理A(治疗组)全部发病,果实上病斑面积达24.3 cm2,对照病斑遍及果实的一侧(面积达50.5 cm2),整体防治效果达52.0%;处理B(治疗组)和处理C(预防组)病斑面积分别为0.5和0.4 cm2,防效分别为98.4%和98.8%,且差异不显著,防治效果优于处理组A(图5和图6)。表明菌悬液和病原菌同时接种或提前接种菌悬液均能发挥较好的防治效果。
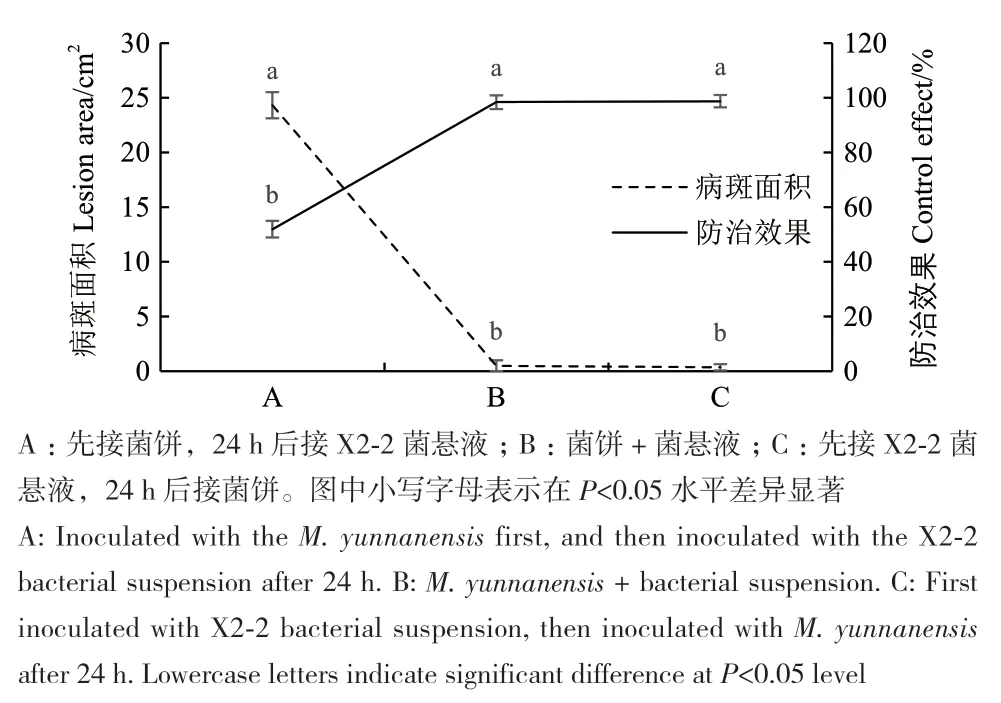
图5 接种时间对病斑面积和防治效果的影响Fig. 5 Effect of inoculation time on lesion area and control effect

图6 X2-2菌悬液对苹果褐腐病病斑扩展的抑制效果Fig. 6 Inhibition effect of X2-2 bacterial suspension on the lesion expansion of M. yunnanensis
2.2.3 X2‑2菌株的形态学鉴定 将菌株接种至PDA平板上,28℃培养5 d后,拮抗菌X2‑2菌落似火山堆,呈乳白色不透明,表面粗糙有褶皱,边缘不规则。显微观察发现,菌体呈杆状,革兰氏染色阳性(图7)。
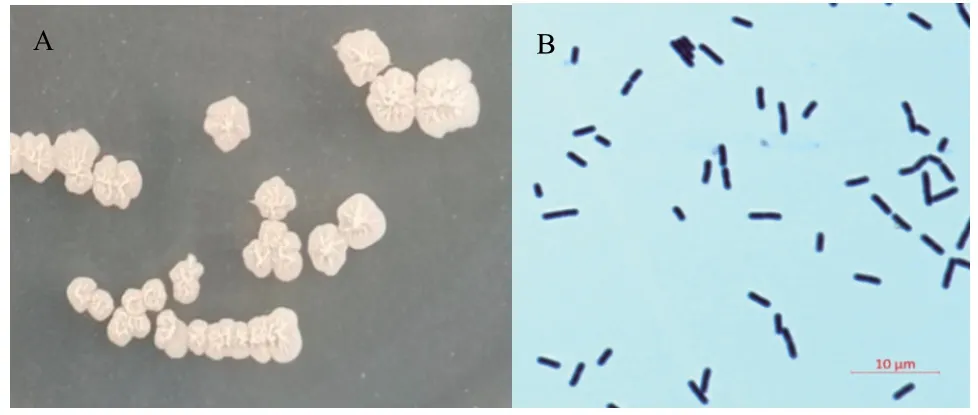
图7 拮抗菌X2-2的单菌落(A)和革兰氏染色(B)Fig. 7 Colony(A)and Gram stain(B)of antagonistic bacterium X2-2
2.2.4 X2‑2菌株的生理生化特性 根据常见微生物鉴定手册可知,该拮抗细菌与解淀粉芽孢杆菌B.amyloliquefaciens的生理生化特性一致(表2)。

表2 拮抗菌X2-2的生理生化鉴定结果Table 2 Physiological and biochemical identification results of antagonistic bacterium X2-2
2.2.5 X2‑2菌株的分子鉴定 在NCBI数据库中BLAST比对分析发现,菌株X2‑2的16S rRNA序列与解淀粉芽孢杆菌(B. amyloliquefaciens)、枯草芽孢杆菌(B. subtilis)、甲基营养型芽孢杆菌(B.methylotrophicus)和贝莱斯芽孢杆菌(B. velezensis)同属近缘种,序列同源性达100%,从构建的系统发育树中可以看出与其处在同一分支上,无法明确菌株X2‑2种的分类地位。菌株X2‑2的gyrA基因序列与已知解淀粉芽孢杆菌KU904810、KU847915和LC096068的gyrA基因序列同源性分别为99%,菌株X2‑2与以上解淀粉芽孢杆菌属同一分支,可将菌株X2‑2鉴定为解淀粉芽孢杆菌(图8)。根据gyrA基因序列构建的系统发育树,可将更接近的解淀粉芽孢杆菌和贝莱斯芽孢杆菌清晰区分为2个分支。

图8 基于16S rRNA(A)和gyrA(B)基因序列构建的拮抗菌X2-2的系统发育树Fig. 8 Phylogenetic tree of antagonistic bacterium X2-2 based on 16S rRNA (A) and gyrA (B) sequences
3 讨论
本试验对采自甘肃省静宁县和榆中县苹果产区的褐腐病果上分离的菌株,采用ITS序列结合形态学将其鉴定为云南链核盘菌(M. yunnanensis),这与报道的中国梨和苹果的褐腐病菌优势种为M.yunnanensis的研究结果一致[11],而与周芳[25]和牛程旺等[26]报道的山西省和新疆苹果、梨褐腐病主要病原菌种群为M. fructigena[25]研究结果不一致,这可能与不同地区的生态环境、气候类型等因素有关。M. yunnanensis是2011年发现于我国云南省的新种,分布于云南的大部分地区[6],同时也在北京、河北、陕西、甘肃、新疆及辽宁等省(市)采集到,可以危害桃、杏、山楂、苹果及梨等[27-28]。据报道,不同地区苹果褐腐病菌种群之间存在差异,本试验仅对甘肃静宁县和榆中县苹果主产区的苹果褐腐病进行了研究,但有关全省和全国不同地区的褐腐病菌种群的遗传多样性需进一步探索,为该病原菌的种群分化及不同地区核果类及仁果类果实褐腐病的有效防治提供理论依据。
芽孢杆菌属由于其具有较好的抑制植物病原菌的能力,并且其产生的芽孢具有很强的抗逆性,有利于生防菌剂的生产、剂型加工及在环境中存活、定殖与繁殖,目前被广泛用于农业领域[29]。近几年,已有学者筛选出了一些拮抗M. fructigena的贝莱斯芽孢杆菌(B. velezensis)[30]、拮抗M. fructicola的解淀粉芽孢杆菌(B. amyloliquefaciens)和特基拉芽孢杆菌(B. tequilensis)[17]、地衣芽孢杆菌(B.licheniformis)[31],但国内外对于拮抗M. yunnanensis的生防菌筛选研究较少,本研究通过平板对峙筛选出抑菌效果最好的解淀粉芽孢杆菌X2‑2,对M.yunnanensis的菌丝抑制率达(81.29±0.57)%,在离体果实上打孔接种拮抗菌菌悬液24 h后再接种病原菌菌饼,拮抗菌的防治效果高达98.8%,说明该拮抗菌具有很强的附着能力,能在受伤果实表面迅速定殖,有效降低果实病斑扩展速度。现在普遍认为,与病原物进行营养物质与空间位点竞争是拮抗微生物防治病害最主要的作用机制之一[32]。本研究中接种M. yunnansis菌饼同时接种菌悬液的处理与接种M.yunnansis菌饼24 h后接种菌悬液的处理,培养5 d后防治效果分别为98.4%和52.0%,说明病原菌与拮抗菌同时接种时拮抗菌能够更快地利用果实机械伤口处的营养,阻止病原菌的侵入和扩展,这也很好解释了为什么越早接种拮抗菌生防效果越好。但关于该菌株在实际储藏果实上的防治效果还需进一步试验验证。
4 结论
甘肃静宁县及榆中县的苹果褐腐病的病原菌为云南链核盘菌(M. yunnanensis)。以该病原菌为靶标,以分离自葡萄的5株优良拮抗内生菌为研究对象,筛选得到抑制效果最好的拮抗细菌X2‑2,将其鉴定为解淀粉芽孢杆菌(B. amyloliquefaciens)。该菌株具有较好的生防潜力,病原菌与菌悬液同时接种至离体果实,培养5 d后防效仍达98.4%,可用于开发苹果采后病害防治的生防制剂。
