低磷胁迫下番茄转录因子WRKY6功能分析
2023-11-23陈浩婷张玉静刘洁代泽敏刘伟石玉张毅李天来
陈浩婷 张玉静 刘洁 代泽敏 刘伟 石玉 张毅 李天来,2
(1. 山西农业大学园艺学院,太谷 030801;2. 沈阳农业大学园艺学院,沈阳 110866)
磷是植物生长发育必需的大量元素之一,在遗传信息的传递和细胞结构的维持中起重要作用。磷的供应减少,会使细胞分裂和增殖受到限制,植物新器官不能形成,代谢停滞,生长发育受阻[1]。研究表明,低磷胁迫能使大多数植物的根冠比增大、根直径变细、侧根和根毛密度增大,大多数植物根系还可改变生长角度,在表层土壤富集,形成“伞状”根系构型,以便于吸收表层土壤中的磷[2]。低磷胁迫下,植物自身还能产生一系列适应性反应,通过增强根系酸性磷酸酶活性等,增加根系对外界磷的获取和内部磷的循环再利用,通过根系释放的低分子量有机酸活化土壤中的无机、有机磷,通过诱导响应磷饥饿基因表达量变化等提高植物对磷的吸收,进而维持植物体内的磷稳态[3-5]。然而,设施番茄(Solanum lycopersicum L.)生产中普遍存在土壤磷总量高但磷肥利用率严重偏低的问题,每年仍需大量增施磷肥才能满足番茄生产的养分需求(磷肥用量达需求量的28.7倍),阻碍产业发展[6]。因此,采用有效的生物技术手段,解析磷素营养调控的分子通路,挖掘提高番茄低磷耐受性和磷素利用率的种质资源,具有重要的理论价值和现实意义。
大量研究表明,WRKY转录因子家族成员广泛参与应答各种生物和非生物胁迫反应[7]。WRKY转录因子作为应答逆境胁迫的主要成分,通过与启动子区域中的顺式作用元件W‑box结合调控与抗逆有关靶标基因的表达,最终赋予植物抗逆性[8]。依据结构域数量和锌指结构特征,WRKY主要分为3类:第I类含2个WRKY结构域,又可分为2个亚类(Ia和Ib,锌指结构分别为C2H2型和C2HC型);第II、III类含1个WRKY结构域,其中第II类锌指结构为C2H2型(IIa-IIe,5个亚类),第III类锌指结构为C2HC型[9]。近年来,WRKY通过结合靶基因启动子调控磷胁迫信号通路中相关基因表达的作用引起了广泛关注[10]。AtWRKY75是WRKY家族中首次被报道参与磷转运、分配和信号转导的转录因子,AtWRKY75 RNAi株系中磷转运体基因的表达量显著下降,表明该基因可正向调控磷转运体应对低磷胁迫[11]。过表达WRKY42促进了拟南芥(Arabidopsis thaliana)对磷的吸收,导致根部磷含量的增加;而在WRKY42突变体中磷的吸收能力下降,导致根中磷含量降低,使植株对低磷胁迫敏感。AtWRKY6和AtWRKY42都可直接结合在PHO1的启动子上抑制其表达,降低植株对低磷胁迫的耐受性[12]。过表达OsWRKY21或OsWRKY108通过增强PHT1;1基因的表达而促进磷的积累,而OsWRKY21和OsWRKY108双突变体中PHT1;1基因表达水平和磷积累量均降低[13]。总之,WRKY对下游缺磷响应基因有正向或负向的调控,并对植物的磷素信号和磷素稳态产生影响。
本研究前期转录组结果显示,低磷胁迫下大量WRKY家族基因表达出现显著变化,尤其是SlWRKY6基因表达量降低了67.14%[14]。为发掘番茄中应答低磷胁迫的WRKY转录因子,利用转基因技术获得SlWRKY6的干扰和超表达转基因番茄材料,解析SlWRKY6的功能,为揭示设施番茄磷高效利用的分子调控网络提供新观点,同时为利用WRKY转录因子改良茄科作物的低磷耐受性和提高磷利用效率提供科学依据。
1 材料与方法
1.1 材料
1.1.1 试验材料 试验于2022年4-12月在山西农业大学园艺实验中心人工气候室进行,以实验室自存的Ailsa Craig野生型番茄为试验材料。
1.1.2 主要试剂 RNAiso Plus(Trizol)购自宝生物(TaKaRa)工程(大连)有限公司;反转录试剂盒、荧光定量试剂盒均购于南京诺唯赞生物科技股份有限公司;在上海生工生物工程股份有限公司(https://www.sangon. com/)进行引物合成。
1.2 方法
1.2.1 材料培养及试验处理 将番茄种子清洗、浸种、催芽,播种;待“三叶一心”时选取长势良好、大小一致的幼苗,将其根系表面洗净,定植于1/2倍Hoagland营养液中进行不同磷水平处理。其中正常磷处理的KH2PO4浓度为0.66 mmol/L,低磷处理的KH2PO4浓度为0.066 mmol/L。待缓苗5 d后换1倍营养液开始处理,在胁迫处理0 d和18 d后取番茄幼苗根系和叶片组织,液氮速冻后置于‑80℃保存,用于各生理生化指标的测定。
1.2.2 番茄SlWRKY6基因的克隆及农杆菌介导的番茄遗传转化 根据NCBI中SlWRKY6的Gene ID(101247683),从Sol Genomics Network网站下载CDS序列。利用Primer5设计特异性引物,参照周涛等[15]和王茹等[16]的方法构建SlWRKY6基因的过表达和干扰载体。将测序正确的菌液提取质粒,通过冻融法转入根癌农杆菌中,筛选单克隆阳性菌株进行后续侵染。将成熟的番茄种子温汤浸种消毒后,均匀地播在MS固体培养基上。待番茄子叶完全展开时,在超净台中将叶片两端切去开始预培养3-4 d,获得番茄野生型植株的外植体。将含有过表达和RNAi重组质粒的农杆菌菌液培养至OD600值为0.6,5 000 r/min离心10 min,将收集菌体用MS液体培养基重悬至OD600=0.4。将外植体置于重悬好的菌液中侵染,暗培养2 d后,进行正常光下培养,开始芽诱导分化、生根以及抗性植株筛选等步骤。
1.2.3 RNAi‑SlWRKY6和OE‑SlWRKY6阳性转基因植株的鉴定 随机称取0.2 g已形成完整幼小植株的组织,进行DNA的提取;选取载体上一段序列和基因上一段序列设计引物进行PCR检测,将最终获得的阳性植株即T0代转基因番茄移栽到田间留种。其中PCR反应体系为20 μL:DNA 4 μL,Forword Prim‑er(10 μmol/L)1 μL,Reverse Primer(10 μmol/L)1 μL,2×Rapid Taq Mastermix 10 μL,ddH2O 4 μL。PCR反应程序为:预变性 95℃ 3 min;变性 95℃ 15 s,退火 55℃ 15 s,延伸 72℃ 30 s,35次循环;终止延伸 72℃ 5 min。检测过表达转基因植株引物为表1中JC‑WRKY6‑F和JC‑WRKY6‑R;检测干扰转基因植株引物为表1中JC‑RNAiWRKY6‑F和JC‑RNAi‑WRKY6‑R。将收获的T0代种子浸种催芽播于穴盘中,待三叶一心转移至温室中培养,获得T1代转基因植株。按照该步骤继续传代培养至T2代,对T2代转基因番茄幼苗再次进行PCR检测(PCR体系和扩增体系同上)和RT‑qPCR检测(RT‑qPCR体系和扩增体系见1.2.4),挑选过表达株系中表达量较高的两个株系OE‑SlWRKY6‑1、OE‑SlWRKY6‑2,以及干扰株系中表达量较低的两个株系RNAi‑SlWRKY6‑1、RNAi‑SlWRKY6‑2,用于后续生理生化指标的测定。选取OE‑SlWRKY6‑1和RNAi‑SlWRKY6‑1两个株系的地下部进行磷转运体家族基因相对表达量的测定。
1.2.4 总RNA提取、cDNA合成及实时荧光定量检测 利用RNAisoPlus(TaKaRa,大连,中国)提取样品中的RNA,将所得RNA按照金沙生物反转录试剂盒的说明书进行反转录。使用诺唯赞公司试剂盒合成第一链cDNA,反应体系为:UnionScript First‑strand cDNA Synthesis Mix 4 μL、总RNA 1 μL、dsDNase 1 μL、ddH2O 14 μL。混匀后42℃15 min,95℃ 3 min,在PCR仪上进行。采用RT‑qPCR方法检测不同基因的表达水平,番茄库中Solyc03g078400被用作Actin内参基因,用3次技术重复进行RT‑qPCR扩增。其中RT‑qPCR反应体系为20 μL:cDNA 4 μL,Forword Primer(10 μmol/L)0.4 μL,Reverse Primer(10 μmol/L)0.4 μL,2×ChamQ Universal SYBR qPCR Master Mix 10 μL,ddH2O 5.2 μL。RT‑qPCR反应程序为:预变性95℃ 30 s;95℃10 s,60℃ 30 s,40个循环;溶解曲线95℃ 15 s;60℃ 60 s;95℃ 15 s。计算基因相对表达量的方法采用2-ΔΔCt,本研究中使用的所有荧光定量引物序列均见表1。
1.2.5 根系与叶片无机磷含量和酸性磷酸酶活性的测定 随机称取约0.2 g冻样,加提取液2 mL(0.4 mL TCA+1.6 mL蒸馏水)充分研磨,离心提取上清液。将0.1 mL样品上清液与1.5 mL试剂(6 mol/L硫酸∶蒸馏水∶2.5%钼酸铵水溶液∶1%抗坏血酸=1∶4∶2∶2配置)混匀置于45℃水浴保温30 min,室温冷却10 min后于660 nm测定吸光度。由于钼蓝与磷酸根生成660 nm有特征吸收峰的物质,即可计算无机磷含量。随机称取约0.3 g冻样,加提取液8 mL醋酸-醋酸钠缓冲溶液(pH 5.8)冰浴充分磨样,高速冷冻离心提取上清液。将0.2 mL样品上清液与5 mL 5 mmol/L对硝基苯磷酸二钠,37℃水浴30 min后加入1 mL 1 mol/L的NaOH溶液结束反应。酸性磷酸酶(ACP)活性通过测量对硝基苯酚在405 nm下的吸光值来评估,一个单位的ACP活性即每克组织在405 nm处每分钟吸光度单位的变化量[17]。
1.2.6 根系有机酸含量的测定 随机选取同一处理下3株幼苗的根系用蒸馏水冲洗干净,加适量液氮研磨成粉末,加入适量的超纯水定容到5 mL,室温水浴超声提取30 min,离心提上清液,用0.45 μm微孔滤膜,每个处理重复3次,采用高效液相色谱(HPLC)测定根系中的有机酸含量。高效液相色谱条件:安捷伦C18柱(XDB‑C18,5 μm,4.6 mm ×250 mm);流动相为0.01 mol/L KH2PO4,pH为2.5(磷酸调节);流速0.5 mL/min;柱温40℃;进样量10 μL;检测波长215 nm[18]。
1.2.7 根系与叶片总磷含量的测定 随机选取同一处理下4株幼苗的根系和叶片,用蒸馏水冲洗干净称其鲜重记录,105℃杀青2 h,75℃烘干至恒重后先称其干重记录,再磨成粉末过0.25 mm筛。每个处理3个重复,每个重复称取0.1-0.2 g样品。参照梁颖等[19]的方法,采用H2SO4‑H2O2消煮。首先将已称取干样用5 mL浓H2SO4过夜酸解,第2天将其在消煮炉上先120℃加热30 min,再380℃加热1 h后加4-5滴H2O2过氧化氢,重复此操作直至溶液清澈透明,最后380℃煮20 min以上消除多余H2O2,消解完成。参照梁颖等[19]的方法,采用钼锑抗比色法测总磷含量。吸取消煮液0.2 mL定容至10 mL,加入两滴2,4‑二硝基苯酚指示剂,滴加4 mol/L NaOH溶液至液体变为黄色,再加2 mol/L H2SO4溶液使黄色刚刚褪去,加钼锑抗显色剂2 mL后定容至50 mL,室温摇匀30 min后于700 nm测定吸光度。
1.2.8 数据处理分析 为了获得可重复性的结果,每个处理进行3个生物重复。数据采用方差分析(ANOVA)进行统计学分析,均数比较采用Duncan’s在SPSS 20.0(SPSS Inc., Chicago, IL, USA)中P<0.05水平下进行。图表绘制采用GraphPad prism8.0绘制(GraphPad Software, San Diego,California USA, www. graphpad. Com)。
2 结果
2.1 农杆菌介导的番茄遗传转化以及阳性植株的鉴定
获得T0代番茄的过程如图1‑A-C和 E-F所示,经传代培养后获得T2代转基因植株,在三叶一心时对部分T2代番茄运用PCR和qPCR技术进行检测,结果如图1‑D, H和图2所示,共获得T2代转基因番茄过表达7株、干扰8株,最终选择其中表达量最高的过表达株系和表达量最低的干扰株系用于后续研究。

图1 番茄的遗传转化和T2代番茄的 PCR 验证Fig. 1 Genetic transformation in tomato and PCR validation in the tomato with the T2 generation
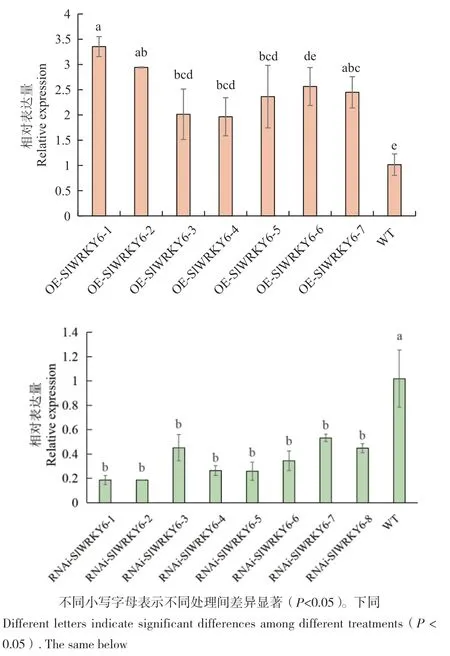
图2 RT-qPCR检测T2代转基因番茄植株RNAi-WRKY6和OE-WRKY6中WRKY6的表达量Fig. 2 Expressions of WRKY6 in RNAi-WRKY6 and OEWRKY6 in T2 generation transgenic tomato plants detected by RT-qPCR
2.2 在低磷胁迫下转基因番茄的表型观察和生理生化指标的测定
2.2.1 在低磷胁迫下转基因番茄的表型变化 低磷处理18 d后,过表达株系茎秆粗壮、叶片伸展且色泽鲜艳、生长趋势良好;而干扰株系茎秆细弱、叶片卷曲枯黄、生长势较弱(图3)。从表型观察可得,SlWRKY6过表达显著提高了番茄植株的耐低磷性。在低磷条件下,与WT相比,OE‑WRKY6的各项生长指标都有显著变化,其中茎粗、地上鲜重、地下鲜重、地上干重、地下干重、总鲜重、总干重均显著增加,OE‑WRKY6‑1分别提高了35.29%、79.75%、104.47%、112.82%、66.82%、88.04%、100.12%;OE‑WRKY6‑2分别提高了80.58%、102.74%、110.27%、67.13%、88.01%、98.35%。与OE‑WRKY6相比,RNAi‑WRKY6的各项生长指标除株高显著提高外,茎粗、地上鲜重、地下鲜重、地上干重、地下干重、总鲜重和总干重等均显著降低(表2)。
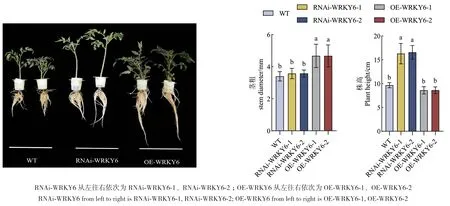
图3 低磷条件下转基因番茄植株RNAi-WRKY6和OE-WRKY6的表型观察Fig. 3 Phenotypes of transgenic tomato plant RNAi-WRKY6 and OE-WRKY6 under low phosphorus conditions
2.2.2 低磷胁迫下不同转基因番茄植株无机磷含量和酸性磷酸酶活性的测定 在处理0 d时,WT和RNAi‑WRKY6叶片的无机磷含量显著低于OE‑WRKY6;而WT和OE‑WRKY6根系的无机磷含量显著高于RNAi‑WRKY6。低磷胁迫处理后,不同基因型番茄植株叶片和根系的无机磷含量均呈下降趋势,其与处理时间呈负相关关系。在处理18 d时,OE‑WRKY6叶片和根系的无机磷含量仍然显著高于WT和RNAi‑WRKY6,与WT相比,RNAi‑WRKY6叶片的无机磷含量较少但未形成显著差异,但根系无机磷显著增高。低磷胁迫下,OE‑WRKY6‑1和OE‑WRKY6‑2叶片和根系的无机磷含量较WT分别显著增加了13.25%、13.39%和46.65%、38.79%(图4)。
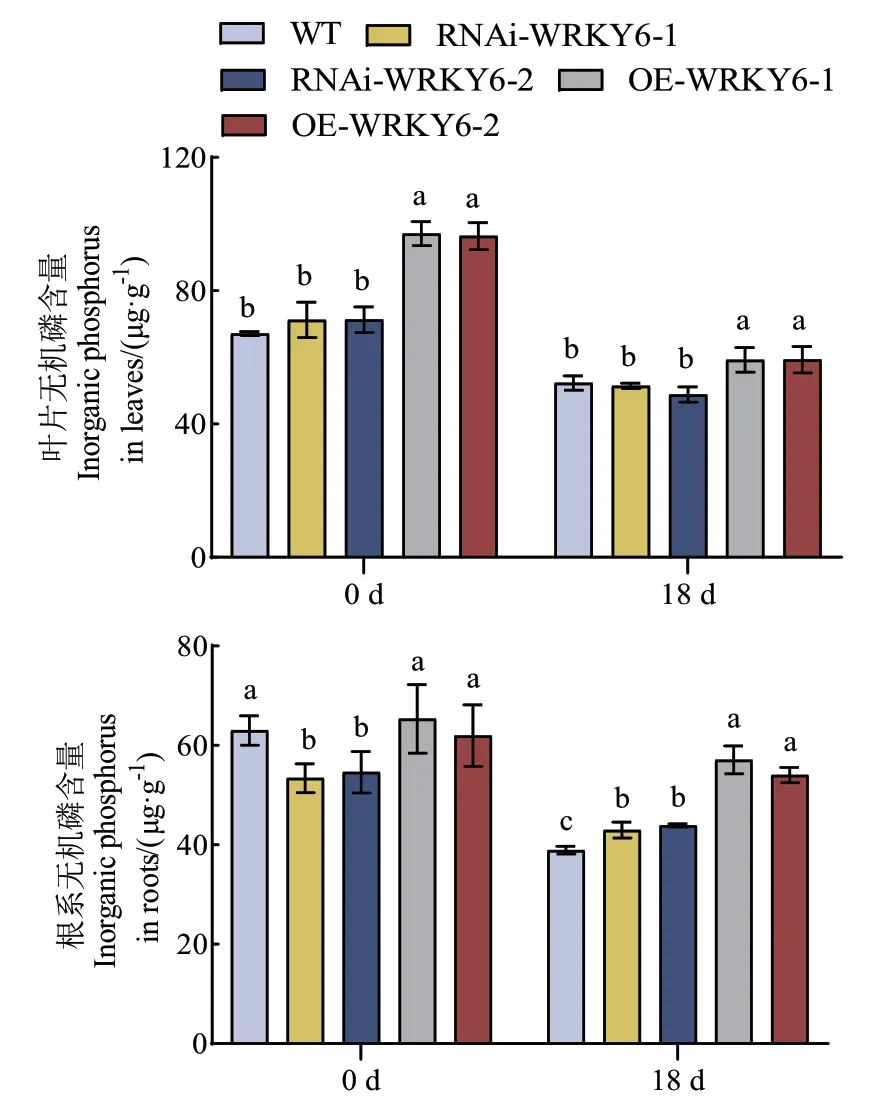
图4 低磷条件下转基因番茄植株RNAi-WRKY6和OEWRKY6无机磷含量的测定Fig. 4 Determination of inorganic phosphorus content in transgenic tomato plants RNAi-WRKY6 and OEWRKY6 under low phosphorus condition
在未处理时,WT和RNAi‑WRKY6叶片与根系的酸性磷酸酶活性显著低于OE‑WRKY6,其中RNAi‑WRKY6‑2根系的酸性磷酸酶活性显著低于OE‑WRKY6‑1,且降低了28.75%。低磷胁迫后,不同基因型番茄幼苗叶片与根系的酸性磷酸酶活性均显著提高,其与处理时间呈正相关关系。在低磷处理18 d时,WT和RNAi‑WRKY6叶片的酸性磷酸酶活性显著高于OE‑WRKY6,而WT和RNAi‑WRKY6根系的酸性磷酸酶活性显著低于OE‑WRKY6。其中与RNAi‑WRKY6‑2相比,OE‑WRKY6‑1叶片的酸性磷酸酶活性显著降低了27.23%;与RNAi‑WRKY6‑1相比,OE‑WRKY6‑1根系的酸性磷酸酶活性显著提高了17.53%(图5)。
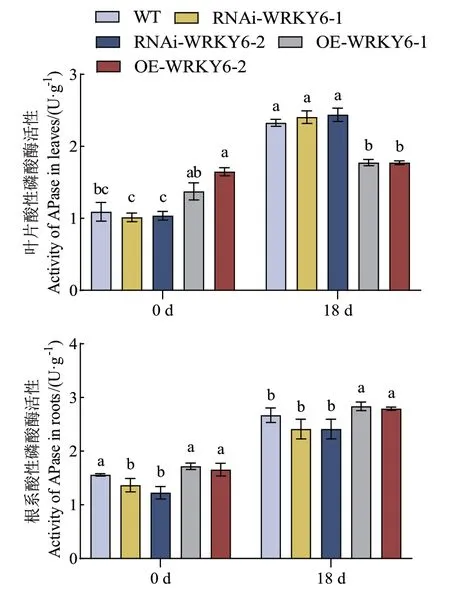
图5 低磷条件下转基因番茄植株RNAi-WRKY6和OEWRKY6酸性磷酸酶活性的测定Fig 5 Determination of acid phosphatase activity in transgenic tomato plant RNAi-WRKY6 and OEWRKY6 under low phosphorus condition
2.2.3 低磷胁迫下不同转基因番茄植株全磷含量的测定 处理0 d时,WT、RNAi‑WRKY6和OE‑WRKY6的叶片全磷含量均无显著差异;处理18 d后,3种基因型番茄植株叶片的全磷含量均呈下降趋势。低磷胁迫下,与RNAi‑WRKY6‑2相比,OE‑WRKY6‑1叶片的全磷含量显著提高了18.50%。处理0 d时,与OE‑WRKY6相比,RNAi‑WRKY6根系的全磷含量均显著提高;在处理18 d后,3种基因型番茄植株的根系全磷含量均呈下降趋势。与WT相比,OE‑WRKY6根系的全磷含量显著提高,OE‑WRKY‑1和OE‑WRKY‑2分别提高了21.23%、23.80%;而RNAi‑WRKY6根系的全磷含量却显著下降,RNAi‑WRKY6‑1和RNAi‑WRKY6‑2分别下降了25.82%、26.71%。在处理18 d后,RNAi‑WRKY6‑2相较于OE‑WRKY6‑2的根系全磷含量降低更为显著,降低了40.80%(图6)。
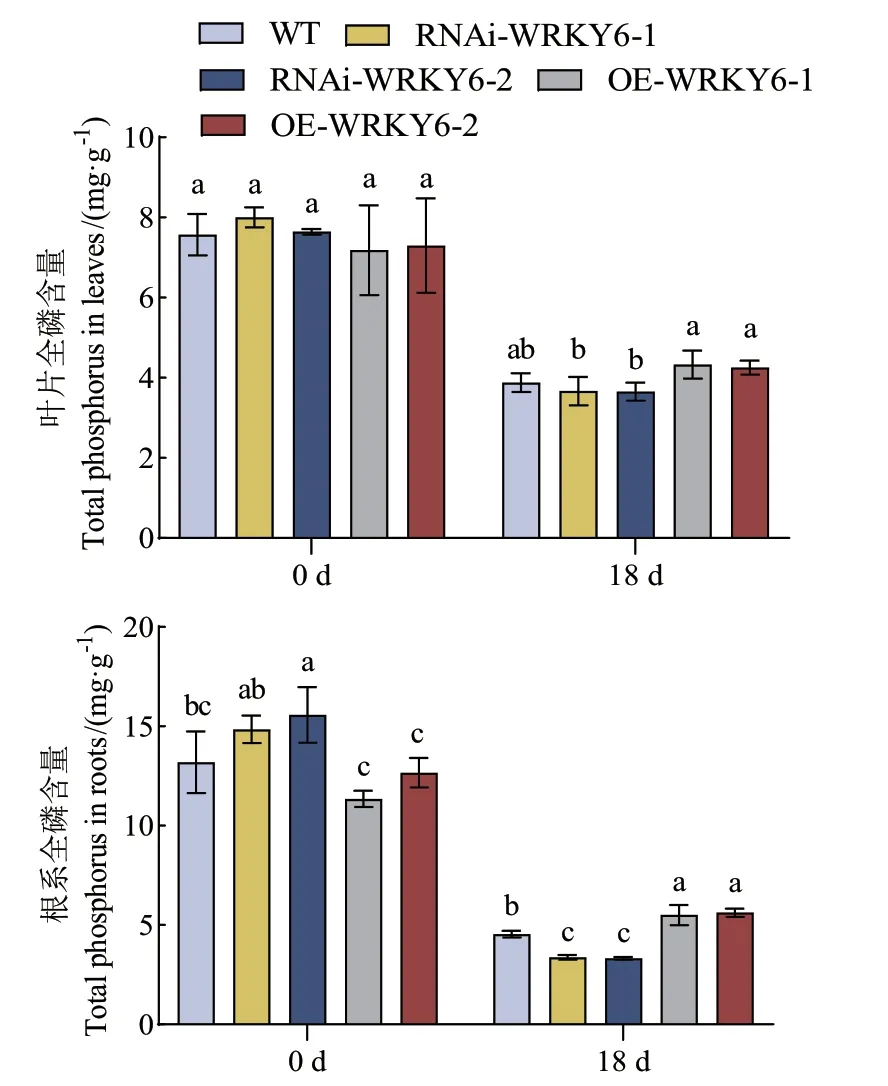
图6 低磷条件下转基因番茄植株RNAi-WRKY6和OEWRKY6全磷含量的测定Fig. 6 Determination of total phosphorus content of RNAi-WRKY6 and OE-WRKY6 transgenic tomato plants under low phosphorus condition
2.2.4 低磷胁迫下不同转基因番茄植株根系有机酸含量的测定 处理0 d时,与WT相比,OE‑WRKY6根系中4种有机酸含量无显著差异,而RNAi‑WRKY6根系中柠檬酸和琥珀酸显著降低,RNAi‑WRKY6‑1和RNAi‑WRKY6‑2分别降低了31.58%、25.34%和34.23%、27.46%。低磷胁迫后,不同基因型番茄幼苗根系中4种有机酸含量大部分都呈下降趋势,只有OE‑WRKY6根系中的琥珀酸含量处理后较未处理前显著增加,其中OE‑WRKY6‑1和OE‑WRKY6‑2分别提高了27.95%和25.23%。在处理18 d时,草酸和琥珀酸的含量在WT和OE‑WRKY6根系中有显著差异。低磷条件下,与WT相比,OE‑WRKY6‑1和OE‑WRKY6‑2根系中草酸、琥珀酸的含量分别显著提高了23.43%、81.77%和23.83%、81.04%。与低磷胁迫后的WT相比,RNAi‑WRKY6‑1中的草酸、苹果酸、柠檬酸和琥珀酸含量分别显著降低了57.56%、57.99%、30.96%、51.59%,RNAi‑WRKY6‑2中的含量分别显著降低了58.90%、63.91%、37.62%、56.56%(表3)。
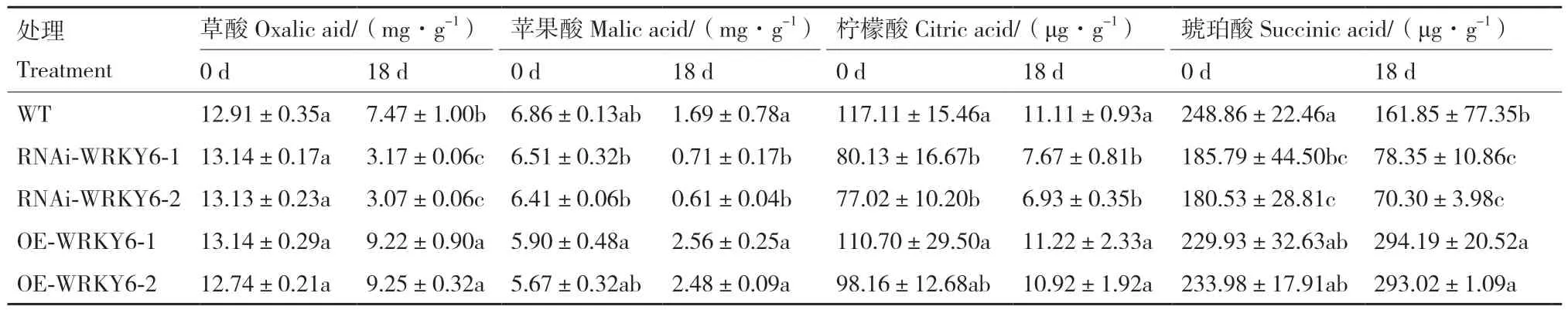
表3 低磷条件下转基因番茄植株RNAi-WRKY6和OE-WRKY6根系有机酸含量的测定Table 3 Determination of organic acid content in the roots of transgenic tomato plant RNAi-WRKY6 and OE-WRKY6 under low phosphorus condition
2.2.5 低磷胁迫下不同转基因番茄植株根系磷转运体表达量的测定 在未处理时,LePT1、LePT2和LePT3在WT、RNAi‑WRKY6和OE‑WRKY6植株中的相对表达量均呈现:OE‑WRKY6>WT>RNAi‑WRKY6;在低磷处理18 d后,LePT2在WT、RNAi‑WRKY6和OE‑WRKY6植株中的表达量相较于0 d时均有大幅度的提高,而LePT3在3种基因型植株中的表达量却均呈下降趋势。与LePT2、LePT3不同,低磷处理18 d后,LePT1的表达量在WT和RNAi‑WRKY6植株中显著增加,呈上升趋势,而在OE‑WRKY6中却显著降低,呈下降趋势(图7)。
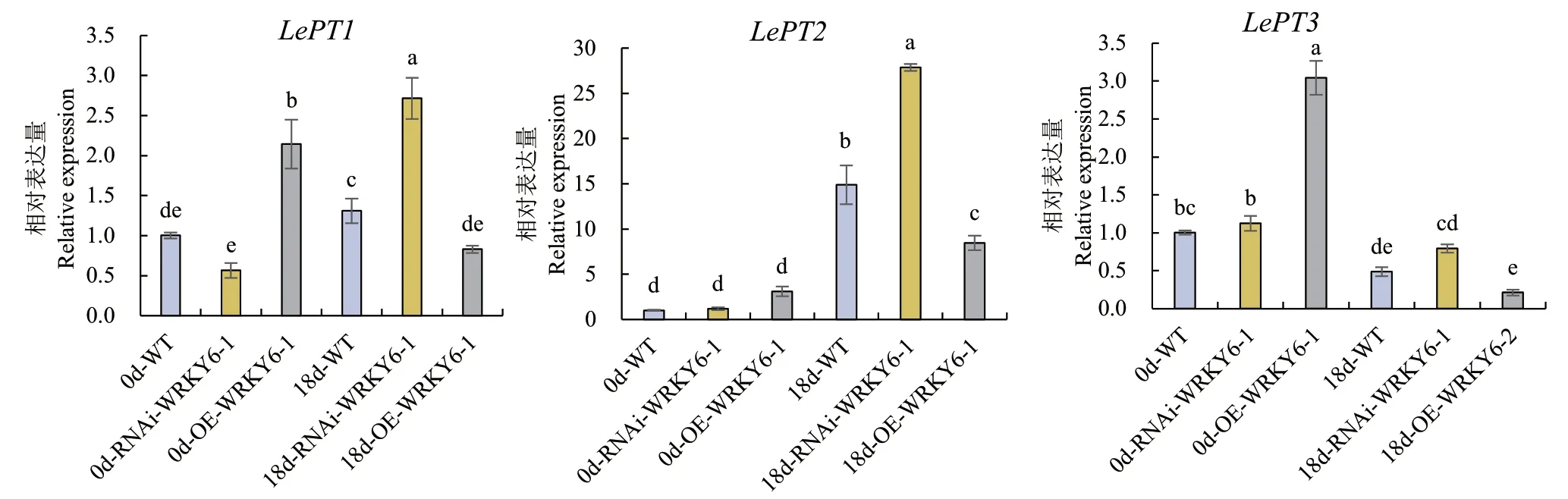
图7 RNAi-WRKY6和OE-WRKY6转基因番茄根系中磷转运体表达量的测定Fig. 7 Determination of phosphorus transporter expressions in the roots of transgenic tomato plant RNAi-WRKY6 and OE-WRKY6
3 讨论
3.1 低磷胁迫下SlWRKY6影响番茄幼苗表型变化和生物量分配
植株表型和生长特性的变化是植株主动适应逆境胁迫最显著的表现。低磷胁迫下,植株会根据外界环境缺磷的程度调节地上部、地下部生物积累量,而根系是最先受到胁迫影响的器官[20]。研究表明,在适应低磷胁迫的过程中,小麦(Triticum aestivum L.)、玉米(Zea mays L.)等作物可通过增强根部能量物质代谢和促进地上部光合产物的转移来维持地上部的生长发育[21]。本研究中,低磷胁迫下过表达植株长势较为粗壮,干扰植株较为细弱;生物量方面更是差异显著,过表达植株的地下部、地上部生物量均显著高于野生型和干扰株系。这说明过表达WRKY6植株具有较强适应低磷环境的能力,可将较多能量物质优先分配到根系,促使根系生长发育,改善根冠结构,从而吸收更多的磷素供地上部正常生长发育[20]。然而当植株体内磷积累较多时,会造成幼苗生长迟缓,部分出现矮化现象。例如,在敲除FvPHO2基因后草莓(Fragaria×ananassa Duch.)叶片中磷含量升高且株高降低,在拟南芥和水稻(Oryza sativa L.)等模式植物中也有此类现象发生。本研究中,低磷胁迫下OE‑SlWRKY6植株叶片与根系的全磷含量显著高于RNAi‑SlWRKY6,导致OE‑SlWRKY6植株矮小粗壮,具有较强适应低磷环境的能力[22]。
3.2 低磷胁迫下SlWRKY6增强番茄幼苗酸性磷酸酶活性和无机磷含量
低磷胁迫下植物为了提高对磷吸收利用的能力,不仅在根系形态结构上产生变化,而且在生理代谢中也会主动提高获得介质中磷素的能力,以缓解低磷胁迫造成的损伤[23]。其中,酸性磷酸酶活性的增加被认为是植物适应低磷胁迫的普遍反应,酸性磷酸酶能将复杂的有机磷化合物水解为可被吸收利用的无机磷,促进有机磷源的再利用,进而提高磷素的利用率[24]。本研究结果显示,番茄植株中酸性磷酸酶活性变化与其他植株类似,受低磷信号诱导而升高,低磷胁迫下野生型、过表达、干扰植株中根系与叶片酸性磷酸酶活性均逐渐增加,表明低磷环境下植物体内的酸性磷酸酶直接参与了植物体内各种磷化合物的再利用。由于基因型不同,低磷诱导的酸性磷酸酶活性也存在较大差异[25]。当磷正常培养时,不同基因型植株体内均积累了较多的无机磷,其中OE‑SlWRKY6植株中无机磷含量最高且酸性磷酸酶活性最强,而在转移至低磷处理18 d后,由于OE‑SlWRKY6植株前期未胁迫时自身储备较多无机磷且叶片有较强的磷储存能力,因此过表达株系中叶片的酸性磷酸酶活性较低、变化幅度较小。但随着植株体内积累无机磷的逐渐消耗和外界环境中较少的磷素供应,强烈的低磷信号触发了根系适应低磷胁迫的机制,最终引起根系酸性磷酸酶活性的升高。其中,在低磷胁迫下OE‑SlWRKY6植株根系的酸性磷酸酶活性最高,表明OE‑SlWRKY6植株根系能有效促进有机磷化合物水解,将水解得到的无机磷转运到地上部分,从而提高磷的吸收利用率。综上可得,低磷胁迫下过表达株系酶活的增加幅度、活性以及无机磷含量远远高于野生型和干扰株系,表明SlWRKY6超量表达能提高体内酸性磷酸酶活性,有机磷库中磷脂等有机物的磷素会被高活性的酸性磷酸酶高效水解活化,产生更多的无机磷应对低磷胁迫,有效提高植株磷的再利用效率,缓解植株缺磷的状况,保证其正常生长发育。因此,过表达SlWRKY6在低磷胁迫下,对磷的循环利用具有明显的优势,是其有效应对低磷胁迫中的一个重要机制。
3.3 低磷胁迫下SlWRKY6增强番茄幼苗根系的有机酸含量
外界不利的环境因素和植物体内养分的丰缺,都能一定程度上影响有机酸的合成和积累[26]。有机酸作为三羧酸循环的主要产物,也是植物体物质和能量代谢的重要中间产物,不仅可以反映植物的磷素吸收、运输、积累等代谢过程,而且在应对营养胁迫中扮演着重要角色[27]。本研究中,低磷下番茄根系除琥珀酸外,其余3种有机酸含量均显著下降,这是由于已适应低磷环境的番茄根系对有机酸的合成和积累表现出明显的抑制作用[28]。OE‑SlWRKY6植株根系的4种有机酸含量均显著高于RNAi‑WRKY6株系,说明低磷胁迫下,OE‑SlWRKY6植株通过提高根系有机酸的合成能力以适应低磷胁迫。有研究表明,酸性磷酸酶活性与有机酸含量呈正相关关系[29],本研究中低磷胁迫下OE‑SlWRKY6植株根系的酸性磷酸酶活性和有机酸含量均最高,更加充分验证SlWRKY6超表达后可提高植株对低磷胁迫的适应性。苹果酸是过表达株系与干扰株系中含量差异较为悬殊的有机酸之一,其不仅能活化难溶性磷酸盐释放无机磷,还能作为渗透调节物质提高细胞液浓度,在增强植株抗逆性方面发挥作用;这也充分印证了OE‑SlWRKY6植株在应对低磷胁迫时自身具有较高的适应性[30]。TCA循环中琥珀酸主要是由琥珀酰CoA受琥珀酰CoA合成酶催化生成的,这一过程中同时还生成了GTP或ATP,因此其也是TCA循环中唯一一次底物水平磷酸化[31]。OE‑SlWRKY6植株根系在低磷胁迫后琥珀酸含量显著增加,而野生型与RNAi‑WRKY6的含量显著降低,与此同时,OE‑SlWRKY6植株细胞能量状态指示剂ATP也会随之增加。植物体代谢过程中的细胞高能状态指示剂除ATP外还有NADH和柠檬酸等,他们能反映出植物体在应对不良外界环境时自身能量充足或匮乏的状态[32]。低磷胁迫下,过表达SlWRKY6植株根系中柠檬酸的含量也是3种基因型中最高的,表明OE‑SlWRKY6株系在外界磷供给不足时,自身具有强大的能量代谢循环系统和适应低磷胁迫机制,通过协同调控根系有机酸的合成来保证植物体正常的能量供给,进而适应低磷胁迫。
3.4 低磷胁迫下SlWRKY6影响番茄幼苗根系磷转运体的表达
研究表明,外界磷素供应浓度可直接影响植株体内的磷素水平,进而诱导磷转运蛋白的表达,而磷转运蛋白的转录调控直接或间接地调控着磷的获得,对植株在低磷条件下生理代谢平衡起着重要作用[33]。当外界磷素供应不足时,植株自身进化出一系列生理生化机制实现磷的活化、转运以及再利用,例如大分子物质核酸、磷脂中的有机磷被酸性磷酸酶等水解活化、液泡中暂储多余的无机磷被转运以及营养器官中活化的无机磷被转运到新生长中心再利用[34]。高亲和磷转运体在介导这些植株磷素吸收运输过程中发挥着重要的作用,研究表明低磷下,番茄植株中负责体内磷素转运分配的LePT1和负责根系吸收磷素的LePT2表达量均显著增加[35],与本研究结果一致,低磷胁迫后,野生型和RNAi‑SlWRKY6根系的LePT1、LePT2表达量显著升高进而提高磷的吸收利用率,但过表达植株根系中的LePT1、LePT3的表达量却在低磷胁迫后显著降低。这是由于过表达植株在正常条件下,根系磷转运体表达量和酸性磷酸酶活性较高,能水解出较多的无机磷供利用,且自身有较充足的无机磷储备。因此,OE‑SlWRKY6植株在面临低磷胁迫时体内的磷素水平所受影响较小,其根系与叶片的全磷含量显著高于野生型和RNAi‑WRKY6植株,同时也表明过表达植株内部具有高效调节利用磷素机制可有效应对低磷胁迫的发生。有研究证实,WRKY21和WRKY108可作为磷饥饿条件下植株自身的转录调节器,与OsPht1;1的W‑box区域结合,正向调控植株耐低磷性[13]。这与本研究中WRKY6基因相对表达量较高的植株具有较强吸收、转运和再利用磷酸盐能力的表现一致,但WRKY6是否直接调控PHT家族基因的表达,进而对番茄植株磷素稳态产生影响仍有待进一步试验验证。最终可得,低磷条件下过表达SlWRKY6基因能增强番茄植株的耐低磷性,提高磷的再活化、再转运和再利用,缓解外界磷素供应不足造成的损伤。该研究也为进一步揭示番茄根系适应低磷胁迫的分子机制提供了重要理论依据。
4 结论
番茄中WRKY6基因在响应低磷胁迫过程中起着重要作用,其可通过增强酸性磷酸酶活性、提高有机酸合成量和改善根系与叶片磷素转运分配等途径,增强番茄植株对外界磷素的吸收和体内磷营养的重分配再利用,最终实现磷的高效吸收利用。
