FACS技术在酶定向进化中的应用
2023-11-23刘金升陈振娅霍毅欣郭淑元
刘金升 陈振娅 霍毅欣 郭淑元
(北京理工大学生命学院,北京 100081)
流式细胞术(flow cytometry,FCM)是一种广泛应用于生物学、医学和药物研发等领域的重要技术。FCM可以快速、高通量地分析溶液中的单个细胞,并且能同时获取多个参数信息,例如细胞大小、形态、表面标记、代谢状态、DNA含量等。这些信息对于了解细胞的生物学特性、疾病发生机制、药物筛选和疗效评估等都具有重要的意义。目前,FCM与质谱、显微成像等技术结合,形成了多种功能的组合技术,已广泛应用于免疫学、分子生物学、细菌学、病毒学、癌症生物学和传染病监测等领域[1-7]。其中,荧光激活细胞分选术(fluorescence‑activated cell sorting,FACS)是基于FCM建立的一种可以实现荧光标记单细胞分选的技术[8]。
由于温度、pH和溶剂稳定性,以及底物特异性和活性的限制,天然酶通常不是工业生产的最佳选择。定向进化是改善酶催化活性和热稳定性的常用方法[9-10],利用易错PCR等技术[10-12]能够大量增加目标酶基因的多样性,例如,对一个酶的5个氨基酸进行饱和突变,其理论突变文库大小能达到205,那么如何从此大型文库中获得目标单一突变体是关键问题。如果利用传统微孔板筛选[13],需耗费大量的成本和时间,因此高通量筛选方法在酶定向进化中显得尤为重要。
近几年来,具有高通量、耗费低、误差小、精度高等优势的FACS,已经广泛应用于大型突变文库的筛选,其筛选通量从传统筛选方法的1/s提高到104/s[8],并且在筛选流程中的培养基消耗量相较于传统筛选可以忽略不计。利用传统微孔板筛选约105大小的突变库,至少需要104mL培养基,而FACS仅需数毫升。同时,FACS可以减少培养过程中人工干预所带来的误差,并且相较于传统酶标仪检测具有更高的荧光检测精度。由此,本文首先概述了FCM的发展历程和原理,并简述了基于FACS技术建立的流式细胞分选仪。随后,详细讨论了FACS在酶定向进化中的应用现状及局限,并展望了FACS在该领域中的发展方向和前景。
1 FCM和FACS
1.1 FCM的发展及应用
FCM是一种用于分析、计数、分类单个细胞的技术,具有高分辨率、高通量和多参数分析等优点,广泛应用于生命科学领域,例如免疫学、细胞学、肿瘤学、生殖学、遗传学、神经科学等。其发展历史可以追溯到20世纪50年代,主要经历了3个阶段。早期流式细胞术:FCM主要被用于血细胞计数。1969年,Leonard Herzenberg和他的团队成功地使用基于FCM搭建的流式细胞仪对免疫细胞进行分析,主要使用光散射和荧光染色等技术来对细胞进行分类和计数,证明了FCM在免疫学研究中的潜力[14]。多参数流式细胞术:在20世纪80年代和90年代,随着荧光染料和光学检测技术的发展,FCM实现了多参数分析[15]。现代流式细胞术:随着20世纪末期和21世纪初期生物技术的迅速发展,FCM开始往单细胞基因表达分析[16]、细胞分选[17]和多模态成像[18]等方向发展,并衍生出光谱流式细胞术[18]、成像流式细胞术[19]和质谱流式细胞术[20]等技术。
FCM在全血细胞计数[21]、循环肿瘤细胞检测[22]、荧光原位杂交[23]、抗原检测[24]和细胞增殖和凋亡测定[25]等领域有着广泛的应用[26-27]。目前,基于FCM开发了各种市场化的流式细胞仪,主要分为有声聚焦流式细胞仪、细胞分选仪、成像流式细胞仪、质谱流式细胞仪、全光谱流式细胞分析仪、基于微珠矩阵分析细胞仪和纳米流式细胞仪等[27-33]。
1.2 FACS的原理及相关仪器
1.2.1 FACS的原理 FACS的基本原理是单个细胞依次通过一个细管,并对携带荧光信号的细胞进行定量检测、数据分析和细胞分选[8]。主要流程包括:(1)样品制备,制备单细胞悬液;(2)标记细胞,利用荧光染料标记单细胞;(3)信号检测,通过流式细胞仪获取前向散射光(forward scatter,FSC)、侧向散射光(side scatter,SSC)和荧光信号等数据;(4)分析和数据处理,电子器件对检测到的信号进行处理,将其转换成数字信号,计算机软件对数字信号进行分析和处理,例如数据统计、细胞计数、细胞排序和可视化显示等;(5)细胞分选,对细胞群体进行数据分析后,可依据荧光信号强度或细胞大小等选择性地对包裹单细胞的液滴进行加电,并通过电场力的作用收集单细胞到指定容器中。
1.2.2 荧光信号 FACS依赖于荧光信号,荧光是一种光致发光的现象,即某种物质经入射激光(激发光)照射后,吸收光能并瞬间进入激发态,随后立即退出激发态并发射出比激发光波长长的发射光,该发射光的波段通常为可见光。计算机软件将检测到的荧光信号数字化,这些数据用于分析细胞的荧光特性,例如荧光强度的分布、荧光峰值的位置和形状等。
通常,可采用如下方法使细胞携带荧光信号:荧光染料染色、表达荧光蛋白和添加荧光标记底物。常用荧光染料包括小分子有机染料[34]、量子点[35-36]、藻胆蛋白[37]和荧光示踪染料(核酸染料、细胞质染料和膜结合染料)[17]等。细胞表达的不外泌荧光蛋白包括蓝色荧光蛋白(BFP)、青色荧光蛋白(CFP)、绿色荧光蛋白(GFP)、黄色荧光蛋白(YFP)、红色荧光蛋白(RFP)及其各种衍生物,如eGFP、Super‑folder GFP、eCFP和eYFP等[38]。添加可溶性荧光标记底物的方法主要包括:首先将底物进行荧光标记,随后通过液滴微流控芯片将荧光标记底物和细胞一起封装在均匀分散的液滴内,每个液滴的体积及其内部的荧光标记底物浓度均是相同的。细胞表达的酶可将荧光标记底物转化为荧光产物来作为细胞的荧光信号[39-40]。
1.2.3 流式细胞分选仪 流式细胞分选仪是一种基于FACS技术而设计的单细胞分析和分选设备,其已广泛应用于生物学、医学和生物技术领域。该设备能够快速地分析细胞或颗粒的多个参数,包括大小、复杂度、表面标记和荧光信号等,以获取大量的细胞特征信息。流式细胞分选仪的工作原理是利用细胞或颗粒在鞘液中流动时,通过检测激光照射后发射出的荧光信号和散射光信号来识别和分析细胞或颗粒的特征,通过计算机控制选择性地收集具备一定特征的目标细胞。流式细胞分选仪的基本组成部分包括液流系统(产生单液滴)、光学系统(信号检测)、电子控制系统(分选细胞)和计算机系统(分析信号数据)等。
2 酶定向进化
天然酶具有丰富的结构和生化特性,但由于其催化性能的局限性,导致仅有少部分天然酶能直接用于工业生产[40-41]。为了提高天然酶的催化性能,扩大其工业生产范围,定向进化方法应运而生,利用此方法可以改善酶的耐受性、特异性和稳定性等[42],以适应工业生产。定向进化主要有3个步骤:(1)构建突变文库。通过随机突变、定点突变、饱和突变和DNA重组等技术手段[10-12]对目标酶基因造成大量突变,以此构建目标酶基因的突变文库;(2)筛选突变文库。利用特定的筛选方法对具有一定表型的突变体进行高通量筛选,例如荧光信号、吸光度等;(3)迭代。将回收的优势突变体再次构建突变文库,并筛选突变文库,这种循环迭代的方法能够提高酶定向进化的效率。
目前,主要用于酶定向进化的筛选方法有平板或微孔板、FACS[8]和荧光激活液滴分选(fluorescence‑activated droplet sorting,FADS)[43]等技术。相较于平板或微孔板筛选,FACS和FADS不仅具有通量更高的优点,同时具有培养体系简便、培养基使用量少、选择压力均衡等优势。例如,在构建文库后可直接混合宿主细胞进行培养,无需建立单个突变体的单反应培养体系,而且每个突变体受到的选择压力是完全相同的,极大减少了人工干预造成的误差。FACS和FADS在鞘液、分选方式和假阳性方面存在一些差异。FACS是使用经0.22 μm滤膜过滤后的PBS或蒸馏水作为鞘液,无法使用腐蚀性或黏稠性液体作为鞘液,而FADS通常使用黏性较大的油作为鞘液。FACS主要通过对包含细胞的液滴加电,随后在电场力的作用下将细胞收集到指定容器中来实现细胞分选,而FADS则是在液滴流动通道的一侧利用介电泳力来实现细胞分选。当将荧光产物固定在细胞表面时,由于FACS分选前细胞是混合培养的,存在荧光产物可能会转移到其他细胞表面的风险,容易产生假阳性结果,而FADS采用液滴间隔单细胞培养的方法,极大地降低了假阳性的风险。本文总结了定向进化中的传统筛选(平板、微孔板)、FACS和FADS筛选方法的通量、突变文库大小、优缺点等信息,如表1所示。

表1 筛选方法比较Table 1 Comparison of screening methods
FACS应用于酶定向进化的主要流程如图1所示[8,52]。首先,需构建含有目标酶基因的质粒突变文库,并通过荧光标记底物、生物传感器偶联酶自产荧光蛋白等建立荧光表型,然后将质粒文库转化进宿主细胞中,如大肠杆菌(Escherichia coli)、酵母细胞(Saccharomyces cerevisiae)、杆状病毒、哺乳动物细胞等;随后,培养宿主细胞以产生荧光信号表型;最后,利用FACS对有荧光信号表型的宿主细胞进行高通量筛选,基于荧光强度的高低分选目标宿主细胞,对分选得到的目标宿主细胞进行富集培养,测序验证目标酶的突变位点,同时可进行重复分选或定向进化。本文以大肠杆菌自产GFP荧光蛋白为例,说明FACS在酶定向进化中的应用原理(图1),详细荧光信号表型在下文中概述。
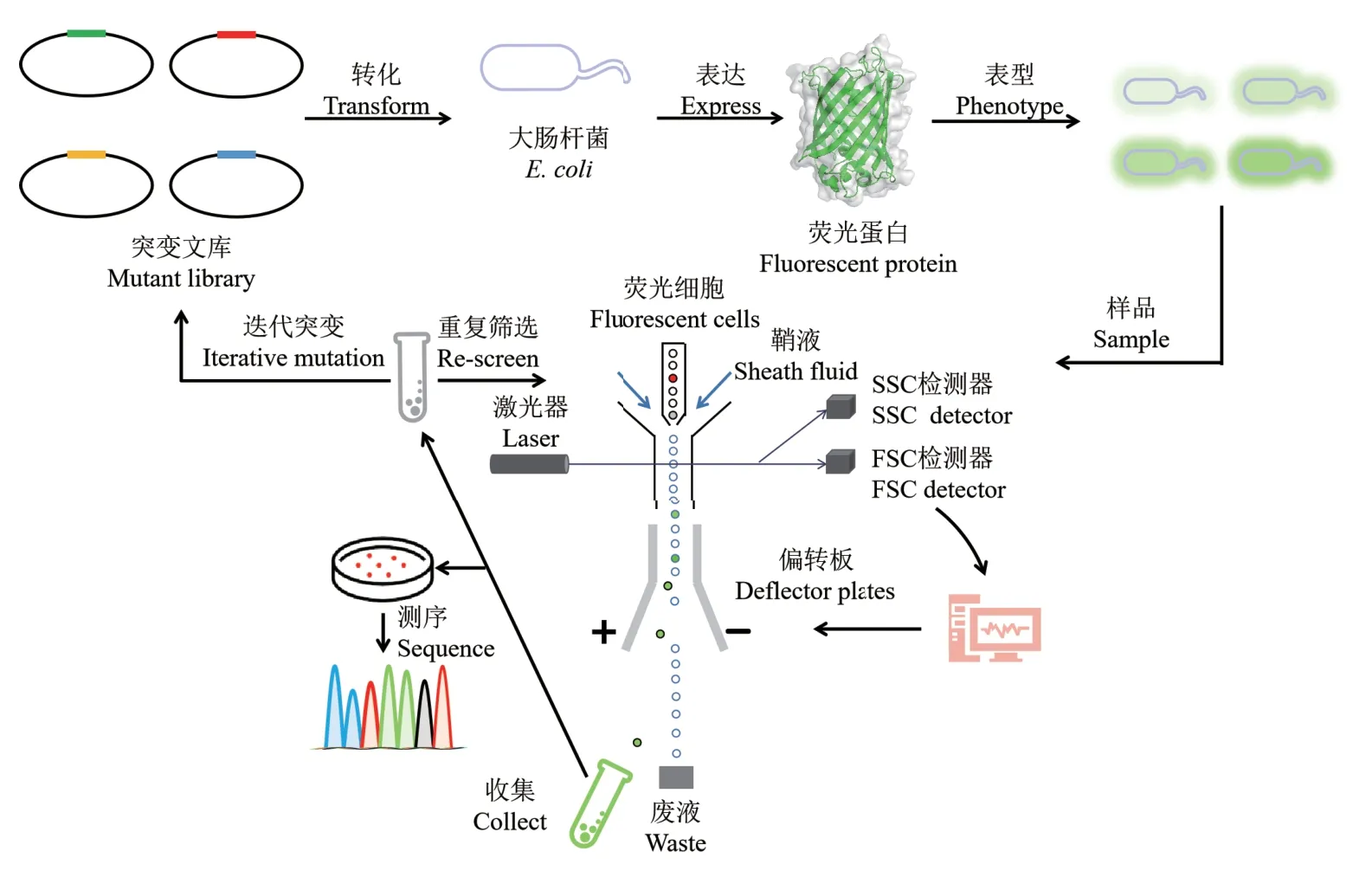
图1 FACS与酶定向进化的结合Fig. 1 Incorporation of FACS and directed evolution of enzyme
细胞表达酶后,酶的位置可以分布在细胞表面、细胞内和细胞外,分别形成细胞表面酶、胞内酶和分泌酶,如何将不同位置酶的活性与荧光信号偶联是FACS进行高通量筛选的关键问题,同时为提高单细胞荧光信号检测的准确性,需保证突变文库中不同细胞的荧光信号互不干扰。本文将从细胞表面酶、胞内酶、分泌酶与荧光信号的偶联关系出发,阐述了FACS高通量筛选的设计原则,并列举相关应用实例。
3 FACS在非分泌酶定向进化中的应用
在非分泌酶(细胞表面酶和胞内酶)的定向进化筛选中,基于酶的存在位置和荧光信号来源,可以将其筛选分为3种方式:第1种是荧光标记底物(如荧光素、BODIPY、香豆素等荧光基团[53])筛选细胞表面酶,此方法的目标酶通常暴露于细胞表面,其催化底物后产生的荧光产物会通过静电力作用、共价或非共价键的方式保留在细胞表面;第2种是荧光标记底物筛选胞内酶,此方法的目标酶存在于细胞内,其荧光产物不能扩散出细胞;第3种是生物传感器筛选胞内酶,此方法通过使用对底物或产物有响应的生物传感器,并由此驱动荧光蛋白表达,通过检测荧光强度来衡量目标酶活性,本文主要以转录因子调控的生物传感器举例。因此,对于非分泌酶的突变文库筛选,FACS可直接对单细胞进行多指标评价,然后将符合一定指标数值的细胞挑选出来。在筛选前无需对样品进行特殊处理,仅稀释到合适浓度即可。一般情况下,生成封装单细胞液滴的缩流管(喷嘴)的孔径应大于细胞颗粒直径的5倍,同时需根据缩流管的堵塞情况来调节鞘液流速和样品稀释倍数。基于FACS筛选细胞表面酶和胞内酶的应用实例如表2所示。

表2 FACS在非分泌酶中的应用Table 2 Application of FACS in non-secretory enzymes
3.1 荧光标记底物筛选细胞表面酶
细胞表面酶是一类嵌入细胞膜中的酶,具有广泛生物学功能。FACS筛选细胞表面酶的主要步骤包括:首先将荧光标记基团结合到底物上,制备出荧光标记底物,并将其结合到细胞表面,表面酶催化荧光标记底物后释放的荧光基团被保留在细胞膜上,以此通过荧光强度来表征目标酶的活性;随后,通过FACS检测荧光信号并筛选出具有特定功能的突变体;最后,通过DNA测序确定优势突变体的突变位点,具体流程如图2‑a所示[31,69]。目前,此方法已经实现多种细胞表面酶的筛选。例如,Olsen等[54]设计了具有Arg‑Val切割序列的FRET‑肽底物,此底物携带正电荷,能够吸附在带负电的细胞膜表面,经丝氨酸蛋白酶OmpT裂解后可释放带正电的荧光产物,此产物同样会吸附在细胞表面。此研究利用该机制,通过FACS筛选了大小为6×105的OmpT酶突变文库,并获得了催化活性比野生型高60倍的OmpT突变体。Chen等[55]通过整合酵母表面展示和酶介导的生物偶联技术,并结合FACS建立一种用于分选酶A定向进化的高通量筛选方法。通过FACS成功地实现分选酶A转肽活性的6 000倍富集,证明了此方法的实用性。同时利用FACS筛选大小为7.8×107的分选酶A突变文库,并获得了相对于野生型分选酶A催化活性提高140倍的分选酶A突变体。
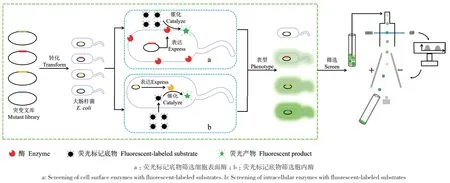
图2 FACS筛选非分泌酶Fig. 2 FACS screening of non-secretory enzymes
在FACS高通量筛选细胞表面酶的方法中,一般使用FRET技术[52]将荧光基团标记后的荧光底物保留在细胞膜上,酶催化释放后的荧光基团能够保留在细胞表面,从而构建基因型与表型的联系,但该方法仍有技术局限,例如,FRET标记后的底物有可能会影响酶的催化活性;细胞膜上的荧光信号容易发生漂移;适合荧光标记底物的酶大多为水解酶和氧化还原酶。
3.2 荧光标记底物筛选胞内酶
胞内酶是不分泌到细胞外的一类酶,其作用是催化和调节细胞内的代谢和信号传递过程。胞内酶可分为多种类型,例如水解酶、氧化还原酶、脱羧酶、转移酶等,还有一些重组酶、荧光蛋白、丝氨酸蛋白酶等外源基因表达的酶,不同类型的酶参与不同代谢途径和信号转导通路,具有重要生物学功能。
利用荧光标记底物筛选胞内酶,首先需要将荧光标记结合到底物上,随后将荧光标记的底物添加到培养基中,荧光标记底物进入细胞后,被胞内酶催化生成带有荧光的产物或与胞内酶结合,形成荧光标记的胞内酶复合物,产物或复合物无法扩散出细胞,通过荧光信号检测,筛选出具有特定功能的突变体,如图2‑b。目前,已有研究应用该方法对多种胞内酶实现了定向进化。例如,Yang等[57]利用FACS对中性糖转移酶β-1,3‑半乳糖基转移酶(CgtB)的突变文库(>107)进行了筛选,使用两种荧光基团(绿色荧光基团和蓝色荧光基团)来标记底物(GalNAc类似物),分别获得绿色荧光标记底物和蓝色荧光标记底物,这两种底物可以自由穿过细胞膜。这两种荧光标记底物进入细胞后,会被胞内CgtB催化产生的相应产物,这些产物无法进出细胞,通过检测细胞的绿色荧光和蓝色荧光来判断CgtB的催化活性高低,从而进行后续的检测和筛选。最终,通过FACS筛选获得了比天然CgtB活性提高了300倍的突变体。Kovačević等[61]通过酪酰胺荧光标记和酵母增强型GFP(yGFP)来量化葡萄糖氧化酶的催化活性,yGFP具有保留在酵母细胞表面的特性。在对葡萄糖氧化酶突变文库进行FACS筛选后,获得了两个相较于野生型葡萄糖氧化酶催化活性分别提高1.3和2.3倍的葡萄糖氧化酶突变体。Meister等[64]设计了一个N端为Aβ1‑42肽,中间是一个蛋白酶裂解位点,C端是增强型绿色荧光蛋白(eGFP)的报告蛋白,此报告蛋白能够被3C蛋白酶裂解从而释放eGFP产生荧光信号,且酶活与荧光强度成正比。基于该方法,通过FACS从大小为2.3×107的3C蛋白酶突变文库中获得了对底物LEVLFQ↓GP分解活性提高4倍的3C蛋白酶突变体。
基于荧光标记底物的FACS高通量筛选方法虽然简单易行,但其存在荧光标记底物和荧光产物限制的问题。首先,酶促反应底物需要具有可自由渗透细胞的特性。其次,酶对于荧光标记底物的催化性能可能会降低,容易出现假阴性的问题。最后,酶促反应生成的荧光产物应无法扩散至胞外。然而,仅有少量符合这些要求的荧光标记底物和荧光产物,因此需根据实际需求人工设计合理的荧光标记底物。
3.3 生物传感器筛选胞内酶
利用生物传感器筛选胞内酶是通过构建响应底物或产物的生物传感器,利用生物传感器驱动荧光蛋白表达来衡量目标酶的活性高低。常见的有转录因子调控和核糖开关调控的生物传感器,本文以基于转录因子的生物传感器为例,目标酶的底物或产物首先结合转录因子,形成复合体,复合体结合到荧光蛋白基因的启动子上游序列,激活荧光蛋白的表达,荧光蛋白表达量通常与底物或产物浓度成正比,底物和产物浓度的变化直接反映出酶活性的变化[70],基于此,实现后续的FACS筛选步骤,如图3[31,69]。基于生物传感器,FACS已实现对多种胞内酶的筛选。例如,Della等[62]对转录因子LysG进行了半理性设计,获得了LysG突变体,此突变体不与L‑赖氨酸结合,但对L‑组氨酸和L‑精氨酸有显著结合能力。随后,利用LysG突变体构建了生物传感器pSenHis,LysG突变体与L‑组氨酸或L‑精氨酸结合后,能够激活相应启动子,驱动荧光蛋白EYFP的合成,由此在细胞内建立荧光筛选标记,可用于胞内酶的高通量筛选。基于此,利用FACS从107个化学诱变的谷氨酸棒状杆菌突变文库中筛选获得了多个高产L‑组氨酸的突变株,其中217个突变株可生产超过0.1 mmol/L L‑组氨酸。通过测序发现所有突变株在编码ATP‑磷酸核糖转移酶的hisG基因上都发生了突变。Michener等[65]开发了能够响应代谢物茶碱的RNA开关调控的生物传感器,此生物传感器表达产生GFP作为荧光信号,在酿酒酵母体内咖啡因可被咖啡因去甲基化酶分解产生茶碱,从而激活RNA开关表达GFP。基于此方法,通过FACS筛选获得了酶活提高33倍和底物专一性提高22倍的咖啡因去甲基化酶突变体。Zhang等[68]使用响应L‑丝氨酸的转录因子NCgl0581,此转录因子可启动增强型黄色荧光蛋白(eYFP)的表达作为荧光信号,并结合FACS建立L‑丝氨酸生产菌株的高通量筛选体系。此研究首先对谷氨酸棒状杆菌进行常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变建立突变文库,随后使用FACS筛选此突变文库,最终获得了一株L‑丝氨酸高产菌株A36‑pDser,其L‑丝氨酸产量达到34.78 g/L,相对于出发菌株的提高了35.9倍。
基于生物传感器的高通量筛选方法依赖于生物传感器。生物传感器是一种灵敏度高、特异性强、可重复性高且能够实时监测的筛选工具,尤其对于低表达量的酶,能明显降低假阴性的发生概率。但目前适用于酶筛选的天然生物传感器数量有限且特异性不高,而且在底物和产物的结构变化很小时无法区分底物和产物,导致高通量筛选中可能会出现假阳性。为了解决这些问题,需从启动子、转录因子或DNA 结合位点等方面改造生物传感器,以使其具有更高的特异性和灵敏性。
4 FACS在分泌酶定向进化中的应用
传统筛选分泌酶的方法主要有微孔板筛选和平板筛选,这些方法设备相对便宜,操作简单。平板筛选主要是在培养平板上添加底物,随着培养时间的增加,细胞分泌目标酶到平板上,菌落周围会呈现出区别于普通菌落的颜色或荧光。平板筛选具有材料成本低和快速筛选的优点,但其通量低,能够筛选的突变体数量少,菌落颜色比较仅是一种定性和半定量分析,人工误差大[45]。微孔板筛选是挑取每一个突变体菌落至微孔中培养,培养至一定时间后裂解细胞释放酶并添加底物,随后对产物进行检测。微孔板筛选相较于平板筛选,有更宽的动态范围,在定量分析上优于平板筛选。但其也有通量低、操作繁琐、材料成本高、设备昂贵的缺点。微孔板筛选还存在一些局限性。首先,由于微孔的体积和表面积有限,通气性差,不适用于需要长时间生长或需要复杂培养条件的菌株。其次,由于每个微孔中只能容纳有限数量的细胞,对于某些低表达量的酶,可能会出现假阴性的情况。分泌酶的FACS筛选,具有通量高、易定量、操作简单、材料成本低的优点,突破了传统方法的局限,在分泌酶定向进化领域具有巨大的潜力[13]。目前,常用双乳化液滴法和水凝胶微珠法来辅助FACS筛选分泌酶,生成液滴的方法通常为:T型通道法、流动聚焦法和共流聚焦法等[71]。为符合大多数流式细胞分选仪对分析和分选颗粒的标准直径要求,这两种方法应控制生成的液滴或微珠直径约为50 μm左右[71-73]。基于FACS的分泌酶筛选实例如表3所示。

表3 FACS在分泌酶中的应用Table 3 Application of FACS in secretory enzymes
4.1 双乳化液滴法
该方法主要使用液滴微流控芯片通过油(矿物油、氟化油和植物油等)包水的方式将荧光标记底物和表达酶突变体的细胞共同封装在一起,在外部进行培养后使用微流控芯片以水为流动相去包裹上述的油包水液滴,从而形成水包油包水的双乳化液滴,具体流程如图4‑a[76]。双乳化液滴的最外层是水相,因此FACS可直接筛选此双乳化液滴,从而能够从数百万甚至更多的突变体文库中快速、定量地分离目标突变体。Bernath等[83]率先证明了双乳化液滴可在FACS上分选并能够实现正确结果的富集。Aharoni等[74]构建了包含超过107个表达血清对氧磷酶(PON1)突变体的大肠杆菌文库,这些突变体被封装在双乳液中,通过FACS筛选,获得了活性提高100倍的PON1突变体。Menghiu等[77]在大肠杆菌中建立几丁质酶A的突变文库,几丁质酶A可分解底物4‑甲基伞形酮基β-d‑N, N′, N′‑三乙酰基壳三糖苷为4‑甲基伞形酮,此产物在激发光波长为365 nm下发射出波长为460 nm的信号,以此衡量几丁质酶A的活性。最终,通过FACS筛选几丁质酶A突变文库,获得了12个酶活提高两倍的几丁质酶A突变体。

图4 FACS筛选分泌酶Fig. 4 FACS screening secretases
双乳化液滴法具有高稳定性、高可控性、可重复性强的优点,有助于保持液滴内酶的活性和稳定性,通过控制液滴尺寸可提高筛选效率。双乳化液滴存在以下限制:因双乳化液滴不如单乳化液滴稳定,因此需要在第二次包埋液滴时平衡流动相和分散相的流速以及表面张力等参数以生成稳定、尺寸均一和单分散性好的双乳化液滴;虽然液滴之间的体系是相对封闭的,但当参与反应的底物或产物具有挥发特性时,双乳化液滴的定量分析将会受到干扰。
4.2 水凝胶微珠法
利用液滴微流控技术可生成各种形状的微凝胶体,包括中空和圆柱形凝胶纤维、球体、圆盘和胶囊(核-壳结构)等。常用的水凝胶分为两类:天然水凝胶和合成水凝胶,如表4所示。
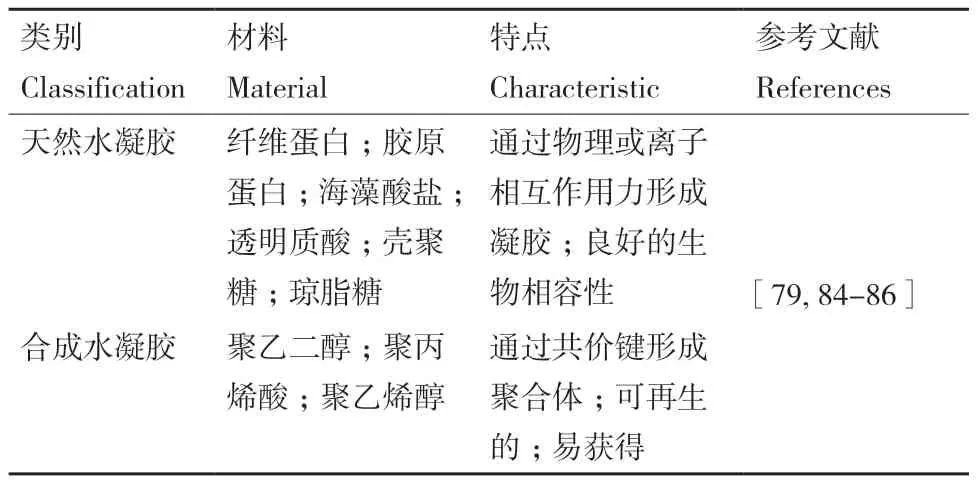
表4 水凝胶类型Table 4 Types of hydrogels
水凝胶微珠法需要利用液滴微流控和胶凝基质(如琼脂糖)将荧光标记底物、培养基等和表达酶的单细胞包裹在微珠中,然后利用FACS进行高通量分选。首先将细胞和琼脂糖溶液混合,随后利用液滴微流控芯片生成包裹细胞的琼脂糖微珠,微珠悬浮在含有酶促底物的油相中。在过夜培养后,荧光标记底物被分泌酶催化后生成荧光产物。因油相的隔绝,荧光产物不会扩散到其他微珠中。最后进行变温和洗涤等多个步骤形成不会形变且大小均一的固体微珠,并利用FACS对这些微珠进行筛选,如图4‑b[87]。Eun等[79]利用此方法将大肠杆菌封装在琼脂糖微珠中,首先确定了利福霉素对大肠杆菌的最小抑制生长浓度。随后,此研究将大肠杆菌MG1655‑ptetEGFP包裹在琼脂糖微珠中,并将其与利福霉素混合,MG1655‑ptetEGFP在代谢过程中会表达eGFP荧光蛋白。具有耐药性的MG1655‑ptetEGFP单细胞会在琼脂糖微珠中生长形成发出绿色荧光的单菌落。利用FACS筛选到具有绿色荧光的微珠,通过测序发现自发耐药性突变靶点是RNA聚合酶的β亚基RpoB,集中的突变位点是Q513L。使用水凝胶微珠法获得自发耐药突变体所需的时间和检测单细胞数量比传统的平板筛选分别减少了8倍和150倍。Ma等[81]利用此方法将生产木聚糖酶的毕赤酵母和荧光标记的木聚糖底物共同封装在琼脂糖水凝胶微珠中,木聚糖酶水解底物后产生荧光信号。存在优势木聚糖酶突变体的凝胶微珠具有更高的荧光强度,经过对大约108个突变体进行3轮FACS筛选和诱变后,获得了一个木聚糖酶活性提高1.3倍的毕赤酵母菌株突变体。此研究证明基于水凝胶微珠法的FACS筛选相对于机器人辅助的微孔板筛选通量至少提高103倍,试剂消耗量减少了106倍,并且筛选前的孵化时间大大缩短,极大地加速了酶定向进化的进程。
水凝胶微珠法在FACS高通量筛选酶中具有高通量、适用于复杂反应体系、筛选效率高、筛选准确性高等优点。但水凝胶微珠法也存在一些局限性,例如,制备过程中使用的胶凝物质可能对细胞产生毒性;水凝胶微珠可能会受到机械剪切的影响,导致破裂或形状变化,微珠尺寸不均匀可能导致分离效率低下和筛选结果不理想;微珠尺寸较大,需要调整FACS仪器参数和流速以确保准确分选和统计分析。
5 总结与展望
近年来,随着荧光标记、生物传感器、液滴微流控等技术的快速发展,基本满足了大多数酶基因型和荧光表型偶联的需求,也因此FACS在酶定向进化领域的应用范围日益扩大。经过几十年的发展,FACS对荧光信号表型的筛选已经从单色荧光检测发展到多色荧光同时检测,通量达到了104/s以上。本文首先简要概述了FACS的基本理论、流式细胞分选仪的组成和原理。随后重点探讨了FACS高通量筛选不同酶的方法及相关问题。通过本文的阐述,旨在为酶定向进化过程中建立高通量筛选方法提供参考,以加快酶定向进化的进程。
虽然FACS是一种加速酶定向进化获得优势突变酶的有效方法[88],但现有的FACS相关方法仍然存在一些问题。例如,双乳化液滴和水凝胶微珠方法易发生液滴合并,且工艺高度复杂等问题[89];采用液滴微流控直接生成包含DNA或者RNA文库的液滴,会造成文库中遗传信息多样性的损失。此外,偶联基因型和荧光表型的方法存在局限性,例如,底物荧光标记法或生物传感器仍无法涵盖所有酶,因此需开发不依赖荧光的高通量筛选方法。目前,液滴微流控领域建立了吸光度激活液滴分选技术(absorbance‑activated droplet sorting,AADS),通过检测吸光度来实现细胞分选,相关研究已证明了AADS对于酶定向进化的实用性[90]。尽管其通量为每秒1 000个液滴,但这种方法摆脱了分选过程中对于荧光信号的依赖。未来,将AADS技术与FACS技术进行交叉融合,可提高AADS技术的分选通量,同时使FACS技术不再受限于荧光信号,从而进一步扩大FACS技术的应用范围。
此外,对于未知结构和机理的酶,定向进化通常会使用随机突变构建突变文库。酶的突变文库能够达到20N(N为蛋白质一级序列长度)量级[91]。对于这种巨型文库,FACS对其筛选也需耗费大量时间。近年来,机器学习、深度学习等人工智能技术已被应用于酶定向进化领域,其能够快速找到未知结构和机理酶的合理突变序列空间,从而对酶的突变进行理性设计,减小突变文库的规模,实现小而精突变文库的构建[91-94]。将人工智能与FACS结合,能够减小FACS对上述巨型文库筛选的难度,同时使得FACS快速准确地从小而精突变文库中筛选出优势酶突变体。新技术的发展和不同技术之间的交叉融合,为FACS技术在酶定向进化中的应用提供了更多可能性和潜力。随着这些技术的不断发展和改进,我们可以期待更高效、更准确的高通量筛选方法。
致谢
感谢北京理工大学生物与医学工程公共实验中心提供的流式细胞分选仪FACS BD Aria II,感谢孙立权、罗茂国等在技术上提供的帮助。
