基于紫色杆菌素生物合成途径的L-色氨酸生物传感器的构建
2023-11-23李仁瀚张乐乐刘春立刘秀霞白仲虎3杨艳坤李业
李仁瀚 张乐乐 刘春立,3 刘秀霞,3 白仲虎,3杨艳坤,3 李业,3
(1. 江南大学工业生物技术教育部重点实验室,无锡 214122;2. 江南大学粮食发酵与食品生物制造国家工程研究中心,无锡 214122;3. 江苏省生物活性制品加工工程技术研究中心,无锡 214122)
L‑色氨酸(L‑Tryptophan, L‑Trp)是一种重要的芳香族氨基酸,在医药、食品、饲料等领域有着广泛的应用[1-2],是许多高附加值化合物的前体,如吲哚‑3‑乙酸[3]和5‑羟色胺[4]等。主要用于工业化生产L‑色氨酸的工业底盘菌株通常为大肠杆菌[5]和谷氨酸棒杆菌[6]等。精准调控大肠杆菌的代谢途径可将碳通量转移到L‑色氨酸,如敲除编码色氨酸操纵子抑制因子的基因trpR[7],敲除编码色氨酸酶的基因tnaA[8],过表达trpE、aroG[9],抑制Pta‑AckA途径[10],平衡前体供应等[11],L‑色氨酸的生产已达到较高的产量、转化率和产率(titer, yield,Productivity, TYP)。例如,大肠杆菌菌株TRP07在5 L发酵罐补料分批培养中生产色氨酸的TYP分别为49 g/L、0.186 g/g葡萄糖、2.8 g/(L·h)[12]。
通过识别和修饰更多基因靶点,特别是那些与L‑色氨酸代谢没有直接关系的基因,可进一步提高L‑色氨酸的产量。然而,大肠杆菌中有数千个基因,其胞内代谢和调节途径十分复杂;另外精确定量L‑色氨酸主要依赖液相色谱技术,需进行多轮繁琐、耗时且昂贵的测试才能鉴定出高产菌株[13]。但生物传感器辅助的高通量筛选能够在代谢通路不明确的情况下识别新的基因靶标,成为代谢工程的补充策略,改造微生物工厂以提高其性能[14],在合成生物学领域有着广泛的应用。进行高通量筛选的一个条件是生物传感器可将相关代谢物的浓度与易检测的信号相关联,如可见光、荧光或生长优势[15]。近年来研究人员已经开发了多种L‑色氨酸生物传感器,如基于核糖体开关的p15‑ribo727[16]和基于Rho因子的pSensor[17]。前者检测L‑色氨酸的动态范围为10.85倍,工作范围为0.2-10 mmol/L(0.04-2.04 g/L);后者检测L‑色氨酸的动态范围为8倍,工作范围为0.1-1.5 mmol/L(0.02-0.3 g/L),检测上限都较低。目前的工业L‑色氨酸菌株在摇瓶中很容易达到2.1 g/L的L‑色氨酸产量[10],因此上述生物传感器可能不适合应用于工业菌株。
紫色杆菌素是一种天然的双吲哚紫色色素,最初从Chromobacterium violaceum中分离,后续在Duganella violaceinigra sp.、Janthinobacterium lividum、Collimonas CT、Psychrotrophic bacterium, XT1中也陆续发现[18]。如图1所示,紫色杆菌素以两分子L‑色氨酸为底物,以VioABCDE[19]酶催化,经五步反应合成,并生成亮紫色副产物脱氧紫色杆菌素。进一步研究[20]表明,脱氧紫色杆菌素仅在VioABCE的参与下合成。由于紫色杆菌素及其衍生物具有抗菌、抗癌及抗病毒[21-22]等生物活性,目前其研究方向主要在于如何通过代谢工程利用微生物工厂提高其产量[23-26]。同时,由于紫色杆菌素和其中间体的颜色鲜艳,其生物合成途径也经常被用作合成生物学的验证工具[18]。红色的番茄红素[27]和淡黄霉素[28]都已被开发成相应的生物传感器,但关于将紫色杆菌素开发成生物传感器的研究却较少[29],未见其作为L‑色氨酸生物传感器的报道。本研究对紫色杆菌素在大肠杆菌中的生物合成途径进行了全面表征,将其开发成L‑色氨酸生物传感器。通过RBS工程对途径中第一个酶VioA进行优化,并测试了来自不同的菌种的VioA,开发了动态范围高达55倍的L‑色氨酸生物传感器,可检测到0-10 g/L的胞外供应的L‑色氨酸。这种新型的酶偶联生物传感器可结合高通量筛选技术,通过与出发菌株的颜色对比,高效鉴定出L‑色氨酸产量相对较高的大肠杆菌菌株,为提高L‑色氨酸及其高附加值衍生物的工业化产量做出贡献。
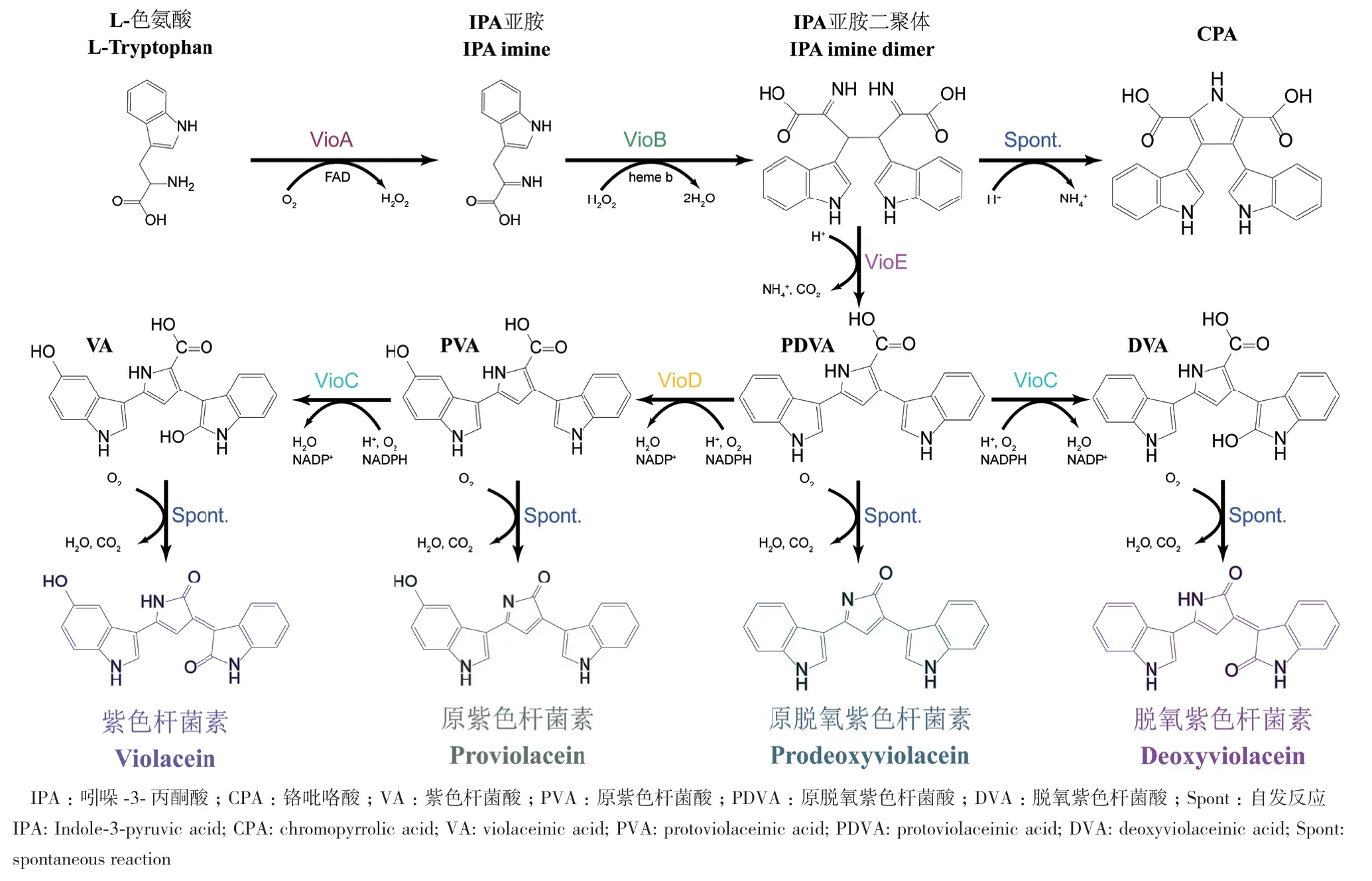
图1 紫色杆菌素生物合成途径Fig. 1 Violacein biosynthetic pathway
1 材料与方法
1.1 材料
1.1.1 质粒、菌株与引物 本研究所用质粒列于表1,所用菌株列于表2,所用引物列于表3。所有基因合成、密码子优化、引物合成和测序服务均由苏州金唯智生物科技有限公司提供。

表1 本研究所用质粒Table 1 Plasmids in this study

表2 本研究所用菌株Table 2 Strains in this study
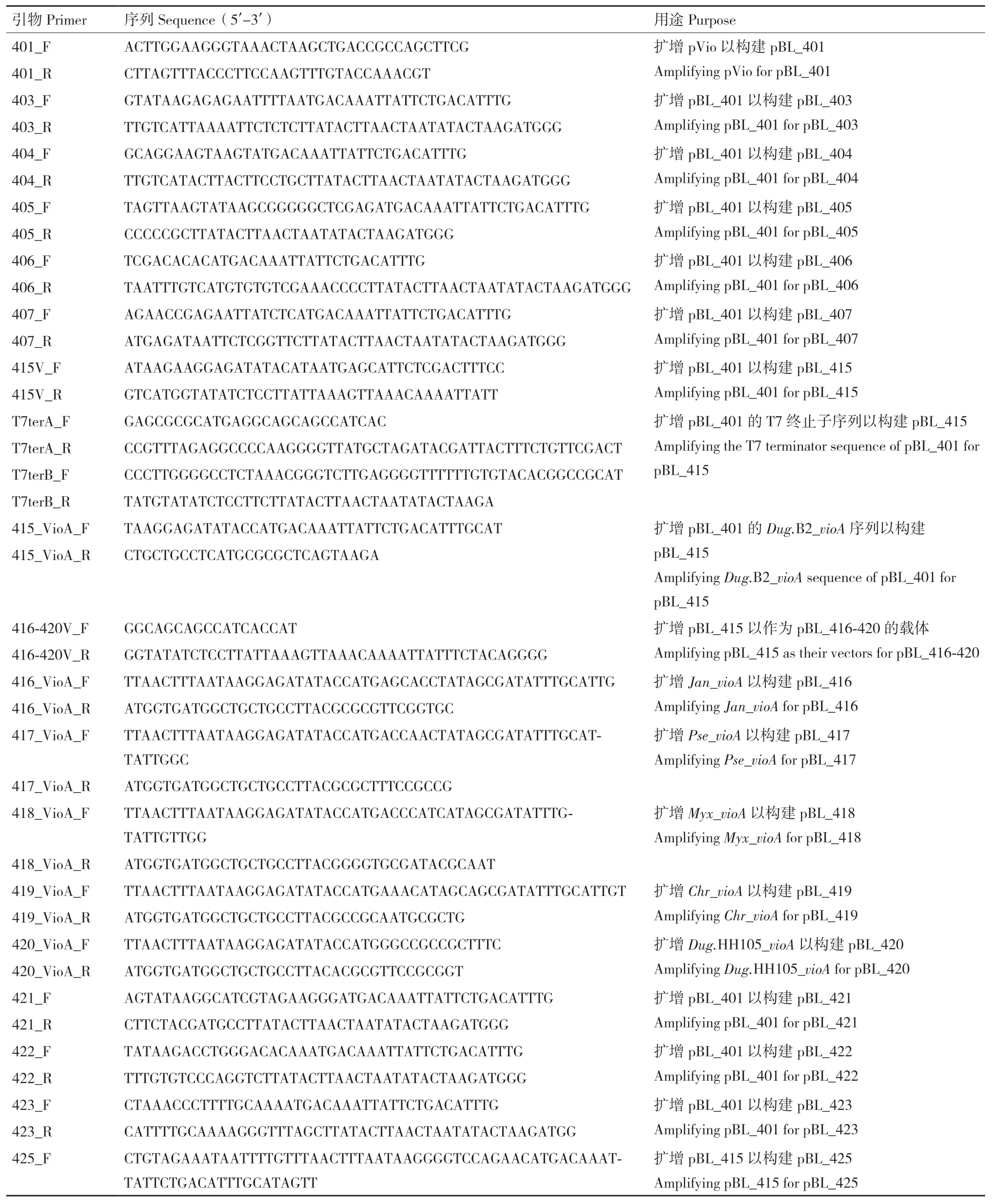
表3 本研究所用引物Table 3 Primers in this study
1.1.2 试剂与设备 高速高保真PCR酶PrimeSTAR®Max DNA Polymerase购自TaKaRa Bio;质粒同源重组试剂盒MultiF Seamless Assembly Mix购自武汉爱博泰克有限公司。
LB培养基:10 g/L蛋白胨,5 g/L酵母抽提物,10 g/L氯化钠。M9‑YE培养基:17.1 g/L十二水合磷酸氢二钠,3 g/L磷酸二氢钾,0.5 g/L氯化钠,1 g/L氯化铵,1 g/L酵母抽提物,1 mmol/L硫酸镁,0.1 mmol/L氯化钙,10 g/L葡萄糖及相应浓度的L‑色氨酸[26]。根据需要添加终浓度为34 μg/mL的氯霉素或50 μg/mL的卡那霉素。以上所有试剂均购自上海国药集团化学试剂有限公司。
759S紫外可见光分光光度计,上海棱光技术有限公司;Q5000 NanoDrop紫外可见分光光度计,Quawell 公司。
1.2 方法
1.2.1 RBS序列设计 本研究所使用的起始质粒pVio的载体为pRSFDuet,含有两个多克隆位点(multiple cloning site, MCS),来自Duganella sp. B2(Dug.B2)的vioABCDE基因簇被插在第二个多克隆位点上。每个多克隆位点前都有一个核糖体结合位点(ribosome binding site, RBS),依次命名为RBSa和RBSb。
使用RBS计算器[30]在线网站https://salislab.net/software/,计算得出pBL_401上的Dug.B2_vioA的RBSb翻译起始速率(translation initiation rate,TIR)约为11 000(任意单位,arbitrary unit, au)。随后分别为pBL_403-407和pBL_421-423设计了8个RBSb序列;为pBL_425、pBL_429、pBL_437-439设计了5个RBSa序列。所有质粒的RBS序列及其TIR见表4。
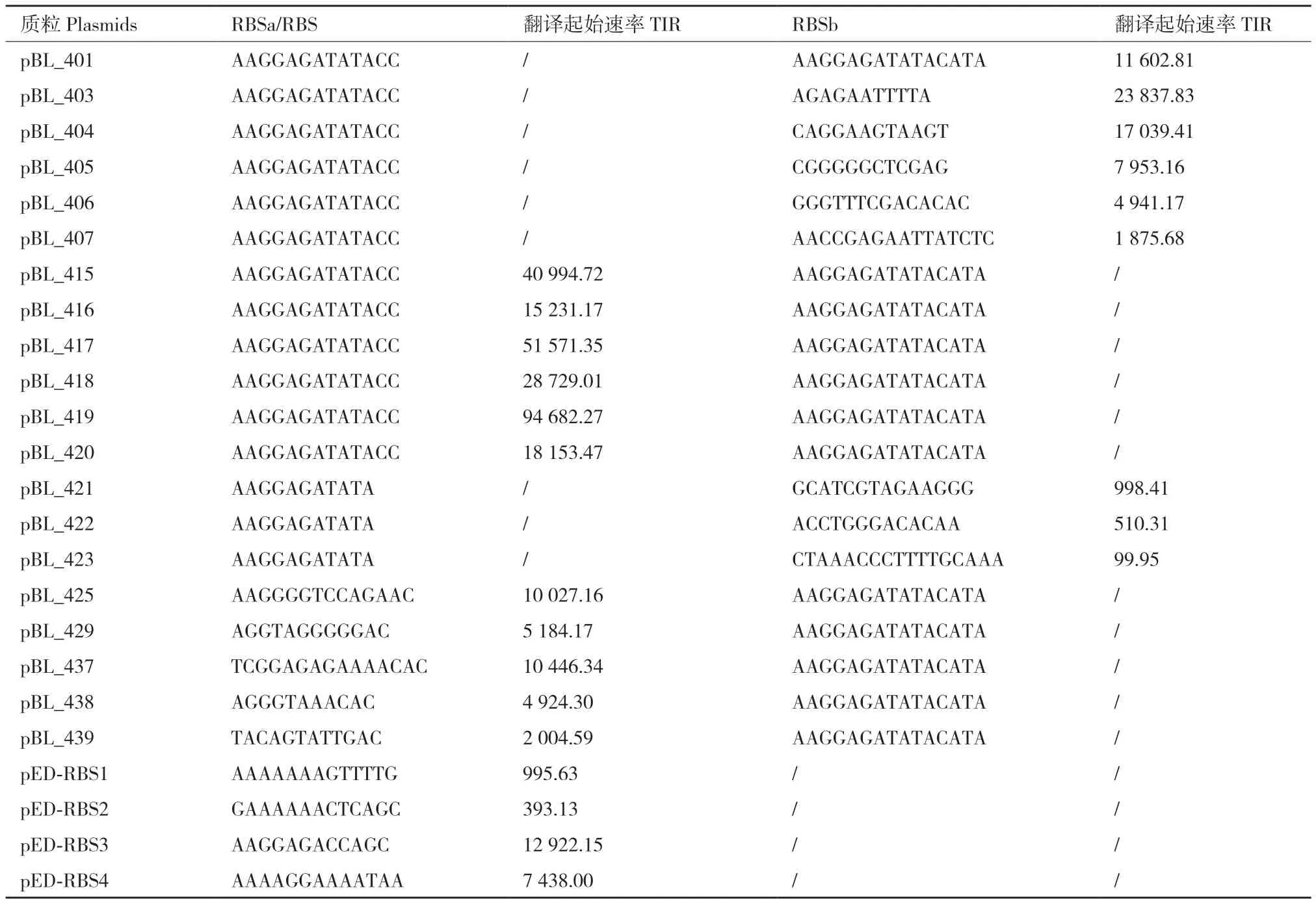
表4 本研究设计的RBS序列及其TIRTable 4 RBS sequence and its TIR designed in this study
1.2.2 质粒构建与基因合成 敲除原核表达质粒pVio[26]上的vioD基因,并保留了其后100个碱基作为vioE可能的核糖体结合位点。以pVio为模板,用引物401_F和401_R进行扩增,得到线性化的pBL_401,再采用同源重组法将线性化的质粒环化。同样,为替换RBSb序列,以pBL_401为模板,采用同样的方式构建质粒pBL_403-407和pBL_421-423。
以Dug.B2 VioA(GenBank:ACT67682.1)为模板,在NCBI上搜索其他物种的VioA,并选择21个VioA序列进行进一步分析。使用MEGA7构建系统发育树。最终选择的5个VioA序列由GENEWIZ(Suzhou, China)进行密码子优化并合成,分别替换Dug.B2_vioA,同时保留了原来的Dug.B2_vioBCE。采用Vector NTI进行序列比对。以pBL_401为模板,获得4个DNA 片段415V、T7terA、T7terB和415_VioA,同源重组得pBL_415。以pBL_415为模板,采用同样的方式构建质粒pBL_416-420。部分质粒简图见图2。
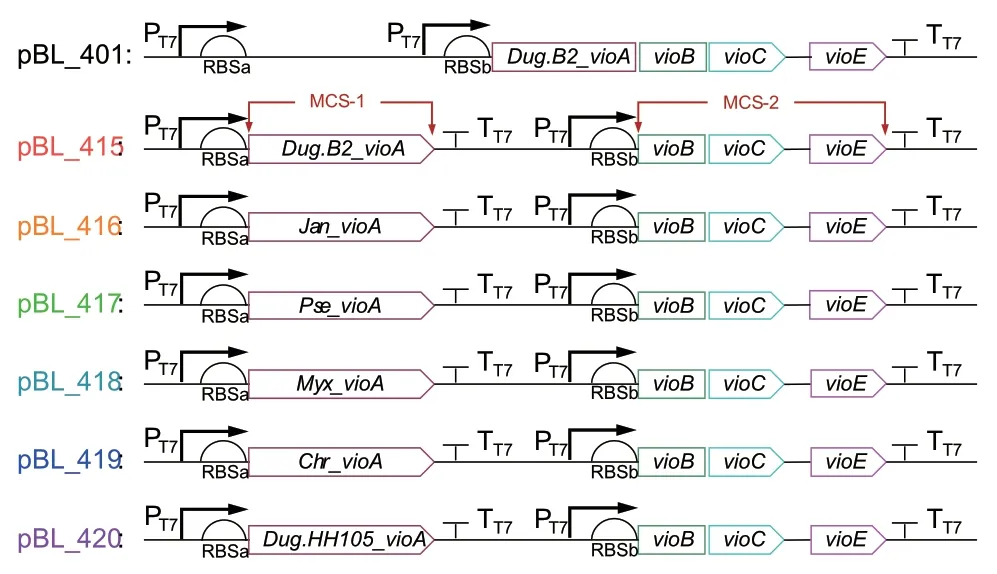
图2 质粒pBL_401和pBL_415-420的简图Fig. 2 Schematic diagram of plasmids pBL_401 and pBL_415-420
为替换各自的RBSa序列,以pBL_415、pBL_416和pBL_419为模板,分别构建质粒pBL_425、pBL_429和pBL_437-439。
1.2.3 菌株培养 挑取单菌落,在5 mL LB培养基中以37℃、220 r/min的条件培养过夜。随后,将75 μL种子液接种到24孔板中,每孔含有1.5 mL M9‑YE培养液。在37℃,220 r/min下培养2-3 h,当OD600达到0.8-1.0时,加入终浓度为0.1 mmol/L的IPTG,调节温度至30℃。本文中所有数据图的起始时间均为诱导时间。所有发酵实验均进行3次重复。
1.2.4 产物测定 发酵结束后,首先将1 mL培养物在10 000 ×g的条件下离心10 min。沉淀物用2 mL 95%乙醇重悬,然后10 000 ×g再离心10 min。乙醇萃取上清液在570 nm处测量吸光度,Abs570的值代表脱氧杆菌素相对含量[24]。将沉淀用1 mL无菌水重悬,OD600值代表生物量。用DNS法测定了培养液中剩余的葡萄糖[31]。
采用高效液相色谱(high performance liquid chromatography, HPLC)定量L‑色氨酸[32]。将离心后的发酵上清液与等量的无水乙醇混合,充分混匀后在16 500 ×g的条件下离心5 min,取上清检测。色谱柱为岛津(Kyoto, Japan)Shim‑pack GIST C18柱(5 μm, 150 mm×4.6 mm)。流动相A为0.1%的甲酸,流动相B为甲醇。B的浓度在0-15 min内从20%线性增加到60%,15-16 min线性下降到20%,16-24 min维持在20%。总流速0.8 mL/min,检测波长270 nm,柱温箱40℃。L‑色氨酸标准品购自Macklin。
参考Fang等[26]的方法,采用上述色谱柱,以75%甲醇水溶液为流动相,检测波长为570 nm,分离紫色杆菌素和脱氧紫色杆菌素。
2 结果
2.1 重组大肠杆菌生产紫色杆菌素和脱氧紫色杆菌素
将pVio和pBL_401转化进E. coli BL21(DE3)中,得菌株EBL_400和EBL_401。发酵并检测产物,结果如图3所示,EBL_400既生产紫色杆菌素(保留时间, retention time, RT=3.33 min),也生产脱氧紫色杆菌素(RT=4.97 min),而EBL_401只生产脱氧紫色杆菌素。
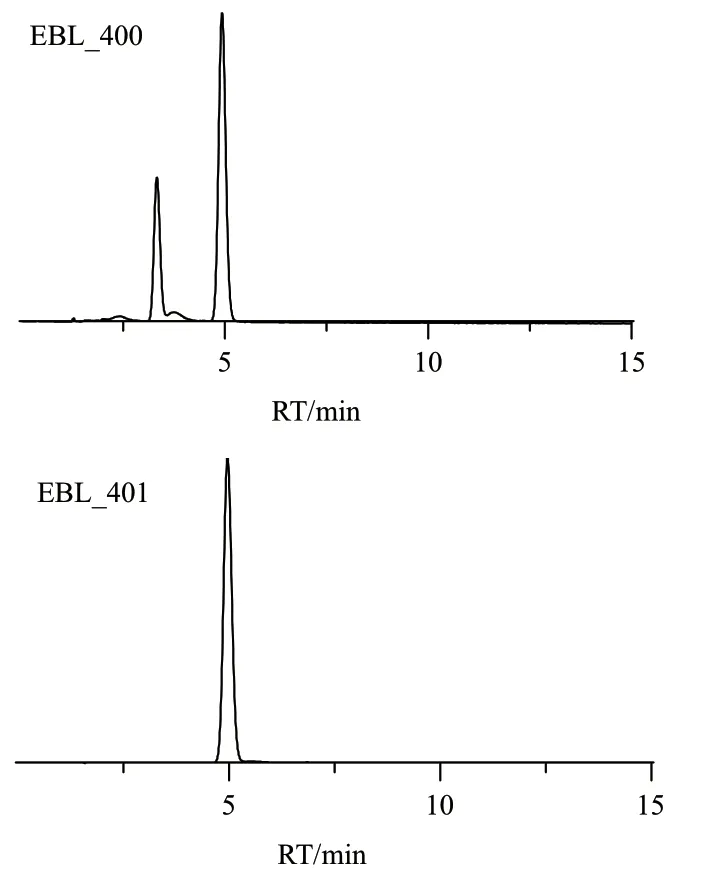
图3 HPLC分析EBL_400和EBL_401发酵产物Fig. 3 Fermentatied products EBL_400 and EBL_401 by HPLC
详细研究EBL_401的脱氧紫色杆菌素生产、细胞生长和葡萄糖的消耗。每隔2 h采集一次样品,结果如图4所示,在添加诱导剂IPTG的情况下,菌体生长和葡萄糖消耗均慢于不添加IPTG的对照组,这表明通过表达vioABCE产生脱氧紫色杆菌素对菌株生长略有损害。由于本研究的目的是通过肉眼来区分不同菌株脱氧紫色杆菌素产量,而不追求其高产量,所以在后续实验中选择24 h作为发酵终点。在该时间点,EBL_401产生足够的脱氧紫色杆菌素,使培养物呈紫色。
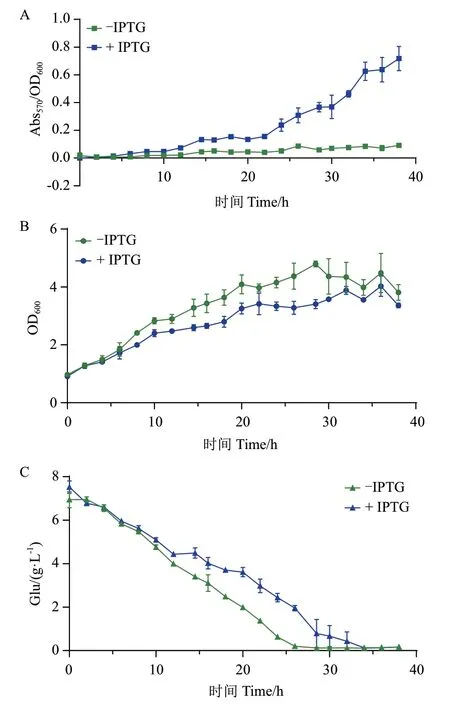
图4 EBL_401的脱氧紫色杆菌素生产曲线(A)、菌株生长曲线(B)和葡萄糖消耗曲线(C)Fig. 4 Deoxyviolacein production curve(A), strain growth curve(B), and glucose consumption curve(C)of EBL_401
2.2 利用RBS工程开发VioABCE生物传感器
通过改变RBSb序列而改变vioA基因的翻译速率,以调整VioA的表达水平,理论上可扩大生物传感器的动态范围。对含有相应质粒的BL21(DE3)菌株的发酵表明,VioA的RBSb强度与脱氧紫色杆菌素的产量总体上呈正相关(图5‑A)。此外,脱氧紫色杆菌素产量降低会增加菌液OD值,尤其当vioA的TIR≤1 000时。这再次证明生产脱氧紫色杆菌素会影响细菌生长(图5‑B)。

图5 EBL_401, 403-407, 421-423的脱氧紫色杆菌素生产(A)、菌株生长(B)及生物传感器pBL_406的测试(C)Fig. 5 Deoxyviolacein production(A)and the strain growth(B)of EBL_401, 403-407, 421-423 and the test of biosensor pBL_406(C)
选择脱氧紫色杆菌素产量最低的EBL_406来评估其作为生物传感器的性能,测试胞外添加L‑色氨酸与Abs570/OD600的关系,结果如图5‑C所示,该传感器可区分2-7 g/L胞外供应的L‑色氨酸,动态范围为3倍,但不能区分0-2 g/L胞外供应的L‑色氨酸,需进行进一步的优化。
2.3 测试不同物种的VioA以优化生物传感器性能
不同物种的VioA对底物L‑色氨酸的敏感性不同,其作为生物传感器理论上也有不同的工作范围。在构建的系统发育树中(图6),依据不同菌株所在的位置,最终选择5种VioA进行实验验证:Janthi‑nobacterium violaceinigrum(Jan)VioA(NCBI参考序列:WP_152281413.1)、Pseudoduganella violaceinigra(Pse)VioA(NCBI参考序列:WP_028101315.1)、Myxococcus xanthus(Myx)VioA(NCBI参考序列:WP_140866970.1)、Chromobacterium violaceum(Chr)VioA(NCBI参考序列:WP_043614891.1)和Du‑ganella sp. HH105(Dug.HH105)VioA(GenBank:OEZ63731.1)。序列比对表明,5株VioA的序列同源性在64.9%-82.5%之间,与已鉴定的Dug.B2 VioA的序列同源性为54.7%-62.5%(表5)。
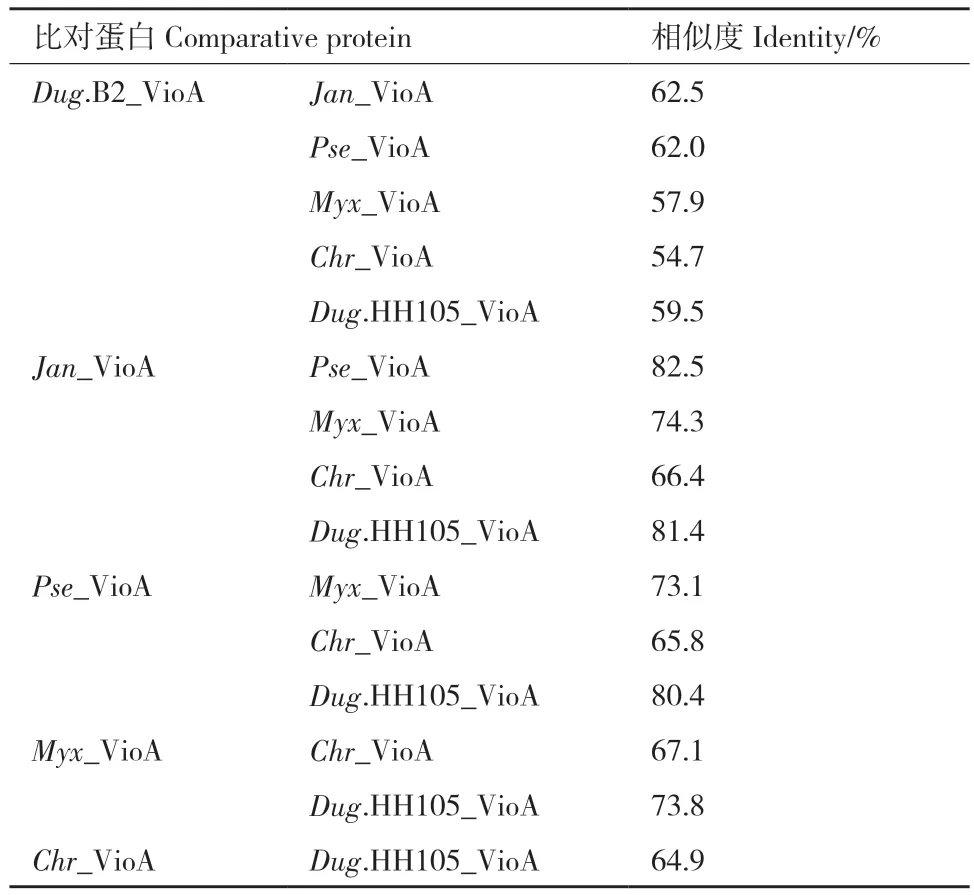
表5 5种不同来源VioA的序列相似性比对Table 5 Sequence comparison of 5 VioAs from different sources

图6 21个不同来源VioA的系统发育树Fig. 6 Phylogenetic tree of 21 VioAs from different sources
对EBL_415-420的发酵结果表明:除含有Dug.B2_VioA的EBL_415能产生脱氧紫色杆菌素外,EBL_416和EBL_419也能产生(图7‑A),表明Jan_VioA和Chr_VioA在大肠杆菌中表达时具有活性。

图7 不同来源VioA(A)、调整RBSa(B)及生物传感器pBL_438、pBL_439的测试(C,D)Fig. 7 Testing of different sources VioA(A), adjusted RBSa(B), and biosensors pBL_438 and pBL_439(C, D)
继续调整Jan_VioA和Chr_VioA的RBSa序列以优化这些生物传感器的性能,发现使用Chr_VioA可检测到0-10 g/L胞外供应的L‑色氨酸(图7‑B)。通过降低Chr_vioA的RBSa强度,其对L‑色氨酸的动态范围有所提高。当其TIRRBSa降低到2 000时,对比外源添加0和10 g/L的L‑色氨酸,动态范围高达55倍(图7‑C)。但当外源添加10 g/L L‑色氨酸时,菌株生长已受到明显影响(图7‑D)。相反,即使优化了Jan_VioA生物传感器,其在0-10 g/L的范围内也不能区分外源添加的L‑色氨酸(图7‑B)。
2.4 在产量不同的L‑色氨酸生产菌株中验证该生物传感器
在L‑色氨酸产量不同的大肠杆菌中测试生物传感器pBL_439的性能,pED系列质粒中trpEfbrD操纵子的TIRRBS见表4。如图8‑A所示,在没有生物传感器的情况下,E. coli B8/pED‑RBS1和E.coli B8/pED‑RBS2的L‑色氨酸产量是野生型E. coli BL21/pED‑RBS1的8.36倍。导入生物传感器后,B8/pED‑RBS1和B8/pED‑RBS2产生的脱氧紫色杆菌素是BL21/pED‑RBS1的7.97倍。随着trpEfbrD翻译速率的提高,L‑色氨酸的产量进一步提高。与B8/pED‑RBS1和B8/pED‑RBS2相比,B8/pED‑RBS3和B8/pED‑RBS4的L‑色氨酸产量增加了7.27倍,脱氧紫色杆菌素增加了1.60倍。最后,如图8‑B所示,该生物传感器可通过肉眼直观地将L‑色氨酸产量不同的菌株区分开来。上述结果证明了我们的工程化生物传感器在原位快速检测L‑色氨酸高产菌株方面的适用性。
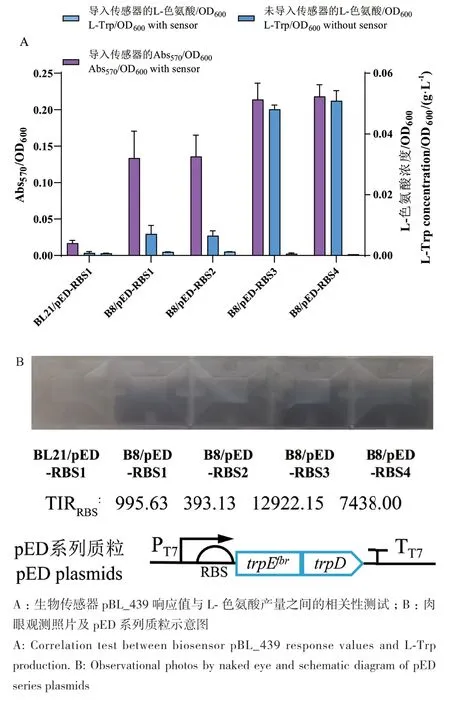
图8 生物传感器pBL_439在L-色氨酸产量不同的大肠杆菌中的测试Fig. 8 Testing of the biosensor pBL_439 in different E. coli strains with varying L-Trp production
3 讨论
L‑色氨酸是一种重要的芳香族氨基酸,在工业、农业、医药等领域有着广泛的应用。多年来,世界各地的研究人员一直在研究如何利用微生物高效生产L‑色氨酸。理性设计通过分析代谢和调控网络,预测出许多可修饰的基因靶点,并进行实验测试,从而开发了许多用于生产L‑色氨酸的工业菌株。例如过表达aroG、serA、trpEDCBA和截断tnaA、trpR[7]。同时,由于大多数代谢途径相关基因已经被测试,进一步改造这些工业菌株变得非常具有挑战性。基因文库筛选能够在不需要太多代谢背景的情况下发现更多的遗传靶标,因此成为理性设计进化微生物的替代策略[13]。生物传感器可通过高通量的方式进行文库筛选,将胞内的代谢物转换为易于检测的物理信号,如可见光、荧光或生长优势[33]。
由于紫色杆菌素生物合成途径以L‑色氨酸为底物,我们对该途径进行了系统的表征。虽然紫色杆菌素生物合成途径的4个产物都具有特定的颜色,但原紫色杆菌素和原脱氧紫色杆菌素的颜色并不明显,通过紫外分光光度计检测也没有明显的特征峰[29],因此不适合作为生物传感器。紫色杆菌素和脱氧紫色杆菌素同时生产会增加菌株的碳代谢负担,对生物传感器来说也无必要。因此需敲除vioD基因使菌株只生产脱氧紫色杆菌素。
原pVio质粒是为高产紫色杆菌素而构建的,过高的产量也会增加菌株的碳代谢负担和生物传感器的背景噪音。另外,一些研究表明,降低报告基因的表达水平有利于提高生物传感器动态范围[34]。在脱氧紫色杆菌素生物合成途径中,第一个反应是由FAD依赖的L‑色氨酸氧化酶VioA[35]将L‑色氨酸催化成IPA亚胺。显然,降低胞内VioA水平而使该反应成为限速步骤,将有利于该生物传感器的开发。
调整生物传感器性能的一个正交策略是改变VioA的动力学性质,而获得动力学上不同的VioA的一个直接方法是从不同物种中寻找同源酶。该方法比设计Dug.B2的突变体要简单得多,避免了基于结构生物学的分析、设计和实验验证。在构建pBL_415-420系列质粒的过程中,由于使用了不同的vioA基因,为控制变量,原始设计中的多顺反子vioABCE操纵子被分成两个操纵子:vioA和vioBCE,受两个独立的T7启动子的控制,并在第二个T7启动子前添加了一个T7终止子。这种设计避免了不同vioA序列引起的Dug.B2_vioBCE的翻译差异。即使是同样的RBSa序列,由于其后的vioA基因序列不同,该RBS也有不同的TIR。
生物传感器的一个主要应用是原位检测胞内代谢物,并将浓度信息转换为易于检测的信号[36]。在证明生物传感器pBL_439能区分添加到培养基中的不同浓度的L‑色氨酸后,仍需证明该生物传感器也能识别L‑色氨酸产量不同的大肠杆菌菌株。先前对L‑色氨酸代谢的研究表明,某些基因靶点及其修饰表达对提高大肠杆菌L‑色氨酸产量有重要作用[5]。例如,trpE和trpD编码邻氨基苯甲酸合成酶的两个亚基,而反馈抑制不敏感的trpEM293T,S40L和trpD的过度表达是促进L‑色氨酸合成的关键[37]。trpR编码一个转录抑制因子,它负反馈调节色氨酸操纵子;tnaA编码降解L‑色氨酸的色氨酸酶;pheA编码分支酸变位酶,负责合成L‑色氨酸的竞争前体L‑苯丙氨酸[26],在大肠杆菌中敲除这3个基因(ΔtrpR ΔtnaA ΔpheA)也能增加色氨酸的产量。利用上述遗传修饰的组合,一系列L‑色氨酸产量不同的E. coli菌株被构建,并测试生物传感器是否可识别这些菌株。
该生物传感器的一个主要缺点是它只能在30℃下工作,而大多数L‑色氨酸的生产过程都是在37℃[9]下进行的。在利用其进化工业菌株前,需探究在30℃和37℃时,L‑色氨酸的产量是否存在正相关。另外,在引入以L‑色氨酸为底物的异源途径后,以大肠杆菌为宿主可合成大量的高附加值天然产物[38-39],这些来自其他细菌、真菌和植物的相关异源基因的功能表达通常在低温下进行,因此可直接利用我们的L‑色氨酸生物传感器筛选相关产物的高产菌株。
4 结论
本研究在大肠杆菌中系统表征了紫色杆菌素生物合成途径,成功将其改造为L‑色氨酸生物传感器。通过RBS工程优化了VioA的表达水平,提高了生物传感器的动态范围。测试了不同物种的VioA,结合RBS工程,构建了一个性能极佳的L‑色氨酸生物传感器,可区分0-10 g/L外源添加L‑色氨酸,动态范围高达55倍。导入该生物传感器的L‑色氨酸产量不同的大肠杆菌在培养过程中即可凭肉眼被区分开来,避免了额外的检测流程,缩短了检测时间。因此该生物传感器可通过结合高通量筛选等手段,为进一步提高L‑色氨酸及其高附加值衍生物的工业化产量奠定坚实基础。
