超声介导下羟基喜树碱纳米粒抗细胞增殖活性的研究
2023-11-23林柳任郑永仁
林柳任,窦 晨,张 昆,王 葳,郑永仁,程 欣*
(1.云南中医药大学中药学院,云南省高校外用给药系统与制剂技术研究重点实验室,云南省傣医药与彝医药重点实验室,云南 昆明 650500; 2.云南中医药大学科技处,云南 昆明 650500)
恶性肿瘤(即癌症) 是严重威胁我国居民生命健康的重大疾病之一[1-2]。目前常见的治疗手段为化疗、放疗、微创治疗等,但易引起全身性的不良反应,使得临床疗效常不尽人意。羟基喜树碱是一种活性生物碱,常用于治疗膀胱癌、肝癌、乳腺癌等多种癌症,但因其难溶于水、半衰期短、副作用大等问题影响临床疗效[3-5]。为解决上述缺陷,研究者们在不影响活性的基础上将其制成多种剂型。包载液态氟碳(liquid fluorocarbon,PFP) 的纳米粒,近年来常作为药物靶向制剂用于肿瘤诊疗,其通过超声靶向递送(ultrasound mediated targeted delivery,UMTD) 技术,可通过超声介导可控的释放包载药物,实现靶向及缓释双重作用[6-8]。课题组在前期成功制备了羟基喜树碱纳米粒,为进一步探讨羟基喜树碱纳米粒在超声介导下对不同肿瘤细胞的增殖活性抑制能力,本研究以鼠源性肝癌细胞H22、乳腺癌细胞4T1、人正常肝脏细胞LO2 及人源性肝癌细胞Bel-7402 为实验对象,比较超声辐照前后的细胞增殖活性变化,考察自制纳米粒未超声时的安全性及对肿瘤细胞增殖的抑制作用,以期为超声介导药物体内靶向治疗提供一定的实验依据。
1 材料
1.1 仪器 Discovery 电子分析天平[奥豪斯仪器(上海)有限公司]; 4750E 型二氧化碳培养箱(美国NuAire 公司); DMil LED 倒置显微镜(德国Leica 公司); L550 型台式离心机(上海卢湘仪离心机仪器有限公司); HH-2 型恒温水浴锅(常州国华电器有限公司); SW-CJ-1FD 型洁净工作台(苏州安泰空气技术有限公司); Multiskan 酶标仪(美国Thermo Fisher Scientific 公司); DP-50 型便携式超声诊断仪(深圳迈瑞生物医疗电子股份有限公司)。
1.2 药物与试剂 羟基喜树碱(纯度≥99%,彭州市茂源生物科技有限公司,批号170401); 羟基喜树碱注射液(哈尔滨三联药业股份有限公司,批号19010510); 1640 培养基、FBS (胎牛血清)、青霉素-链霉素(双抗)、0.25%EDTA-胰蛋白酶 (以色列Bioland 公司,批号0010120、2001003、2017039、0055019); 噻唑蓝(MTT)、二甲基亚砜(DMSO) (北京索莱宝科技有限公司,批号30975057、D8370); MTS 细胞增殖试剂盒(美国Promega 公司,批号394203)。
1.3 细胞 鼠源性肝癌细胞(H22)、鼠源性乳腺癌细胞(4T1)、人源性肝癌细胞(Bel-7402) 由华中科技大学赠予,云南中医药大学药剂教研室传代培养得; 人正常肝细胞(LO2) 由云南白药公司药物实验室赠予,云南中医药大学药物分析教研室传代培养得。
2 方法
2.1 羟基喜树碱纳米粒的制备 羟基喜树碱纳米粒的制备方法同前期实验结果[9]。
2.2 羟基喜树碱原药、注射液及纳米粒的制备 分别精密称取适量羟基喜树碱原药、注射液及纳米粒于10 mL 离心管中,加入少量DMSO 溶液摇匀后,以含胎牛血清的培养基稀释即得不同质量浓度的羟基喜树碱各制剂。
2.3 细胞超声条件 超声条件为FH 8.5M,D 3.7,G 66,FR 23,IP 5,DR 100,MI 0.2,焦点位置2。超声方式为将超声探头垂直对准96 孔板底部,其间用耦合胶填充隔绝空气干扰,进行间歇式超声,每孔超声8 min,暂停1 min,重复2 次后,最后1 次超声7 min,共超声25 min。
2.4 细胞超声辐照损伤实验 超声组,取对数期生长的H22 细胞、4T1 细胞、LO2 细胞、Bel-7402 细胞,分别按照每孔1×104、5×103、1×104、1×104个的密度接种于96 孔板中(100 μL),每种细胞设置10 个复孔,培养24 h 后外部添加超声辐照,Bel-7402 细胞、4T1 细胞和LO2 细胞继续孵育24、48 h 后,每孔加入20 μL 5 mg/mL MTT 溶液,继续孵育4 h 后弃去上清液,每孔加入150 μL DMSO,轻微振摇10 min 溶解甲臜颗粒,于酶标仪490 nm 波长处检测光密度(OD) 值; H22 细胞分别孵育24、48 h 后每孔加入20 μL MTS 溶液,继续孵育1 h 后,用酶标仪在490 nm波长处测定OD 值。未超声组,除不添加超声外,其余条件与超声组相同。超声刺激后细胞损伤率计算公式为细胞损伤率=[(OD未超声组-OD超声组) /OD未超声组] ×100%。
2.5 H22 细胞增殖活性实验 取对数生长期的H22、4T1、LO2 细胞,胰酶消化并离心,调整细胞密度为1×105/mL,每孔100 μL 接种至96 孔板中,每个浓度设置5 个复孔,孵育24 h 后待细胞贴壁。超声组分别给予100 μL 不同质量浓度的羟基喜树碱原药、注射液及纳米粒(羟基喜树碱质量浓度均为 800、400、200、100、50、25、5、1 μg/mL),并设置阴性组(含细胞,不含羟基喜树碱)、空白组(不含细胞,不含羟基喜树碱)、背景组(不含细胞,含羟基喜树碱),按“2.3” 项下条件外部添加超声辐照;未超声组除不添加超声外,其余条件相同,2 组实验各重复3 次。分别培养24、48 h 后,每孔加入20 μL MTS 溶液,继续孵育1 h 后,用酶标仪在490 nm 波长处测定OD 值,计算单组细胞存活率,公式为细胞存活率= [(OD实验组-OD背景组) / (OD阴性组-OD空白组)] ×100%。
2.6 4T1、LO2 细胞增殖活性实验 取对数生长期的4T1、LO2 细胞,胰酶消化并离心,调整细胞密度为5×104、1×105/mL,每孔100 μL 接种至96 孔板中,每个浓度设置5 个复孔,孵育24 h 后待细胞贴壁。超声组分别给予100 μL 不同质量浓度的羟基喜树碱原药、注射液及纳米粒(羟基喜树碱质量浓度均为800、400、200、100、50、25、5、1 μg/mL),并设置阴性组(含细胞,不含羟基喜树碱)、空白组(不含细胞,不含羟基喜树碱),按“2.3” 项下条件外部添加超声辐照; 未超声组除不添加超声外,其余条件相同,2 组实验各重复3 次。分别培养24、48 h 后,每孔加入20 μL 5 mg/mL MTT 溶液,继续孵育4 h 后,弃去上清液,每孔加入150 μL DMSO 溶液,轻微振摇10 min,用酶标仪在490 nm 波长处测定OD 值,计算单组细胞存活率,公式为细胞存活率= [(OD实验组-OD空白组) /(OD阴性组-OD空白组)] ×100%。
2.7 Bel-7402 细胞增殖活性实验 取对数生长期的Bel-7402 细胞,胰酶消化并离心,调整细胞密度为1×105/mL,每孔100 μL 接种至96 孔板中,每个浓度设置5 个复孔,孵育24 h 后待细胞贴壁。超声组分别给予100 μL 不同质量浓度的羟基喜树碱原药、注射液及纳米粒(羟基喜树碱质量浓度均为800、400、200、100、50、25 μg/mL),其余步骤及细胞存活率的计算方法同“2.6” 项。
2.8 统计学分析 通过SPSS 21 软件进行处理,数据以(±s) 表示,2 组间比较采用t检验。P<0.05 为差异具有统计学意义。
3 结果
3.1 超声辐照对细胞损伤率的影响 如图1 所示,4 种细胞超声24、48 h 后OD 值无明显变化(P>0.05),细胞损伤率均<2%,表明超声过程引起的细胞损伤较小。

图1 超声前后4 种细胞OD 值变化(±s,n=10)
3.2 不同羟基喜树碱制剂对H22 细胞增殖活性的影响 如图2 所示,随着药物剂量的增加,不同羟基喜树碱制剂对H22 细胞的增殖抑制作用增加。未超声条件下纳米粒组细胞存活率>64%,且在800~25 μg/mL 质量浓度范围内,与羟基喜树碱原药组、注射液组比较,细胞存活率升高(P<0.05),安全性较好。超声48 h 后,在100、5、1 μg/mL 质量浓度范围内,与羟基喜树碱原药组、注射液组比较,纳米粒组细胞存活率降低(P<0.05)。经计算,未超声时羟基喜树碱原药、注射液及纳米粒的IC50值分别为(124.70±9.47) μg/mL、(94.32±9.53) μg/mL、(4.50±1.22)mg/mL; 超声辐照24 h 后,IC50值分别为(76.08±9.81)、(60.95±3.57)、(82.98±6.09) μg/mL; 超声辐照48 h 后,IC50值分别为(55.94±8.65)、(34.91±2.40)、(32.75±4.51) μg/mL,表明超声后纳米粒抑制H22 细胞增殖活性的作用增强。

图2 超声前后3 种羟基喜树碱制剂对H22 细胞增殖活性的影响(±s,n=3)
3.3 不同羟基喜树碱制剂对4T1 细胞增殖活性的影响 如图3 所示,随着药物剂量的增加,不同羟基喜树碱制剂对4T1 细胞的增殖抑制作用增加。未超声条件下纳米粒组细胞存活率>50%,且在800 ~5 μg/mL 质量浓度范围内,与羟基喜树碱原药组、注射液组比较,细胞存活率提升(P<0.05),安全性较好。超声48 h 后,在400~50 μg/mL 质量浓度范围内,与羟基喜树碱原药组、注射液组比较,纳米粒组细胞存活率降低(P<0.05)。经计算,未超声时羟基喜树碱原药组、注射液组及纳米粒组的IC50值分别为(92.33±4.04)、(34.66±2.81)、(796.88±2.14) μg/mL;超声辐照24 h 后,IC50值分别为(29.92±4.63)、(29.09±2.14)、(29.87±0.13) μg/mL; 超声辐照48 h 后,IC50值分别为(26.01±1.14)、(22.50±6.99)、(19.88±0.17)μg/mL,表明超声后纳米粒抑制4T1 细胞增殖活性的作用增强。

图3 超声前后3 种羟基喜树碱制剂对4T1 细胞增殖活性的影响(±s,n=3)
3.4 不同羟基喜树碱制剂抗Bel-7402 细胞增殖活性的影响 如图4 所示,随着药物剂量的增加,不同羟基喜树碱制剂对Bel-7402 细胞的增殖抑制作用增加。未超声条件下纳米粒细胞存活率>62%,安全性较好。超声48 h 后,在100~25 μg/mL 质量浓度范围内,与羟基喜树碱原药组、注射液组比较,纳米粒组细胞存活率降低(P<0.05)。经计算,未超声时羟基喜树碱原药组、注射液组及纳米粒组的IC50值分别为(1.82±0.11) mg/mL、(192.32±10.37)μg/mL、(2.56±0.65) mg/mL; 超声辐照24 h 后,IC50值分别为(179.78±10.48)、(116.34±2.52)、(128.50±11.49) μg/mL; 超声辐照48 h 后,IC50值分别为(166.12±6.24)、(111.12±0.71)、(69.68±10.92) μg/mL,表明超声后纳米粒抑制Bel-7402 细胞增殖活性的作用增强。

图4 超声前后3 种羟基喜树碱制剂对Bel-7402 细胞增殖活性的影响(±s,n=3)
3.5 不同羟基喜树碱制剂抗LO2 细胞增殖活性的影响 如图5 所示,未超声时羟基喜树碱原药及注射液对LO2 细胞增殖抑制作用较强,IC50值分别为 (253.74 ± 6.85)、(33.79±4.71) μg/mL,存在一定的肝毒性作用; 而纳米粒组IC50值为(1.95±0.11) mg/mL,不同质量浓度纳米粒组细胞存活率均>60%,且在800~5 μg/mL 质量浓度范围内,与羟基喜树碱原药组及注射液组比较,细胞存活率升高(P<0.05),表明未超声下纳米粒对人正常肝细胞增殖抑制作用较弱。超声辐照24 h 后,所有组的细胞存活率均有不同程度的降低,羟基喜树碱原药组、注射液组及纳米粒组的IC50值分别为(60.77±7.73)、(19.87±2.31)、(30.07±0.51) μg/mL。超声至48 h 后,在50 ~1 μg/mL 质量浓度范围内,与羟基喜树碱原药组及注射液组比较,纳米粒组细胞存活率降低(P<0.05),此时羟基喜树碱原药组、注射液组及纳米粒组的IC50值分别为 (54.67 ± 9.65)、(19.58±0.38)、(11.94±1.18) μg/mL,表明超声后纳米粒抑制LO2 细胞增殖活性的作用增强。
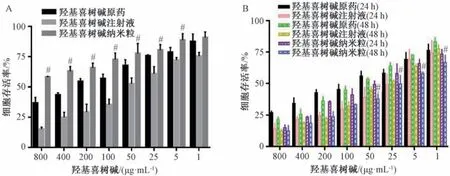
图5 超声前后3 种羟基喜树碱制剂对LO2 细胞增殖活性的影响(±s,n=3)
4 讨论
研究发现许多抗癌药的细胞毒性严重影响了临床使用疗效[10-11]。随着医学影像技术发展,超声分子水平的治疗逐渐成为研究热点,包载PFP 的纳米粒在外部添加超声辐照下,会发生液-气相转变 (acoustic droplet vaporization,ADV),实现局部释药并增加组织或细胞对药物的摄取[12-15]。
本研究使用的超声设备具有非侵入性、安全有效的特点[16]。其中频率和机械指数是影响超声空化效应及促使纳米粒相变的主要参数[17-18]。前期研究发现,较高频率和较低的机械指数能实现纳米粒体外超声破乳。
超声辐照损伤实验证实了本研究超声条件具有作为体外细胞超声来源的潜能。通过细胞增殖活性实验中不同羟基喜树碱制剂对3 种肿瘤细胞的IC50值比较发现,外部未添加超声辐照时,纳米粒对3 种肿瘤细胞的增殖抑制作用均低于羟基喜树碱原药及其注射液,尤其与H22 细胞及Bel-7402 细胞孵育后,存活率>60%,证实了纳米粒对鼠源性或人源性肝癌细胞在未超声辐照时均具有一定的安全性与可控性。此外,LO2 细胞活力的下降常预示体外肝毒性的发生[19]。在与其余肝癌细胞组比较时,发现羟基喜树碱制剂对LO2 细胞仍存在一定的肝毒性。在高浓度时(>200 μg/mL),LO2 细胞存活率低于H22 细胞和Bel-7402 细胞,但在低于200 μg/mL 质量浓度时,其细胞存活率与H22 细胞和Bel-7402 细胞接近,猜测未超声下较高质量浓度的纳米粒可能更容易被正常肝细胞摄取。但与同组其他羟基喜树碱制剂比较,纳米粒组细胞存活率远高于其余2 种制剂组,说明羟基喜树碱制备成纳米粒后,在未超声时安全性具有一定提升。有研究证实,超声辐照除能引起微泡破裂外,还能提高细胞膜的通透性,促进内吞、增加细胞间隙等生物学效应,导致靶细胞摄取药物增加,从而增强药物的治疗效果[20]。当外部添加超声辐照24 h 后,纳米粒与4组细胞共孵育后,细胞增殖抑制能力得到提升,与其余2种羟基喜树碱制剂组比较,纳米粒在4 种细胞中的增殖抑制性排列顺序均为羟基喜树碱注射液>羟基喜树碱纳米粒>羟基喜树碱原药。随着超声时间增加至48 h,纳米粒在4种细胞中增殖抑制能力变为羟基喜树碱纳米粒>羟基喜树碱注射液>羟基喜树碱原药,表明超声48 h 后纳米粒抗细胞增殖活性能力优于羟基喜树碱注射液及其原药。以上结果表明,纳米粒在本实验超声条件下具有缓释作用,可以改善药物在细胞内的蓄积并逐步增强抗肿瘤活性。
综上所述,羟基喜树碱纳米粒未经超声时具有一定的生物安全性,超声后则具有较好的治疗作用,有望开发一种超声介导下释放药物的治疗模式,为后续进一步研究体内释药规律提供了一定的依据。本研究尚有一定的局限,虽证实了超声能引起纳米粒相变,从而使纳米粒“爆破”释放羟基喜树碱发挥抗细胞增殖作用,但超声过程中除不引起细胞死亡外是否还会对细胞产生其他不良影响还需进一步研究。
