高粱根际高亲和性解磷复合菌系的构建及溶磷、促生效果
2023-11-21白文斌冯家璇高振峰
白文斌,冯家璇,高振峰
(1.山西农业大学 高粱研究所,山西 晋中,030600;2.山西农业大学 资源环境学院,山西 晋中,030801;3.山西农业大学 食品科学与工程学院,山西 太原,030031)
磷作为植物生长发育过程必需的大量营养元素之一,是植物体内各种物质的重要组成部分,参与植物体内众多代谢反应。植物缺磷会导致根系生长受限,延缓作物生长,造成作物减产,因此,在农业生产中施用磷肥成为维持或提高作物产量的重要栽培措施之一[1-2]。然而,我国耕地有效磷含量普遍偏低[3],且近年来受“高投入、高产出”栽培观念的影响,磷肥过量施用问题在农业生产过程中时有发生,不仅增产效果不显著,而且作物当季磷肥利用率普遍低于30%[4-5],导致大量磷被土壤固定转化为难以被植物吸收利用的难溶性磷酸盐,这不仅造成资源浪费,同时也带来了一系列环境问题[6]。根据20 世纪80 年代全国第二次土壤普查的数据,我国耕地中的难溶性磷含量约占土壤总磷含量的95%~99%[7]。因此,农业生产过程中活化利用土壤中的难溶性磷,对磷肥减量施用和保护我国生产磷肥所需的不可再生资源——磷矿具有重要意义。
解磷微生物是一种可将土壤中难溶性磷酸盐转化为植物可以吸收利用的有效磷的特殊微生物,目前国内外研究者对植物根际、非根际土壤、植物体内、动物体内、磷矿地、海洋等生境下的放线菌、真菌和细菌解磷微生物进行了大量研究,其中以解磷细菌微生物资源最为丰富,约占溶磷微生物总数的1%~50%,且主要种类为伯克霍尔德菌属(Burkholderia)和芽孢杆菌属(Bacillu)[8-10]。近年来,国内外研究者虽还对解磷微生物的生物学作用和作用机制进行了大量研究[10-11],且相关研究成果为基于解磷微生物的土壤难溶性磷活化利用、作物低磷栽培和磷肥减施目标实现提供了新思路和科学依据,但目前有关高粱根际解磷微生物的研究还较少[12-14],特别是构建有机—无机难溶性磷复合菌群方面的研究还少见相关报道。此外,受土壤环境、作物根际微环境及栽培模式等多种因素的影响,不同作物根际、不同菌种或菌株的溶磷能力存在一定差异[15-16],因此,本研究以高粱为研究对象,以实现土壤中难利用磷的高效利用为核心目的,借助解磷细菌对土壤难溶性磷的活化作用优势,利用课题组前期分离、鉴选出的解磷细菌资源,构建既可在高粱根际有效定殖,又可同时降解土壤有机和无机难溶性磷的复合菌系,并对其促生和高粱耐低磷特性进行研究,旨在为高粱节磷栽培技术和解磷细菌生物有机肥开发奠定理论基础。
1 材料和方法
1.1 试验材料
1.1.1 材料来源
供试菌株:以高粱栽培课题组前期从不同作物根际、不同生境土壤中分离、纯化,并由山西农业大学食品科学与工程学院微生物实验室-80℃保藏和经16S rDNA 序列鉴定的7 株解磷细菌为供试菌株(表1)。
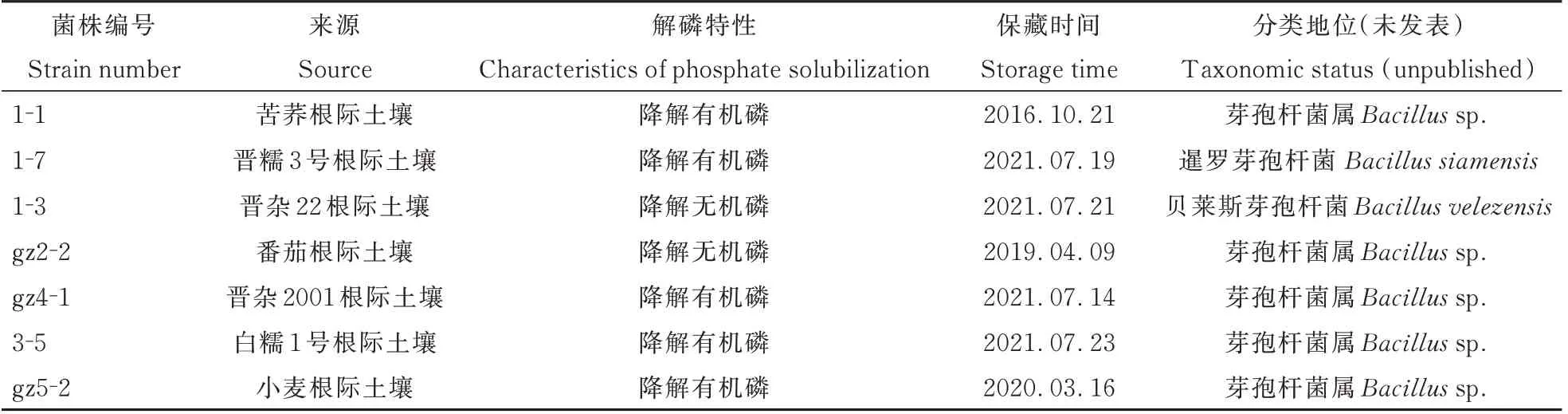
表1 供试菌株编号、来源及解磷特性Table1 Strain number,source and characteristics of phosphate solubilization
供试高粱品种与土壤:供试品种为晋糯3 号、晋杂22 号和晋杂2001 号,由山西农业大学高粱研究所提供。供试土壤为山西农业大学高粱研究所东白试验基地耕地土壤,类型为潮褐土,质地为黏壤土。基础试验田土壤理化性质为:pH 为8.44,有机质20.6 g·kg-1,全氮0.063 g·kg-1,全磷1.23g·kg-1,速效磷10.55 mg·kg-1,速效钾111.4 mg·kg-1。
1.1.2 培养基、主要试剂和仪器
LB 液体培养基、无机磷培养基、有机磷培养基、NA 固体培养基、利福平、Salkowski 显色液等。所用试剂均为国产分析纯。超净工作台(SW-CJ-1FD,浙江苏净净化)、电热恒温培养箱(DH4000A,天津市通利信达仪器厂)、恒温振荡培养箱(DHZD,上海培因实验仪器有限公司)、紫外可见分光光度计(SP-UV2500,上海光谱仪器有限公司)。
1.2 试验方法
1.2.1 高粱根际高亲和性解磷细菌的筛选
(1)解磷菌高粱根际定殖能力测定:首先,参照高振峰等[17]描述的菌株活化方法、利福平抗性菌株诱导方法、遗传稳定性检测方法来对低温保藏的7 株解磷细菌进行活化、利福平抗性诱导和抗性菌株利福平抗性遗传稳定性检测,获得利福平抗性标记菌株;其次,以主栽高粱品种晋糯3 号、晋杂22 号和晋杂2001 号为试验对象,通过田间试验在高粱出苗30 d 后采用灌根接种法将100 mL 于LB 培养液28 ℃、160 r·min-1发酵24 h 且用无菌水调整菌液浓度为1.0×105cfu·mL-1的解磷细菌菌悬液接种至高粱根际,并于接种20 d 后收集根际土壤;最后,参照许昌超等[18]描述的方法,制备根际土壤悬浮液,稀释1.0×105倍后采用平板涂布法于抗生素平板上检测有机、无机磷降解细菌存活数量,进而筛选出可在高粱根际土壤中高效定殖的有机、无机磷降解细菌。
(2)解磷细菌产IAA 能力差异分析:不同菌株接种至LB 培养液中在28 ℃、160 r·min-1条件下震荡培养72 h 后,于8500 r·min-1、4 ℃下离心10 min收集上清液后采用Salkowski 比色法[19]测定不同解磷细菌产IAA 能力,并配制不同浓度IAA 标准溶液(0.5、1.0、5.0、10.0、15.0、20.0、25.0、30.0 mg·L-1)绘制标准曲线(y=0.012x+0.002 9;R2=0.998 4;x代表IAA 浓度/(mg·L-1);y代表OD530),用于发酵液中IAA 含量计算。
(3)解磷细菌促生效果田间试验:于山西农业大学高粱研究所东白试验基地,通过田间小区灌根接种试验测定各菌株对高粱生长的促生作用。菌悬液制备方法与1.2.1(2)相同;菌液灌根浓度和用量分别为1.0×106cfu·mL-1和100 mL;灌根时间为高粱苗后30 d,间隔5 d 连续接种3 次,并于最后一次接种20 d 后,于小区中随机选择10 株测定高粱株高和茎粗。每小区5 m2,每处理重复3次。
1.2.2 菌株间亲和性检测[20]
首先,采用划线法将鉴选出的较优解磷和促生细菌接种至NA 平板上,培养36 h 后,使用接种环分别接种至LB 培养液中,并于28 ℃、160 r·min-1条件下恒温震荡培养48 h;其次,使用无菌水调整菌液浓度 为1.0×104cfu·mL-1,并 取1 mL 涂 布 于NA 平板;最后,待平板表面干燥后,将灭菌的滤纸片(Φ=5 mm)置于平板表面,每平板3 个,并于滤纸片上分别加入不同待测菌株不同浓度菌悬液(1.0×106和1.0×105cfu·mL-1)10 μL(即滤纸片待测菌株浓度分别为1.0×104和1.0×103cfu·mL-1),置于28 ℃恒温培养箱中培养48 h 后,观察滤纸片周围是否形成拮抗圈,并测量抑菌圈大小。所有菌株均被用作平板菌株和测试菌株,进行交叉测试,各处理和试验均重复3次。
1.2.3 高粱根际高亲和性解磷菌复合菌系构建
以复合菌系的OD600吸光值和发酵液中可溶性磷含量为评价指标,通过响应面CCD 设计(表2)对4 株可在3 高粱品种根际良好的定殖的解磷细菌较优组合配比进行优化,从而构建出对难溶性有机磷和无机磷均具有较好降解效果的复合菌系。
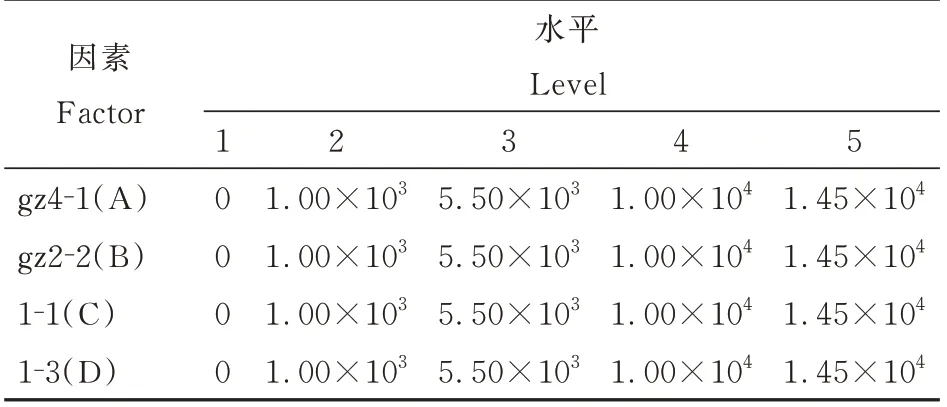
表2 复合菌系响应面CCD 设计因素和水平表Tabe 2 The factors and levels of CCD design for response surface of compound bacteria单位:cfu·mL-1
(1)种子发酵液的制备
将4 菌株分别接种至LB 液体培养基中,于160 r·min-1、28 ℃恒温震荡培养24 h 后,使用无菌发酵液将4 菌株发酵液中的菌浓度统一调整为1.0×105cfu·mL-1后开始后续试验。
(2)解磷细菌复合菌系的构建
首先,依据菌株亲和性测定结果,选择1.0×104和1.0×103cfu·mL-1分别为最低和最高浓度,通过响应面CCD 设计5 个初始混合发酵浓度水平(表2)和30个试验处理;其次,根据设计好的30个试验处理混合好4菌株,按照1%接种量接种至新鲜的有机和无机磷液体培养基中,160 r·min-1、28 ℃恒温发酵培养72 h 后检测各培养液(1.0×104稀释液)在600 nm 下的吸光值和可溶性磷浓度,以空白发酵液为调零对照;再次,通过方差分析中的III 型平方和分析、响应面图、RDA 分析相结合的方法明确不同菌株不同配比下的互作关系,并在此基础上利用III 型平方和分析模型进行复合菌系优选配比组合预测,得出复合菌系不同菌株较优配比组合;最后,通过发酵试验验证预测结果准确性,进而构建出解磷活性突出的解磷细菌复合菌系。
1.2.4 复合解磷菌群对高粱耐低磷特性的影响及促生效果
(1)解磷菌复合发酵液的制备
采用LB 发酵液获得4 菌株单菌株种子发酵液;随后依据1.2.2 中构建的复合菌起始发酵配比混合好4 菌株 接种至新 鲜LB 发酵液中,于160 r·min-1、28 ℃恒温震荡培养72 h 后终止发酵获得复合解磷菌群发酵液,用于后续试验。
(2)田间试验
田间试验于山西省晋中市榆次区山西农业大学东白试验基地(112°40′E,37°32′N,海拔802 m)进行。该试验基地属温带大陆性半干旱季风气候区,春季干旱多风、夏季高温多雨、秋季旱涝无常、冬季寒冷少雪。降雨主要集中于6-9 月,年均气温9~10 ℃,>0 ℃积温3990 ℃,无霜期151 d 左右,最少日照数2535 h,多年平均降水量约450 mm。
以晋糯3 号为试验材料,采用二因素完全随机区组设计,菌液因素设置0、1.0×104、1.0×106、1.0×108和1.0×1010cfu·mL-15 个水平[25];磷肥用量设置:P0(不施磷肥)、P1(减磷1/4)、P2(减磷1/3)、P3(减磷1/2)和P4(减磷2/3);以正常施肥不加菌剂(即正常施用氮225 kg·hm-2、磷75 kg·hm-2、钾肥75 kg·hm-2)为对照(CK),每小区10 m2,于苗后30 d 使用复合解磷菌系发酵液灌根,每株100 mL,每隔7 d 灌根1 次,连续灌根处理4 次,并于最后一次灌根结束后20 d 测定高粱地上部、地下部相关形态指标。对照组采用等量、相同稀释倍数的空白发酵液代替菌液灌根。各处理重复3 次,并在收获期测定各小区产量。
1.3 数据处理
采用Excel 2010 整理试验数据,origin 2018 制作柱形图,SPSS 17.0进行差异显著性分析。
2 结果与分析
2.1 不同高粱品种解磷细菌定殖力差异分析
通过利福平抗性诱导获得了gz4-1、gz5-2、gz2-2、1-1、1-3、1-7 和3-5 抗生素抗性标记菌株,且抗生素抗性标记法定殖力检测结果表明(图1):不同菌株在不同高粱品种根际定殖能力有一定差异;7 株解磷细菌中以菌株gz4-1、gz2-2、1-1 和1-3 在3个高粱品种根际定殖力较优,4 菌株接种20 d 后在3个高粱品种根际的菌落数仍可达4.0×105cfu·g-1以上;菌株gz4-1在晋糯3号高粱根际土壤中的菌落数量明显高于晋杂2001 号和晋杂22 号(P<0.05);菌株gz2-2、1-1 在晋杂2001 号高粱根际土壤中的菌落数量明显高于晋糯3 号(P<0.05),但菌株1-1在晋杂22 号根际土壤中的菌落数量却显著高于晋杂2001 号(P<0.05);菌株1-3 在晋杂22 号和晋糯3 号高粱根际土壤中的菌落数量明显高于晋杂2001号(P<0.05),且在晋杂22 号和晋糯3 号高粱根际土壤中的菌落数量差异不显著。说明,菌株gz4-1、gz2-2、1-1 和1-3 均可在山西主推高粱品种(晋杂22 号、晋糯3 号和晋杂2001 号)根际土壤中良好定殖。

图1 不同解磷细菌在3 种主推高粱品种根际土壤中定殖力差异Fig.1 The differences of colonization ability of different phosphorus solubilizing bacteria in rhizosphere soil of three main sorghum varieties
2.2 解磷细菌产IAA 能力差异及其对高粱株高的影响
以IAA 标品为对照,采用Salkowski比色法对7株高效解磷细菌的产IAA 能力进行分析后发现:7菌株均可分泌IAA,但不同菌株分泌能力存在一定差异;7 菌株产IAA 能力为gz2-2>gz4-1>1-1>1-3>gz5-2>3-5>1-7,且以菌株gz2-2 产IAA 能力最强(25.7 mg·L-1),菌株gz4-1、1-1 和1-3 的产IAA 能力虽然弱于菌株gz2-2,但显著高于菌株gz5-2、3-5 和1-7(P<0.05),且发酵72 h 后的IAA浓度可达8.0 mg·L-1以上(图2)。说明菌株gz4-1、gz2-2、1-1和1-3具有较高促生潜力。

图2 不同解磷细菌产IAA 能力差异Fig.2 Differences in IAA production ability among different phosphorus solubilizing bacteria
另外,通过田间接种试验亦可反映出菌株gz4-1、gz2-2、1-1 和1-3 对高粱生长具有明显促进作用,3 个高粱品种接种4 菌株后的高粱株高均高于菌株1-7、gz5-2 和3-5;3 个高粱品种中菌株gz4-1 和1-3对晋杂22 号和晋糯3 号的株高提高效果,优于晋杂2001;菌株gz2-2 则对晋杂22 号和晋杂2001 的促生效果优于晋糯3 号;菌株1-1 对3 个品种的促生效果无明显差异(P>0.05;图3)。
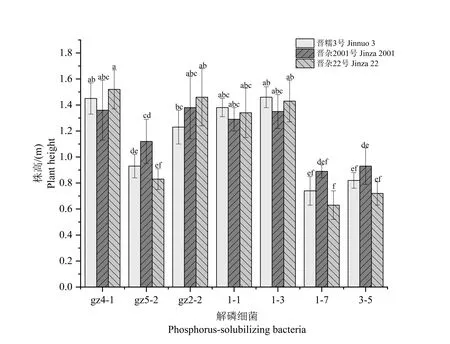
图3 不同解磷细菌对3 种主推高粱品种株高的影响Fig.3 Effects of different phosphorus solubilizing bacteria on plant height of three main sorghum cultivars
2.3 不同解磷细菌间亲和力强度差异
由表3 可见,当菌株1-1 和1-3 作为平板菌株时,菌株1-1 和1-3 之间存在强亲和力,但二者却均与其余2 个测试菌株之间表现为亲和,且当降低菌株gz4-1和gz2-2测试菌株浓度后菌株1-1和1-3与二者表现为弱亲和,而降低菌株1-1 和1-3 浓度后却又表现为强亲和;菌株gz4-1 和gz2-2 之间具有强亲和力,且当二者浓度较高时可增强其与菌株1-1和1-3 之间的亲和力。说明不同菌株之间不同浓度配比会对菌株之间亲和力产生影响[20],且在4 菌株复合菌系构建中应适当降低菌株1-1 和1-3 浓度的同时,提高菌株gz4-1和gz2-2浓度。

表3 菌株间亲和性测试结果Table 3 The results of strains affinity testing
2.4 解磷细菌复合菌系较优配比筛选结果
运用Designexpert 10.0 对表4 的试验数据进行分析,并对CCD 设计试验结果进行二次多项回归拟合,建立OD600、磷浓度(有机组)、磷浓度无机组与4菌株初始复合浓度之间的二次多项数学回归方程:
OD600=1.30+0.055×A+0.13×B-0.11×C+0.025×D+0.11×AB-0.023×AC+0.099×AD+0.15×BC-0.30×BD+0.053×CD+0.073A2+0.035B2-0.011C2+0.051D2;
磷浓度(有机组)=3.05+0.83×A-0.28×B+0.55×C-0.49×D-0.24×AB-0.70×AC+0.067×AD+0.098×BC+0.20×BD-0.38×CD+0.16A2-0.19B2+0.33C2-0.021D2;
磷浓度(无机组)=3.64-0.54×A+0.29×B-0.52×C+1.35×D+0.079×AB-0.15×AC-0.48×AD-0.44×BC-0.54×BD-0.21×CD-0.16A2-0.24B2-0.30C2-0.22D2。
另外,通过RDA 分析(图4)可以看出菌株1-1起始浓度与复合菌系OD600及磷浓度(无机组)之间夹角为钝角,说明菌株1-1 浓度过高会加剧各菌株之间的拮抗效应,且抑制整个复合菌系的难溶性无机磷降解能力;菌株gz4-1 菌株起始浓度与磷浓度(无机组)之间夹角为钝角,但却与磷浓度(有机组)之间夹角为锐角且角度显著小于其余菌株,说明gz4-1 菌株起始浓度的增加会抑制复合菌系难溶性无机磷降解能力,但却显著提升了有机磷降解能力;同 菌株gz4-1 相比,菌株gz2-2 和1-3 则表现出相反结果。另外,依据各菌株与响应指标之间夹角大小及线长度可以得出复合菌系中4 菌株对OD600指标抑制强度大小依次为1-1>gz4-1>1-3>gz2-2;对磷浓度(有机组)的抑制强度大小依次为1-3>gz2-2>1-1>gz4-1;对磷浓度(无机组)的抑制强度大小依次为1-1>gz4-1>1-3>gz2-2。

图4 基于RDA 分析的4 菌株起始发酵浓度与复合菌系OD600、磷浓度(有机组)、磷浓度(无机组)之间的互作关系Fig.4 The interaction between the initial fermentation concentration of four strains and the compound bacteria OD600,phosphorus concentration (organophosphorus treatment),and phosphorus concentration (inorganic phosphorus treatment)based on RDA analysis
通过方差分析(III 型平方和)可知:响应因子OD600、磷浓度(有机组)和磷浓度(无机组)均表现为模型显著和失拟项不显著,说明该模型适用于相关数据分析,且后续分析及较优配比预测结果可靠(表5)。OD600响应因子方差分析和响应面结果显示:因素B(gz2-2)和BD(gz2-2 和1-3)互作对4 菌株复合后的OD600 值影响显著,且BD 互作响应面弯曲度明显大于其它因素两两互作,因此在构建4菌株复合菌群时要注意控制B 因素和BD 互作影响,使其向促进菌株生长方向发展(附图1;表4)。磷浓度(有机组)方差分析和响应面结果显示:因素A(gz4-1)、C(1-1)、D(1-3)和AC(gz4-1 和1-3)互作对4 菌株复合后的有机磷降解效果影响显著(P<0.05),且AC 因素互作后的响应面弯曲度较大,在后期构建4 菌株复合菌群要注意控制A、C、D 和AC互作因素,优化出有利于有机磷降解的较优复合菌群(附图2;表5)。磷浓度(无机组)方差分析和响应面结果显示:仅A(gz4-1)、C(1-1)和D(1-3)单因素会对4 菌株复合后的无机磷降解效果产生显著影响(P<0.05);4 因素两两互作中以BC、BD 和CD 响应面弯曲度较高,但对无机磷降解效果影响不显著(P>0.05),在后期构建4菌株复合菌群要注意控制A、C、D 因素的影响,进而优化出有利于无机磷降解的较优复合菌群(附图3;表5)。因此,综合考虑RDA 和方差分析结果,初步推荐菌株起始浓度大小为gz4-1>gz2-2>1-1>1-3。

表5 基于方差分析(III 型平方和)的各因素与复合菌系OD600 值、磷浓度之间的互作关系Table 5 The interactive relationship between various factors and the OD600 value and phosphorus concentration of the microbial consortium based on analysis of variance(type III sum of squares)
以OD600>1.80、磷浓度(有机组)>4.0 mg·L-1和磷浓度(无机组)>4.0 mg·L-1为限制条件,进行较优配比优化后发现:依据各因素间互作和优化配比限制条件优化出5 个可信度较高(Desirability≥0.966)的较优处理(表6),且根据Desirability 值越大越可靠原则选择序号1 和2 两个配比方案为复合菌群构建较优方案;随后对2 种较优方案进行发酵试验,发现方案1 的OD600、磷浓度(有机组)和磷浓度(无机组)分别为1.85、4.13 mg·L-1、4.07 mg·L-1同预测值相比误差分别为0.54%、0.48% 和0.74%;方案2的OD600、磷浓度(有机组)和磷浓度(无机组)分别为1.89、4.33 mg·L-1和4.26 mg·L-1,同预测值相比误差分别为2.72%、5.60% 和5.45%。2 种优选方案实际测量值均高于预测值,但方案2 误差较大,因此选择方案1 为较优处理。说明菌gz4-1、gz2-2、1-1 和1-3 较优复合菌群配比为:8.75×103、1.33×103、1.00×103和9.9.×103,在该配比下可最大限度发挥4 菌株各自解磷活性,且优化结果与基于RDA 和方差分析的推荐结果一致,说明试验结果可靠性高。
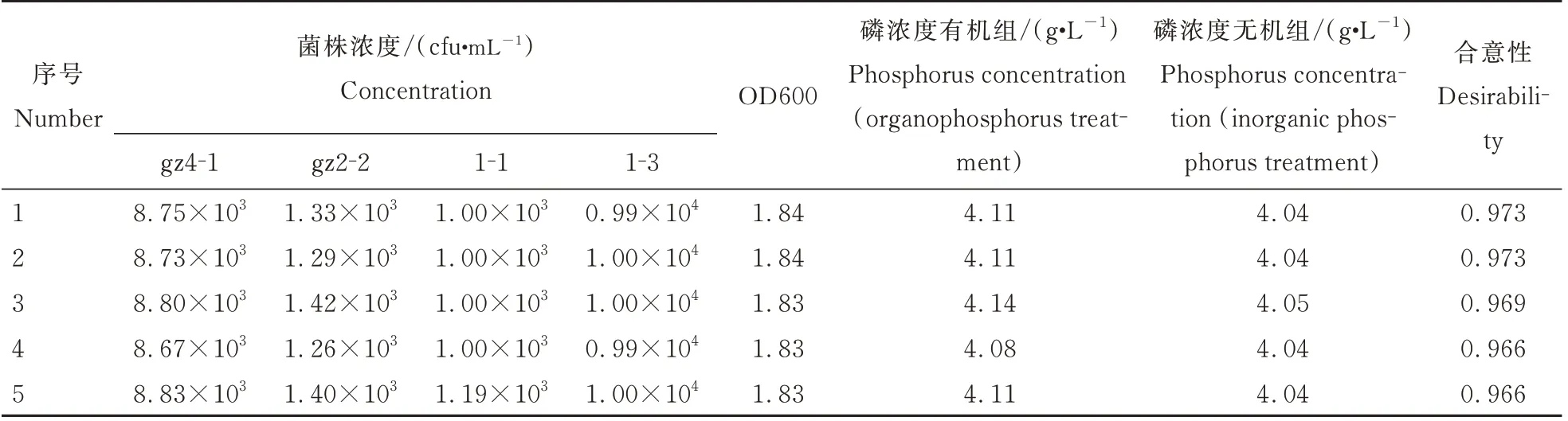
表6 复合菌系起始发酵浓度较优配比优化结果Table 6 Optimal ratio of initial fermentation concentration for the microbial consortium
2.4 复合菌系与单一菌株的解磷及促生能力差异分析
由图5 可见,在有机磷和无机磷培养液中接种复合菌系,发酵72 h 后培养液中的可溶性磷含量和IAA 浓度分别可达0.40 g·L-1和25.0 mg·L-1,且同单一菌株的溶磷能力和产IAA 能力相比显著提升(P<0.05),说明复合菌系很好地强化了4株解磷细菌的溶磷和产IAA 能力,应用潜力显著。

图5 复合菌系与4 种单一菌株的解磷及促生能力差异Fig.5 The difference in phosphorus solubilization and growth promoting abilities between microbial consortium and four single strains
2.5 复合菌系不同接种浓度对高粱地上部表型及产量的影响
田间灌根试验结果表明:不同磷肥减量处理中,高粱地上部株高、茎粗和叶面积均随着解磷复合菌群接种浓度的增大呈现先升高后逐渐下降趋势,较优接种浓度1.0×106~1.0×108cfu·mL-1;在最终产量方面,各磷肥减量处理中除P1(减量1/4)和P2(减量1/3)以接种浓度1.0×108cfu·mL-1产量较高外,其余处理均以接种量1.0×1010cfu·mL-1产量较高,说明磷肥减量程度与复合菌群接种浓度存在正相关关系(表6)。另外,同对照(正常施肥)相比,仅P1 和P2 处理复合菌群接种浓度为1.0×106和1.0×108cfu·mL-1时的高粱地上部表型及产量与对照相当或高于对照,说明本研究构建的复合菌群可使高粱栽培季磷肥减量1/4~1/3,且保障不减产,因此复合菌群田间接种推荐浓度为1.0×106~1.0×108cfu·mL-1(表7)。

表7 复合菌系不同接种浓度对高粱地上部表型及产量的影响Table 7 The effects of different inoculation concentrations of microbial consortium on the phenotype and yield of sorghum
2.6 复合菌系不同接种浓度对高粱地下部表型及生物量的影响
磷肥减量与复合菌群接种浓度互作对高粱地下部表型及干重影响的试验结果表明:不同磷肥减量处理中高粱地下部总根长、总根体积、总表面积和总干重均同样以复合菌群接种浓度为1.0×108cfu·mL-1时最高,且同样在磷肥减量1/4处理(P1)和减量1/3 处理(P2)中,高粱根系形态及生物量在该接种浓度下恢复至对照或高于对照水平(表8)。说明本研究构建的解磷复合菌群对提升高粱耐低磷特性具有较好效果,且较优接种浓度为1.0×108cfu·mL-1。

表8 复合菌系不同接种浓度对高粱根系形态及生物量的影响Table 8 The effects of different inoculation concentrations of microbial consortium on the morphology and biomass of sorghum root system
3 讨论
随着国家“减肥”政策的出台与实施,近年来通过农业技术专家的不懈努力,在稳产前提下,我国虽已集成一批不同作物高效减量施肥技术[21-22],从投入源头上促进了“减肥”的目标实现,但从活化土壤难溶性磷角度来实现磷肥减施目标的相关集成技术还不成熟,这与目前解磷微生物研究以基础研究为主,且主要集中在室内分离、鉴定、解磷特性分析、盆栽试验等方面以及多数离体高活性菌株难以在田间有效定殖和发挥解磷活性有关[10-16]。另外,目前已有大量研究表明,复合菌系在促生、固氮、秸秆降解、土壤修复和物质强化合成等方面具有突出效果[23-27],因此,本研究依托课题组通过室内试验鉴选出的解磷细菌,首先,在大田条件下通过抗生素标记法鉴选出可在高粱根际高效定殖且促生效果明显的解磷细菌;其次,通过竞争培养试验测定优选解磷细菌之间的亲和性,并在此基础上通过响应面CCD 设计发酵试验对不同菌株之间的较优配比进行优化,进而构建复合菌系来强化解磷细菌溶磷效果;最后,通过大田试验对复合菌系与单菌株的田间促生和磷肥减量施用效果进行验证分析,旨在构建可在高粱根际高效定殖且具有较好解磷活性与促生效果的复合菌系,并明确其田间应用潜力,为后期解磷细菌复合菌系生物有机肥产品开发与田间转化应用提供科学依据。
3.1 不同解磷细菌在不同高粱品种根际定殖特性及促生效果差异
在大田条件下抗生素标记法发现菌株gz5-2、1-7 和3-5 虽然在平板上具有较好解磷活性,但难以在主栽高粱品种(晋糯3、晋杂22 和晋杂2001)根际有效定殖,且未表现出良好促生效果,而菌株gz4-1、gz2-2、1-1 和1-3 却表现出较好定殖和促生能力,说明不同菌株在同高粱品种或不同高粱品种根际定殖和促生能力存在一定差异,相关研究结论不仅同郭雨晴等[13](可固氮、溶磷、产蛋白酶的菌株BN5、HN7、BP4、HD3 和SD5 中以节杆菌属BP4 对高粱幼苗促生效果最好,而芽孢杆菌属SD5 却未表现出明显促生效果)、雷学军等[14](菌株WD51 和WD20 具有较好溶磷、产IAA 能力,且对甜高粱促生效果明显优于其余菌株)、赵晨曦等[28](3 株新型钾细菌S-2、S-6、S-12 和磷细菌ACCC10010 具有显著的解磷解钾和促进高粱生长的能力,且促生效果优于其余菌株)在解磷菌溶磷和高粱促生方面的结果相似,而且同郝亚妮等[29]、张慧敏等[30]、申云鑫等[31]研究结论(芽孢杆菌具有较强溶磷、产IAA 能力和促进植物生长作用,但不同菌株同样存在活性差异)相同。然而,同解磷菌资源挖掘报道数量相比,目前有关解磷细菌在作物根际定殖特性和田间促生效果的研究报道还较少,而解磷菌可在作物根际高效定殖又是其转化应用的前提,因此,为促进相关研究成果的落地转化,我们在后期应进一步加强基于大田试验的解磷菌定殖特性和促生菌株鉴选研究,进而形成一批可切实落地转化的解磷菌微生物资源[32]。
3.2 解磷细菌复合菌系的溶磷、促生作用
明确可在高粱主栽品种根际高效定殖且促生效果明显的解磷细菌后,为进一步强化其应用效果,我们采用响应面CCD 设计和发酵试验对其复合菌系解磷效果及菌株间的拮抗效果进行了探究,并对复合菌系的解磷及促生能力同单菌株进行了对比,结果发现4 菌株复合发酵过程中虽会表型出一定的拮抗作用,但经起始发酵浓度优化后有效降低了这种拮抗效应;经4 菌株较优发酵起始浓度配比下形成的复合菌系不仅具备了同时降解难溶性有机、无机磷和促生能力,而且同单一菌株相比复合菌系的难溶性无机、有机磷降解及促生能力均得到明显提高,但难溶性无机磷降解能力提升效果优于有机磷。造成复合菌系对有机、无机难溶性磷降解能力提升效果差异的原因推测可能与菌株1-3 和gz2-2 菌体浓度较高或难溶性无机磷降解相关基因表达量高于有机磷降解相关基因有关,后期需进一步验证。另外,通过构建复合菌系可强化原始单菌株功效的结论同王文丽[25]、韩晓云[26]和刘爱瑜等[33]在防治番茄青枯病、玉米芯生物降解和豆腐渣发酵复合菌系构建研究所得结论相同,说明依托现有资源微生物构建功能性复合菌系可能在农业生产上具有更好应用潜力,且将是后期研究的热点之一。
3.3 解磷细菌复合菌系对高粱的减磷栽培效果
构建出复合菌系后,为进一步明确其在田间的应用潜力,通过大田试验对复合菌系介导下的高粱耐低磷特性、促生效果及优选处理浓度进行了测定,结果表明:复合菌系在田间仍表现出较好应用效果,且在复合菌系菌液浓度为1.0×108cfu·mL-1时可使高粱栽培季磷肥投入量降低1/4~1/3,且不影响高粱正常生长和产量。相关研究结果同杜雷等[34](解磷菌使用浓度达2.0×1010cfu·mL-1时,可使生菜栽培减磷1/2)、戴沈艳等[35](施用伯克霍尔德菌属T4 菌剂可使水稻栽培减磷30%)、刘选帅等[36](双接种丛枝菌根真菌和巨大芽孢杆菌PSB 可使紫花苜蓿减磷1/3)存在一定异同。另外,该复合菌系的解磷能力显著高于目前已报道的甜高粱根际解磷菌WD51、WD20[18]和荒漠珍稀植物根际解磷BP4[17],但产IAA 能力和对高粱的促生效果差异不明显。研究结果不仅再次证实不同菌种或菌株在不同作物之间的解磷功效存在一定差异,而且证实接种解磷微生物可实现磷肥减量施用目标。因此,研究不同作物专用功能微生物相关产品显得尤为重要。
最后,虽然本研究通过抗生素标记、田间试验、响应面CCD 设计、发酵试验等方法鉴选出了4 株可在高粱根际高效定殖的解磷、促生细菌,并构建了经田间试验验证具有良好解磷、促生和减少高粱栽培季磷肥用量效果的复合菌系,但该复合菌系的解磷机制、物化(如:生物有机肥和生物制剂)、不同生态区应用效果和配套使用技术还需进一步研究,以期为高粱低磷栽培技术开发提供新产品和新思路。
4 结论
解磷细菌gz4-1、gz2-2、1-1 和1-3 不仅可在高粱根际高效定殖,还显著促进高粱生长;利用4 菌株构建的复合菌系后显著强化解磷细菌的溶磷和产IAA 能力,且较优起始发酵浓度配比为8.75×103、1.33×103、1.0×103和9.9×103cfu·mL-1;复 合 菌系在接种浓度为1.0×108cfu·mL-1时可使高粱栽培当季减磷1/4~1/3。
