基于p-Akt/p-GSK3β/GSK3β通路灵芝多糖对糖尿病大鼠心肌重构及保护作用研究
2023-11-21牛尚梅王丽萍杨英焘宋潇萌胡新磊
牛尚梅,王丽萍,杨英焘,宋潇萌,胡新磊
作者单位:邯郸市第一医院,a内分泌二科,b心内四科,河北 邯郸056002
糖尿病心肌病(DCM)是由糖尿病引起的严重心肌病变,主要表现为心脏结构和功能异常,最终引发心力衰竭或心源性猝死,也是糖尿病病人的重要致死原因之一[1]。现阶段认为,DCM的主要发病机制为心肌纤维化、心脏自主神经病变、心肌代谢紊乱及心肌细胞凋亡[2]。灵芝多糖(GLP)是灵芝的主要活性组分,具有多种药理作用,如抗肿瘤、增强免疫功能、降血糖、抗衰老、抗炎等[3]。现代药理研究表明,GLP降血糖作用靶点多且效果显著[4]。基于此,本研究于2020年12月至2021年12月采用链脲佐菌素(STZ)腹腔注射法制作糖尿病动物模型,评估GLP对糖尿病大鼠心肌重构的影响。
1 材料与方法
1.1 实验动物 90只SPF级雄性SD大鼠,10周龄,体质量(210±20)g,由上海南方模式生物科技股份有限公司提供,许可证号SCXK(沪)2017-0010,室温饲养。本研究符合一般动物实验伦理学原则。
1.2 药物、主要试剂和仪器 GLP(浓度99%,武汉普洛夫生物科技有限公司),STZ(上海宝曼生物科技有限公司),60%高脂高糖饲料(脂肪热量60%、蔗糖热量22%,南通特洛菲饲料科技有限公司),长效胰岛素(丹麦诺和诺德公司)。转化生长因子-β1(TGF-β1)、基质金属蛋白酶-2(MMP-2)、基质金属蛋白酶-9(MMP-9)酶联免疫吸附测定(ELISA)试剂盒(美国Abcam公司),BCA蛋白定量分析试剂盒(美国赛默飞世尔科技公司),AccuCheck血糖检测仪(德国罗氏公司),丝氨酸/苏氨酸激酶(Akt)抗体、磷酸化丝氨酸/苏氨酸激酶(p-Akt)抗体、糖原合成酶激酶-3β(GSK3β)抗体、磷酸化糖原合成酶激酶-3β(p-GSK3β)抗体(美国Cell signaling technology公司),辣根过氧化物酶标记的山羊抗兔Ig G(英国Abcam公司),RM2235徕卡切片机(德国Leica公司),PowerPac电泳仪、iBright CL750成像系统(美国ThermoFisher Scientific公司)。
1.3 方法
1.3.1 大鼠模型建立 将90只SD大鼠按照随机数字表法分为对照组、模型组、GLP低、中、高剂量组,各18只。参照文献[5]方法,采用高脂高糖饲料喂养联合腹腔注射小剂量STZ的方法建立2型糖尿病大鼠模型:模型组、GLP低、中、高剂量组大鼠连续给予高脂高糖饲料饲喂4周后,检测空腹葡萄糖耐量,72只大鼠均出现胰岛素抵抗,第5周禁食12 h,制备1%STZ溶液(溶于pH4.2的柠檬酸-柠檬酸三钠缓冲液中),一次性腹腔注射30 mg/kg 1%STZ溶液,建立2型糖尿病大鼠模型,在注射STZ 3 d后,大鼠禁食12 h,采集大鼠尾静脉血0.5 mL,检测空腹血糖,非同日连续3次测定血糖均>11.1 mmol/L为造模成功,继续使用高糖高脂饲料饲养8周,维持血糖>11.1 mmol/L。其间血糖过高大鼠皮下注射胰岛素(10 U/kg)治疗,使血糖维持在11.1 mmol/L以上[6]。对照组腹腔注射柠檬酸-柠檬酸三钠缓冲液,以普通饲料喂养。造模期间,模型组死亡3只,GLP低剂量组死亡2只,对照组、GLP中、高剂量组各随机剔除3只、1只、3只,各组均保留15只建模成功大鼠用于实验。
1.3.2 干预方法 GLP低、中、高剂量组均按照10 mL/kg体质量,灌胃浓度25、50、100 mg/kg的GLP[7],对照组和模型组给予等体积生理盐水,每天1次,连续4周。
1.3.3 一般指标观察 在给药前及给药4周后,各组大鼠禁食12 h,称取大鼠体质量,并通过尾静脉采血,检测各组大鼠血糖变化。采血完毕后,断颈处死,打开胸腔取出心脏并除去周围组织,预冷生理盐水冲洗,吸干水分,取左心室(含室间隔部分)在天平上准确称质量。左心室指数=左心室质量/体质量(mg/g)。
1.3.4 组织学观察 各组取10只大鼠的一部分心肌组织10%多聚甲醛中固定1 h后,用磷酸缓冲盐溶液(PBS)漂洗3次×5 min,加入0.1% Trition X-100冰浴孵化2 min,再用PBS漂洗2次×5 min,蛋白酶K常温孵育20 min;PBS漂洗3次后加入TUNEL反应液37 ℃避光孵育60 min;PBS清洗5 min,加入4′,6-二脒基-2-苯基吲哚,PBS清洗5 min×3次,防荧光淬灭封片剂封片。随机计算5个高倍(×400)视野下的红褐色细胞即阳性细胞数。凋亡指数=各视野阳性细胞数/视野所有细胞总数×100%。
一部分含心尖部左心室心肌用10%多聚甲醛中固定24 h后,石蜡包埋制成厚度为4 μm的切片,进行Masson染色,心肌胶原纤维呈蓝色。观察各组大鼠心肌病理变化,用Image J软件分析Masson染色后心肌组织胶原容积分数(CVF)=胶原面积/总面积×100%。
1.3.5 TGF-β1、MMP-2、MMP-9水平检测 取各组剩余5只大鼠心肌组织50 mg,加入1 mL PBS进行匀浆,3 000 r/min离心10 min(离心半径为10 cm),取上清,按照ELISA试剂盒执行各流程,酶标仪450 nm处测定OD值,根据样品吸光度值计算样品TGF-β1、MMP-2、MMP-9浓度。
1.3.6 心肌组织中p-Akt、Akt、p-GSK3β和GSK3β蛋白表达水平 无菌取左心室心肌组织100 mg,加裂解液后充分剪碎,匀浆,离心机离心30 min(4 ℃、12 000 r/mim),蛋白定量后取20 μg样品与等量上样缓冲液混匀,进行SDS-PAGE电泳,100 V电转30 min,转至聚偏二氟乙烯(PVDF)膜上,加入适量封闭液封闭2 h(室温),将膜放入1∶1 000稀释的一抗(p-Akt、Akt、p-GSK3β、GSK3β)中,摇床孵育过夜(4 ℃),TBST洗膜5 min/次,共2次,再放入1∶10 000稀释的二抗,摇床孵育1 h(室温),TBST洗膜每次5 min,共3次,将PVDF膜正面朝上置于凝胶成像仪的显影区,均匀滴加显影液,用滤纸去除PVDF膜周边多余的显影液,避光显色,暗室中进行曝光、显影,采用Image J软件分析,目的蛋白相对表达水平以目的蛋白条带/内参β-actin蛋白条带灰度值的比值表示。
1.4 统计学方法 数据采用SPSS 24.0统计软件处理,采用KS检验计量资料正态分布特性,均符合正态分布,以表示,多组间比较采用单因素方差分析,给药前后血糖和体质量比较采用重复测量资料的协方差分析,两组间比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 一般指标比较 给药前,各组大鼠体质量比较,差异无统计学意义(P>0.05)。给药后,模型组大鼠体质量较对照组降低,血糖、左心室质量和心室指数均较对照组升高(P<0.05);GLP不同剂量组大鼠体质量较模型组增加,血糖、左心室质量和心室指数均较模型组降低(P<0.05);给药后GLP不同剂量组大鼠体质量呈剂量依赖性增加,血糖、左心室质量和心室指数与GLP呈剂量依赖性降低(P<0.05)。见表1,2。
表1 各组大鼠血糖比较/(mmol/L,)

表1 各组大鼠血糖比较/(mmol/L,)
注:GLP为灵芝多糖。①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与GLP低剂量组比较,P<0.05。④与GLP中剂量组比较,P<0.05。
给药后4.45±0.38 20.34±2.78①16.36±1.12①②13.23±0.97①②③9.84±1.01①②③④250.58<0.001组别对照组模型组GLP低剂量组GLP中剂量组GLP高剂量组F值P值鼠数15 15 15 15 15给药前4.34±0.46 20.18±2.34①20.29±2.18①20.46±1.87①19.97±1.94①213.98<0.001
表2 各组大鼠体质量和心室指数比较/
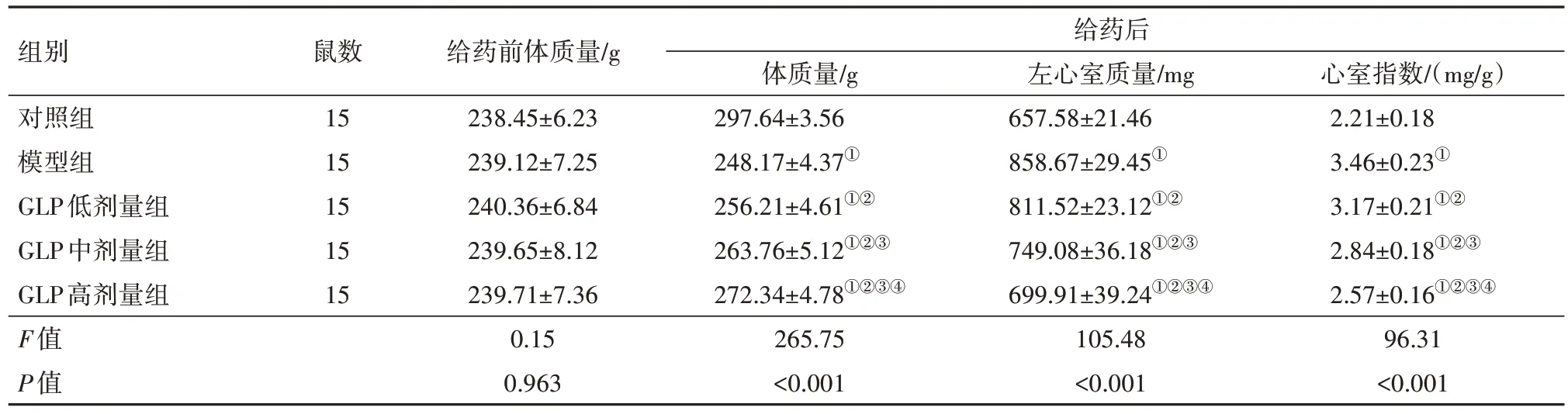
表2 各组大鼠体质量和心室指数比较/
注:GLP为灵芝多糖。①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与GLP低剂量组比较,P<0.05。④与GLP中剂量组比较,P<0.05。
组别对照组模型组GLP低剂量组GLP中剂量组GLP高剂量组F值P值给药后心室指数/(mg/g)2.21±0.18 3.46±0.23①3.17±0.21①②2.84±0.18①②③2.57±0.16①②③④96.31<0.001鼠数15 15 15 15 15给药前体质量/g 238.45±6.23 239.12±7.25 240.36±6.84 239.65±8.12 239.71±7.36 0.15 0.963体质量/g 297.64±3.56 248.17±4.37①256.21±4.61①②263.76±5.12①②③272.34±4.78①②③④265.75<0.001左心室质量/mg 657.58±21.46 858.67±29.45①811.52±23.12①②749.08±36.18①②③699.91±39.24①②③④105.48<0.001
2.2 各组大鼠心肌组织CVF比较 对照组大鼠心肌组织存在少许纤维组织且均匀分布,CVF为(2.59±0.27)%;模型组大鼠心肌组织存在大量纤维组织,有大量束状的蓝色胶原纤维聚集于血管和心肌细胞周围,CVF为(16.12±1.43)%,较对照组心肌组织纤维化严重;GLP各剂量组大鼠心肌组织存在纤维组织,GLP低、中、高剂量组CVF分别为(13.17±1.27)%、(10.41±0.96)%、(7.36±0.62)%,随GLP浓度增加CVF逐渐减少(P<0.05)。
2.3 各组大鼠心肌细胞凋亡指数比较 对照组大鼠心肌组织仅有少量凋亡细胞,凋亡指数为(2.17±0.24)%,模型组凋亡指数为(20.32±1.78)%,较对照组增加(P<0.05);GLP低、中、高剂量组凋亡指数分别为(15.31±1.15)%、(12.18±1.02)%、(9.66±0.74)%,较模型组减少(P<0.05);心肌细胞凋亡指数与GLP呈剂量依赖性降低(P<0.05)。
2.4 各组大鼠心肌组织TGF-β1、MMP-2、MMP-9水平比较 模型组心肌组织TGF-β1、MMP-2、MMP-9水平均较对照组升高(P<0.05);GLP不同剂量组TGF-β1、MMP-2、MMP-9水平均较模型组降低(P<0.05);TGF-β1、MMP-2、MMP-9水平与GLP呈剂量依赖性降低(P<0.05)。见表3。
表3 各组大鼠心肌组织TGF-β1、MMP-2、MMP-9水平比较/(μg/L,)

表3 各组大鼠心肌组织TGF-β1、MMP-2、MMP-9水平比较/(μg/L,)
注:TGF-β1为转化生长因子β1,MMP-2为基质金属蛋白酶-2,MMP-9为基质金属蛋白酶-9,GLP为灵芝多糖。①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与GLP低剂量组比较,P<0.05。④与GLP中剂量组比较,P<0.05。
组别对照组模型组GLP低剂量组GLP中剂量组GLP高剂量组F值P值MMP-9 126.34±10.23 347.65±23.15①302.46±23.48①②257.44±19.77①②③176.17±12.45①②③④117.85<0.001鼠数5 5 5 5 5 TGF-β1 126.34±10.43 257.65±18.15①214.46±17.44①②184.44±14.37①②③163.17±11.54①②③④57.62<0.001 MMP-2 141.23±12.12 268.43±19.35①227.18±17.36①②189.68.±16.89①②③152.74±15.23①②③④51.91<0.001
2.5 各组大鼠心肌组织p-Akt、Akt、p-GSK3β、GSK3β蛋白水平比较 模型组p-Akt、p-GSK3β蛋白表达水平较对照组显著降低(P<0.05);GLP不同剂量组p-Akt、p-GSK3β蛋白表达水平较模型组显著增加(P<0.05);p-Akt、p-GSK3β蛋白表达水平与GLP呈剂量依赖性增加(P<0.05)。见图1,表4。
表4 各组大鼠心肌组织p-Akt、Akt、p-GSK3β、GSK3β蛋白水平比较/

表4 各组大鼠心肌组织p-Akt、Akt、p-GSK3β、GSK3β蛋白水平比较/
注:p-Akt为磷酸化丝氨酸/苏氨酸激酶,Akt为丝氨酸/苏氨酸激酶,p-GSK3β为磷酸化糖原合成酶激酶-3β,GSK3β为糖原合成酶激酶-3β,GLP为灵芝多糖。①与对照组比较,P<0.05。②与模型组比较,P<0.05。③与GLP低剂量组比较,P<0.05。④与GLP中剂量组比较,P<0.05。
p-GSK3β/GSK3β 0.78±0.06 0.39±0.04①0.47±0.03①②0.54±0.04①②③0.64±0.05①②③④56.45<0.001组别对照组模型组GLP低剂量组GLP中剂量组GLP高剂量组F值P值鼠数5 5 5 5 5 p-Akt/Akt 0.93±0.08 0.42±0.03①0.54±0.04①②0.66±0.06①②③0.78±0.05①②③④66.30<0.001
3 讨论
DCM时心肌细胞凋亡增加、心肌间质纤维化。左室舒张功能受损,后期收缩功能亦受损,最终导致心力衰竭[8]。持续高血糖、高血压、脂代谢紊乱、血液黏稠度增加、中心性肥胖、高胰岛素血症、胰岛素抵抗是导致DCM心脏病变的重要原因[9]。该病的早期表现为左心室舒张功能不全,随着病情的进展,逐步出现心肌细胞肥大、心肌纤维化甚至心肌细胞凋亡[10]。有研究[11]表明,GLP可以增强过氧化氢酶和谷胱甘肽过氧化物酶活性从而有效降低血糖水平,对糖尿病小鼠的心肌组织起到保护作用。本研究基于Akt/GSK-3β通路对DCM大鼠心肌组织炎性因子、纤维化因子的水平和心肌组织凋亡水平,进一步研究GLP对DCM大鼠心肌重构及保护作用。
古书记载灵芝具有养心安神、补气益血、滋补强壮、扶正固本的功效,GLP可双向调节人体机能平衡,调动机体内部力,改善新陈代谢机能,提高自身免疫能力,促使全部的内脏或器官机能正常。GLP对血糖、胰岛素敏感性、炎性因子及其血脂水平具有调控作用,但具体调控机制尚需进一步探究。本研究给药后GLP不同剂量组大鼠体质量较模型组显著增加,血糖、左心室质量和左心室指数均较模型组显著降低,提示GLP可以显著降低DCM大鼠血糖和心室指数,改善DCM大鼠心肌重构。有研究[12]表明,GLP显著减少心肌组织丙二醛的产生、增加血清抗氧化酶的活性,降低心肌纤维化程度,延缓糖尿病心肌纤维化并发症的进程。本研究中Masson染色和TUNEL染色可见GLP不同剂量组大鼠心肌组织纤维化区域和凋亡指数均较模型组显著降低,提示GLP有效改善了DCM引起的心肌纤维化与心肌细胞凋亡,改善了心室结构的异常。
TGF-β1是参与心肌胶原重构发生的关键细胞因子,可以促进心肌纤维化形成,是心肌纤维化重要的标志物[13]。TGF-β1对细胞生长分化、细胞外基质沉积也具有潜在作用[14]。MMPs是降解细胞外基质的关键酶,心肌中的MMPs能够降解除多糖以外的所有基质成分[15]。MMP2的过度升高会引起成纤维细胞的增生以及促进炎症细胞向炎症部位趋化、聚集[16]。MMP9能激活生长因子,促进成纤维细胞增殖和活化,导致胶原纤维大量增生[17]。本研究中GLP不同剂量组TGF-β1、MMP-2和MMP-9水平均较模型组降低,提示GLP显著降低心肌组织中TGF-β1、MMP-2、MMP-9水平,抑制心肌组织纤维化,改善心室肌组织异常。
Akt是磷脂酸肌醇-3-激酶下游的重要信号分子,参与调节细胞的分裂、分化、生长、代谢以及凋亡等一系列生理及病理过程,GSK-3β是Akt重要的下游底物之一,活化的Akt能与GSK-3β结合,诱导GSK-3β向细胞膜转位,磷酸化其N端的Ser9活性位点,并使之失活[18]。Akt/GSK-3β通路受损与胰岛素抵抗相关性疾病,如2型DCM[17]、糖尿病肾病[19]、心血管疾病[20]等密切相关。本研究中GLP不同剂量组p-Akt、p-GSK3β蛋白表达水平较模型组显著增加,提示GLP激活了p-Akt/p-GSK3β/GSK3β通路,增强DCM大鼠心肌组织p-Akt和p-GSK3β的表达,表明DCM的保护及治疗作用与Akt/GSK-3β信号通路关系密切。
综上所述,GLP可降低DCM大鼠血糖,改善心脏重构并保护DCM大鼠心肌组织,其机制可能与GLP调节Akt/GSK-3β通路,抑制心肌细胞凋亡和心肌组织纤维化有关,为GLP应用于DCM的临床治疗提供理论支持。但本研究还存在一定局限性,GLP对Akt/GSK-3β通路调控作用,尚需进一步采用特异性激活剂/抑制剂进行验证。
