纳米模拟酶的制备与活性
2023-11-21华绍烽
沈 楠,华绍烽
(河南理工大学,河南 焦作 454000)
天然酶自身的脆弱性与操作不稳定性限制了其在酶催化系统中的广泛应用,纳米模拟酶性能稳定,成本低,既有纳米材料的优良特性,又有生物催化性能。因此,纳米模拟酶成为一种新型生物催化剂[1]。
还原态氧化石墨烯(rGO)性能稳定,其较大的比表面积[2]能够减少磁性纳米材料的聚集,催化位点丰富[3-5],可被用于酶固定化载体。铜基纳米模拟酶因其铜离子价态间的高效转化,表现出良好的类酶活性,可催化H2O2[6]、酚类[7]和胺类[8-9]等物质的转化。Kim K等[10]研究表明,还原氧化石墨烯的褶皱结构能够保护铜纳米颗粒不受过度氧化的影响,从而能够形成稳定的Cu-rGO复合材料。
将磁性纳米粒子与Cu-rGO复合材料结合,形成磁性催化剂,在外部磁场作用下,容易从反应体系中分离,从而获得循环使用的模拟酶催化剂。同时改善磁性纳米粒子易团聚效应[11],适合工业化应用。
本文通过同步还原法制备一种具有类过氧化氢酶活性的纳米模拟酶(Cu-rGO),并将其与磁性纳米粒子结合,进行XRD表征,研究其催化活性以及优化反应条件,最后用于H2O2分解实验。
1 实验部分
1.1 仪 器
紫外分光光度计,Ultrospec 7000,通用电气公司;高速离心机,TG1650-W,湖南沪康离心机有限公司;磁力搅拌器TWCL-G,水浴锅TWLL-G,郑州生元仪器有限公司;超声波清洗器,KX-1740QT,北京科玺世纪科技有限公司;转靶X射线衍射仪,SmartLab(9 kW),日本株式会社理学公司。
1.2 试 剂
石墨粉,8 000目,99.95%,上海麦克林生化科技有限公司;无水硫酸铜,分析纯,天津市河东区红岩试剂厂;氢氧化钠,分析纯,天津市大陆化学试剂厂;过氧化氢,30%,烟台市双双化工有限公司;无水乙酸钠,分析纯,洛阳市化学试剂厂;冰乙酸,分析纯,天津威晨化学试剂科贸有限公司;3,3’,5,5’-四甲基联苯胺(TMB),≥99.9%,上海麦克林生化科技有限公司;无水乙醇,分析纯,烟台市双双化工有限公司;六水合三氯化铁,分析纯,天津市科密欧化学试剂有限公司;氯化亚铁,分析纯,天津欧博凯化工有限公司;氨水、磷酸氢二钠、磷酸二氢钠,分析纯,洛阳市化学试剂厂。
1.3 氧化石墨烯(GO)制备
采用修饰的Hummers法制备了氧化石墨烯[12]。磁力搅拌下,将1.0 g的NaNO3和44 mL浓硫酸添加到250 mL圆底烧瓶中,接着添加1.5 g石墨粉,在冰浴下将反应体系冷却至4 ℃以下。缓慢加入6 g KMnO4(使温度控制在约10 ℃),继续反应20 min后,升温至40 ℃,反应2 h。然后将100 mL 去离子水缓慢滴加到反应体系,升温至85 ℃,反应10 min,再缓慢滴加4.7 mL的H2O2(30%)。冷却,产物经HCl溶液(0.5 mol·L-1)离心洗涤,至上清液与BaCl2溶液不产生沉淀,之后由去离子水离心洗涤至中性。最后,冰水浴中超声(250 W,40 kHz)40 min,离心,干燥,备用。
1.4 Cu-rGO制备[10]
将30 mL的GO水溶液(2 mg·mL-1)与27 mg的CuSO4混合,搅拌(10~15) min,加入2.1 mL的0.5 mol·L-1的NaOH,加热至70 ℃,反应5 min,此时颜色瞬间变成深灰色。自然冷却至室温,快速加入1.8 mL水合肼溶液(80%),搅拌40 min,反应瓶中出现深紫色物质。将产物用过量的乙醇离心洗涤,50 ℃真空干燥。
1.5 Fe3O4制备[13]
将FeCl2·4H2O溶液与FeCl3·6H2O溶液按物质的量比1∶2混合,40 ℃水浴机械搅拌10 min,然后在该条件下缓慢滴加1.28 mol·L-1的NaOH,至pH=10,在氮气气氛下继续反应30 min,得到黑色颗粒(Fe3O4MNPs)。静置,在外部磁场的作用下用去离子水离心洗涤数次,干燥,充氮气保存。
1.6 Cu-rGO-Fe3O4制备
通过共沉淀法制备Cu-rGO-Fe3O4,将Cu-rGO与Fe3O4按质量比2∶1进行混合,常温搅拌15 h,在外界磁场作用下洗涤干燥。
2 结果与讨论
2.1 XRD
在25 ℃和扫描速率10°·min-1条件下,采用软件OriginPro 9.0分析得到的数据,分析其晶体结构。图1为Cu-rGO、Cu-rGO-Fe3O4和Fe3O4的XRD图。
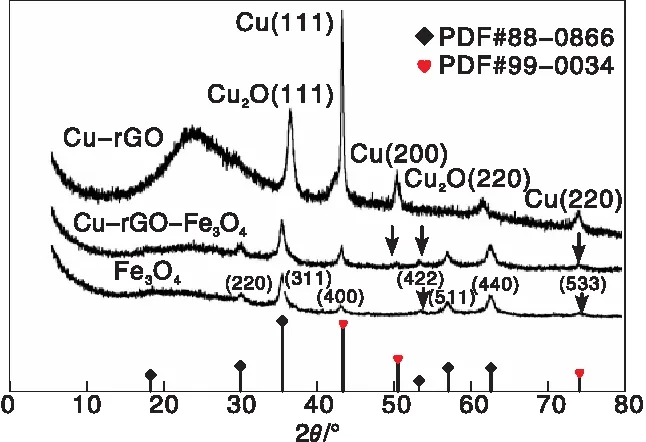
图1 Cu-rGO、Cu-rGO-Fe3O4和Fe3O4的XRD图Figure 1 XRD patterns of Cu-rGO,Cu-rGO-Fe3O4 and Fe3O4
由图1可以看出,2θ=43.4°、50.5°和74.2°的特征衍射峰,可以归属于Cu的(111)、(200)和(220)晶面,表明Cu2+在氧化石墨烯上的还原。Fe3O4的衍射峰出现在2θ=30.2°、35.5°、43.2°、53.5°、57.1°、62.7°和74.1°,依次对应于(220)、(311)、(400)、(422)、(511)、(440)和(533)晶面,表明Fe3O4纳米粒子的成功制备[14]。Cu-rGO-Fe3O4的XRD图中,在2θ=50.5°存在Cu的特征衍射峰,对应(111)晶面,在2θ=43.2°和74.1°的衍射峰强度大于Fe3O4在该处的峰强,表明Cu-rGO与Fe3O4的成功结合,并且反应前后晶体结构保存完好。
2.2 类过氧化物酶活性
(1) 相对活性
H2O2为反应底物,TMB为显色剂,测定Cu-rGO和Cu-rGO-Fe3O4的相对酶活性。将30 μL的TMB、15 μL的Cu-rGO(2 mg·mL-1)或15 μL的Cu-rGO-Fe3O4(2 mg·mL-1)、100 μL的H2O2和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合,在50 ℃条件下反应,蓝色显色后,用紫外-可见分光光度计在652 nm处记录吸光度。吸收峰强度越高,类过氧化物酶活性越高。
相对活性(%)=A1/A2×100%
式中,A1为记录的吸光度,A2为一组中最大的吸光度。A1和A2是在相同条件下测量的吸光度。
(2) 活 性
取5支试管做实验组,1支试管做空白组。空白组加入1.5 mL磷酸盐缓冲液(pH=7.5),1 mL硫酸(8%),1.5 mL蒸馏水。实验组加入1.5 mL磷酸盐缓冲液(pH=7.5)、1 mL硫酸(8%)、不同体积的H2O2(5.402 6 mg·mL-1)和不同体积的蒸馏水,构成总体积4 mL的反应体系。空白组调零,使用紫外分光光度计记录240 nm处的吸光度,绘制H2O2浓度标准曲线。
取2支试管,1支为对照组,按顺序加入1.5 mL磷酸盐缓冲液(pH=7.5),0.1 mL的Cu-rGO(2 mg·mL-1)、0.2 mL蒸馏水、1 mL硫酸(8%)和0.2 mL的H2O2(5.402 6 mg·mL-1)。另1支为实验组,按顺序加入1.5 mL磷酸盐缓冲液(pH=7.5)、0.1 mL的Cu-rGO(2 mg·mL-1)、1.2 mL蒸馏水和0.2 mL的H2O2(5.402 6 mg·mL-1),反应4 min后立即加入1 mL硫酸(8%)终止反应。在240 nm处以蒸馏水调零,分别记录对照组与实验组的吸光度。Cu-rGO-Fe3O4的活性测定同上。
类过氧化物酶活性用每毫克酶在1 min内消耗的H2O2的毫克数来表示。
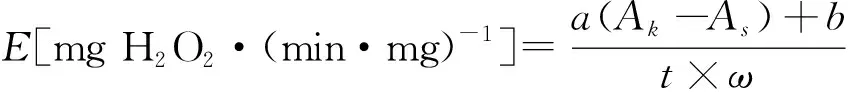
式中,a,b为标准曲线回归方程常数;Ak为对照组吸光度;As为实验组吸光度;t为时间,min;ω为酶的质量,mg。
H2O2在Cu离子催化下产生羟基自由基·OH-,可使显色剂TMB变为蓝色。为了研究Cu-rGO的类过氧化物酶活性,在H2O2存在条件下,以TMB作为显色基质,记录不同体系在50 ℃条件下反应的颜色变化,不同反应体系的紫外-可见吸收光谱和不同纳米模拟酶的活性如图2所示。
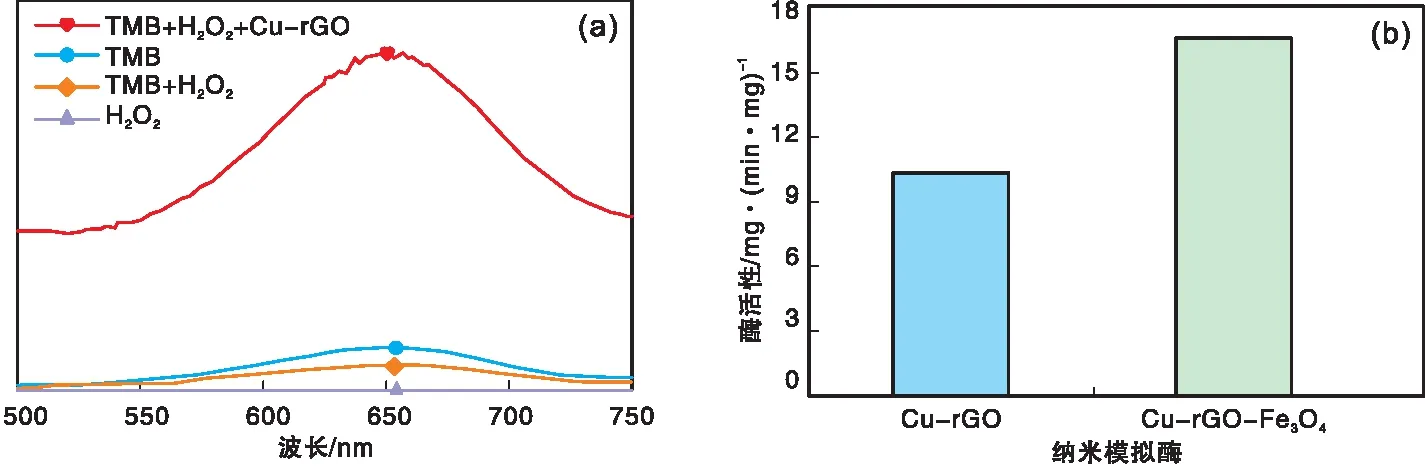
图2 不同反应体系的紫外-可见吸收光谱(a)和不同纳米模拟酶的活性(b)Figure 2 UV-Vis absorption spectra of different reaction systems(a) and cctivity comparison of different nano-mimetic enzymes(b)
由图2(a)可以看出,TMB+H2O2+Cu-rGO体系在652 nm处具有较强的吸收峰,其他三个反应体系没有明显的吸收峰,表明Cu-rGO能够催化H2O2,使TMB发生颜色反应,同时证实Cu-rGO具有类过氧化物酶活性。由图2(b)可以看出,Cu-rGO的类过氧化物酶活性低于Cu-rGO-Fe3O4,这可能因为Fe3O4在Cu-rGO表面的附着减小了粒子之间的团聚效应,增大与底物的接触面积从而提高酶催化活性。
2.3 酶学性质
2.3.1 反应温度
将30 μL的TMB、15 μL的Cu-rGO(2 mg·mL-1)或15 μL的Cu-rGO-Fe3O4(2 mg·mL-1)、100 μL的H2O2和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合,在不同温度下进行反应,利用紫外分光光度计记录吸光度。图3为反应温度对Cu-rGO和Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响。

图3 反应温度对Cu-rGO、Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响Figure 3 Effects of temperature on peroxidase-like activity of Cu-rGO and Cu-rGO-Fe3O4 nanocomposites
由图3可见,在(25~50) ℃,Cu-rGO-Fe3O4和Cu-rGO纳米复合材料的类过氧化物酶活性均随着反应温度升高逐渐升高,在反应温度50 ℃时,催化活性最强,之后随反应温度的升高而下降。故Cu-rGO和Cu-rGO-Fe3O4的最适反应温度为50 ℃。
2.3.2 pH值
将30 μL的TMB、15 μL的Cu-rGO(2 mg·mL-1)或15 μL的Cu-rGO-Fe3O4(2 mg·mL-1)、100 μL的H2O2和2.855 mL不同pH值的醋酸盐缓冲液(0.2 mol·L-1)混合,在50 ℃条件下反应,利用紫外分光光度计记录吸光度。图4为pH值对Cu-rGO、Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响。由图4可以看出,Cu-rGO和Cu-rGO-Fe3O4在pH=3.0时,催化活性最高,故Cu-rGO和Cu-rGO-Fe3O4的最适pH=3.0。
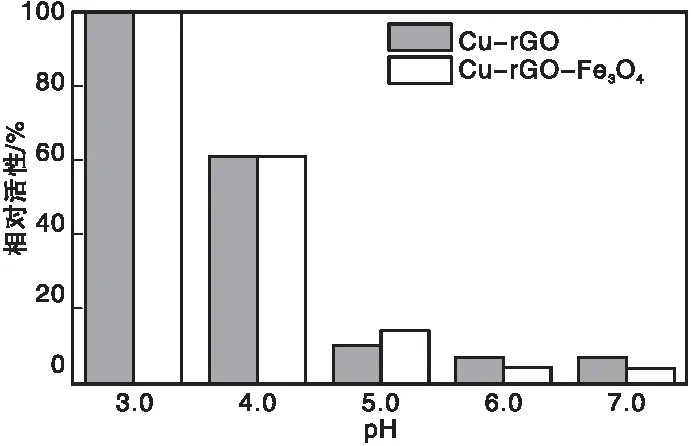
图4 pH值对Cu-rGO、Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响Figure 4 Effects of pH value on peroxidase-like activity of Cu-rGO and Cu-rGO-Fe3O4 nanocomposites
2.3.3 反应时间
将30 μL的TMB、15 μL的Cu-rGO(2 mg·mL-1)或15 μL的Cu-rGO-Fe3O4(2 mg·mL-1)、100 μL的H2O2和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合,在50 ℃下反应,利用紫外分光光度计记录吸光度。图5为反应时间对Cu-rGO、Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响。
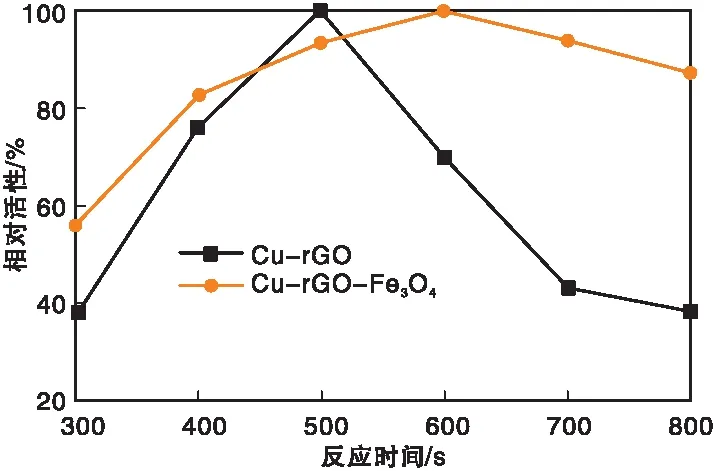
图5 反应时间对Cu-rGO、Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响Figure 5 Effects of reaction time on peroxidase-like activity of Cu-rGO and Cu-rGO-Fe3O4 nanocomposites
由图5可以看出,反应时间500 s前,Cu-rGO的催化速率比Cu-rGO-Fe3O4快。反应500 s后,Cu-rGO的催化活性显著减小,而Cu-rGO-Fe3O4在反应600 s时催化活性最高。故Cu-rGO的最佳反应时间为500 s,Cu-rGO-Fe3O4的最佳反应时间为600 s。
2.3.4 重复性
将30 μL的TMB、6 mg的Cu-rGO-Fe3O4、15 μL蒸馏水、100 μL的H2O2和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合,50 ℃下反应10 min。反应结束后在外界磁场的作用下分离Cu-rGO-Fe3O4,用去离子水洗涤数次,进行下一次循环实验。每次循环实验使用紫外分光光度计在652 nm处记录吸光度。图6为Cu-rGO-Fe3O4反应4个循环后的相对活性。
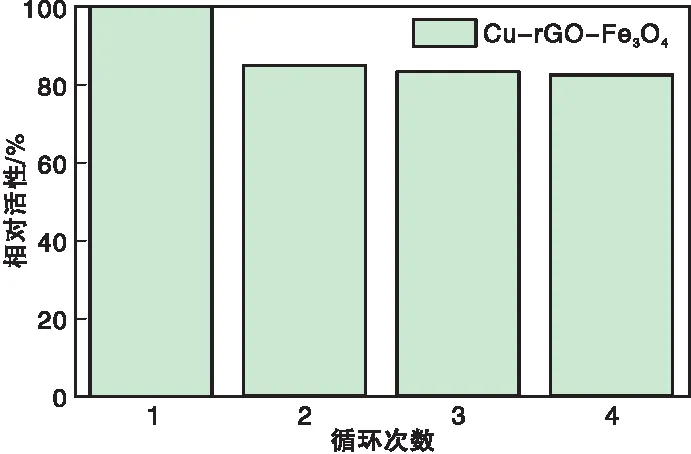
图6 Cu-rGO-Fe3O4反应4个循环后的相对活性Figure 6 Relative activity of Cu-rGO-Fe3O4 after four cycles
由图6可以看出,Cu-rGO-Fe3O4循环反应4次后仍具有80%的催化活性,并且在循环使用过程中酶活性下降缓慢。
2.3.5 TMB浓度
选择30 μL不同浓度的TMB溶液(0.625 mmol·L-1、1.25 mmol·L-1、2.5 mmol·L-1、3.75 mmol·L-1、5 mmol·L-1、7.5 mmol·L-1、10 mmol·L-1、15 mmol·L-1、20 mmol·L-1、30 mmol·L-1)与15 μL的Cu-rGO(2 mg·mL-1)或15 μL的Cu-rGO-Fe3O4(2 mg·mL-1)、100 μL的H2O2和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合反应,利用紫外分光光度计记录吸光度。图7为TMB浓度对Cu-rGO和Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响。

图7 TMB浓度对Cu-rGO和Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响Figure 7 Effects of TMB concentration on peroxidase-like activity of Cu-rGO and Cu-rGO-Fe3O4 nanocomposites
由图7可见,Cu-rGO和Cu-rGO-Fe3O4的催化活性都随着TMB浓度的增大而升高,当TMB浓度为20 mmol·L-1时达到最大催化活性。因此,Cu-rGO和Cu-rGO-Fe3O4的最适TMB浓度为20 mmol·L-1。
2.3.6 H2O2浓度
保持TMB浓度不变,选择100 μL不同浓度的H2O2溶液(0.8 mmol·L-1、1 mmol·L-1、10 mmol·L-1、20 mmol·L-1、30 mmol·L-1、100 mmol·L-1、150 mmol·L-1、200 mmol·L-1、300 mmol·L-1)与15 μL的Cu-rGO(2 mg·mL-1)或15 μL的Cu-rGO-Fe3O4(2 mg·mL-1)、30 μL的TMB和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合反应,利用紫外分光光度计记录吸光度。图8为H2O2浓度对Cu-rGO、Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响。由图8可见,当H2O2浓度为(0.8~30) mmol·L-1,Cu-rGO的催化活性随着H2O2浓度的增大而逐渐增强;当H2O2浓度为30 mmol·L-1时达到最大催化活性,之后随着H2O2浓度的增大而缓慢减小。Cu-rGO-Fe3O4在H2O2浓度为20 mmol·L-1时达到最大催化活性。因此,Cu-rGO的最适H2O2浓度为30 mmol·L-1,Cu-rGO-Fe3O4的最适H2O2浓度为20 mmol·L-1。
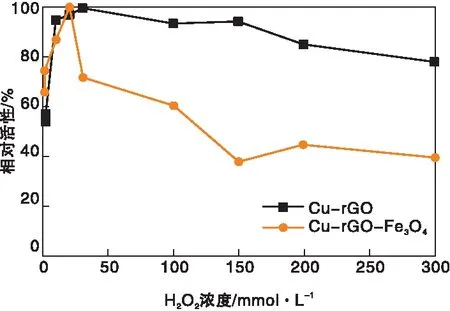
图8 H2O2浓度对Cu-rGO和Cu-rGO-Fe3O4纳米复合材料类过氧化物酶活性的影响Figure 8 Effects of H2O2 concentration on peroxidase-like activity of Cu-rGO and Cu-rGO-Fe3O4 nanocomposites
2.4 底物H2O2浓度范围
将30 μL的TMB、15 μL的Cu-rGO(2 mg·mL-1)、100 μL不同浓度的H2O2和2.855 mL醋酸盐缓冲液(0.2 mol·L-1、pH=3.0)混合,50 ℃下反应500 s,记录紫外分光光度计在652 nm处的吸光度。Cu-rGO-Fe3O4检测底物H2O2浓度范围的方法同上。图9为Cu-rGO-Fe3O4和Cu-rGO催化反应的吸光度与H2O2浓度的线性关系。
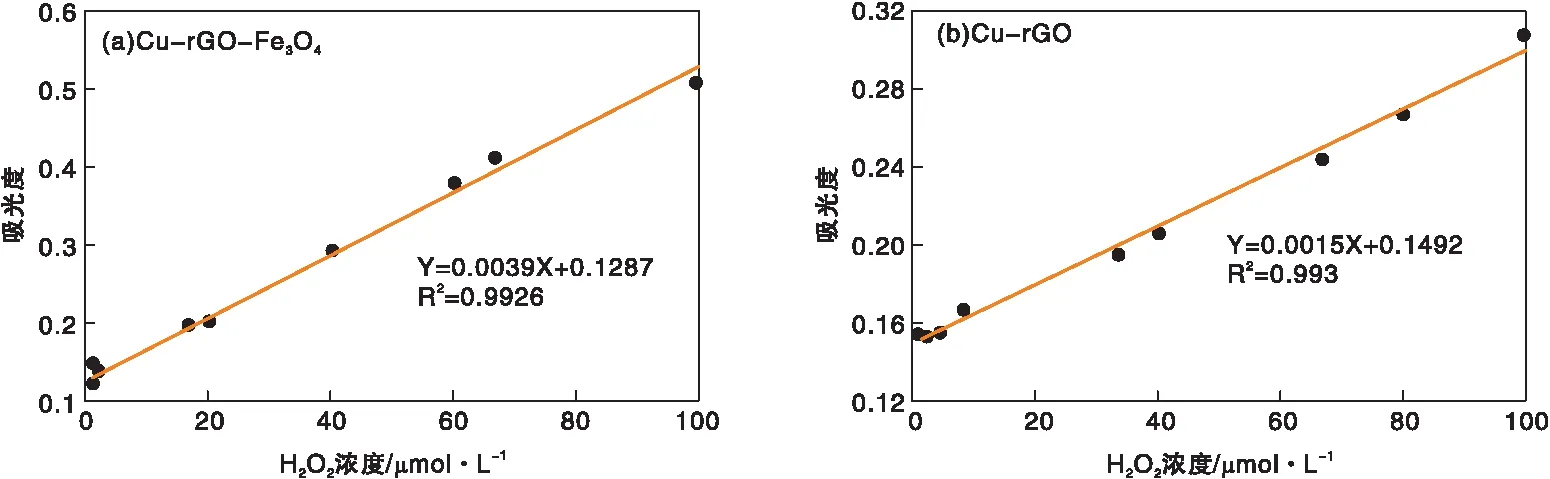
图9 Cu-rGO-Fe3O4和Cu-rGO催化反应的吸光度与H2O2浓度的线性关系Figure 9 The linear relationship between the absorbance with concentrations of hydrogen peroxide using Cu-rGO-Fe3O4 and Cu-rGO catalyst
由图9(a)可以看出,Cu-rGO-Fe3O4在(0.52~100) μmol·L-1,H2O2浓度与吸光度呈良好的线性关系,检出限约0.38 μmol·L-1。由图9(b)可以看出,Cu-rGO在(1.04~100) μmol·L-1,H2O2浓度与吸光度呈良好的线性关系,检出限约1.0 μmol·L-1。因此,Cu-rGO-Fe3O4的灵敏度更高,检测范围更广,具有更好的检测性能。
3 结 论
采用同步还原法制备了纳米模拟酶Cu-rGO,通过共沉淀法制备磁性纳米模拟酶Cu-rGO-Fe3O4,二者具有类似的最适反应温度与最适pH值,Cu-rGO的最佳反应时间为500 s,Cu-rGO-Fe3O4的最佳反应时间为600 s,Cu-rGO的类过氧化物酶活性低于Cu-rGO-Fe3O4。Cu-rGO-Fe3O4循环使用4次后仍具有80%的相对活性,表现出较好的稳定性。Cu-rGO的最佳H2O2和TMB浓度分别为30 m mol·L-1和20 m mol·L-1,Cu-rGO-Fe3O4的最佳H2O2和TMB浓度分别为20 m mol·L-1和20 m mol·L-1。Cu-rGO和Cu-rGO-Fe3O4对H2O2浓度的检出限分别约为1.04 μmol·L-1和0.5 μmol·L-1,Cu-rGO-Fe3O4的灵敏度更高,对H2O2具有更好的检测性能。其中,Cu-rGO和Cu-rGO-Fe3O4对H2O2的选择性,需要进一步条件优化。
