Sfrp5与心血管疾病的相关性研究进展
2023-11-21孔凡玲刘慧程维礼张莱陶琴张郁青
孔凡玲 刘慧 程维礼 张莱 陶琴 张郁青
(南京医科大学附属江宁医院心内科,江苏 南京 211100)
分泌型卷曲相关蛋白(secreted frizzled-related protein,Sfrp)是主要由心外膜脂肪组织产生的一种生物活性分子[1],其结构包含一个含神经导向因子的功能结构域及一个富含半胱氨酸结构域(cysteine-rich domain,CRD)。其成员主要分为三个亚组:Sfrp1、Sfrp2、Sfrp5为第一亚组;Sfrp3、Sfrp4为第二亚组;Sizzled、Sizzled2、新月形为第三亚组[2]。Sfrp5于2010年在Ouchi等[3]的动物实验中被发现其在白色脂肪组织中表达量呈高水平,证实是一种由脂肪组织分泌的新型抗炎脂肪因子。目前认为,Sfrp5作为Wnt信号通路的特异性抑制剂,在细胞分化、增殖、极性和迁移,以及心血管疾病的发生和发展[4-5]等方面均有密切的相关性。Wnt蛋白介导的信号通路依据对β连环蛋白(β-catenin)的依赖与否,分为经典型与非经典型,由于Sfrp5的CRD区域与Wnt信号通路Frizzled受体的CRD区域在形态及结构上高度相似,故能通过内源竞争性抑制非经典型Wnt信号通路中的Wnt5a与Frizzled受体结合,阻断下游c-Jun氨基端激酶(c-Jun N-terminal kinase,JNK)和Ca2+介导的信号转导途径[6]。目前认为,Sfrp5通过与Wnt5a特异性结合,抑制非经典Wnt信号通路,在体内血糖、血脂、炎症反应的调节和心血管疾病的发病及预后等方面均发挥重要作用[7]。
1 Sfrp5与慢性冠状动脉疾病
随着生活水平的提高,慢性冠状动脉疾病(coronary artery disease,CAD)在全球发病率呈逐年升高趋势,加重了世界范围内的社会及经济负担。慢性CAD的发生和发展与体内血脂水平、内皮细胞功能、血管弹性及炎症反应等因素相关。在多种危险因素的暴露及不同炎症因子对血管内皮细胞的刺激下,脂质在冠状动脉内形成斑块样物质沉积,随着血管弹性功能的下降,最终导致慢性CAD的发生。近年来,多篇研究报道了Sfrp5水平与CAD之间的关系[8]。
1.1 Sfrp5调节脂质代谢
脂质代谢紊乱是慢性CAD发病最重要的危险因素之一。研究[9]表明Sfrp5在成熟脂肪细胞中高表达,作为脂肪生成前转录因子,过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)的靶基因,PPARγ可直接与Sfrp5启动子结构域结合并调节Sfrp5启动子活性。在先前的研究中,Liu等[10]研究者指出,Sfrp5通过拮抗Wnt5a/Ca2+通路对PPARγ、CCAAT增强子结合蛋白α(CCAAT/enhancer binding protein α,C/EBPα)的抑制作用,促进脂肪分化,增加白色脂肪细胞数量,且促进脂质在细胞内的累积和血管内皮生长因子的表达,介导血管新生。近年Zhang等[11]发现PPARγ下调miR-21-5p,靶向上调Sfrp5,可抑制脂质在肝脏的积累。这一发现不同于既往研究结果,Sfrp5在细胞和组织水平对脂质代谢的调节方式不同,是否可预防心脏脂肪过度累积尚有待研究。在一项选取11~16岁患代谢综合征的中国青少年的研究[12]中,评估血浆Sfrp5与总胆固醇(total cholesterol,TC)、甘油三酯(triglyceride,TG)的相关性,结果显示,低Sfrp5水平是高TC形成的独立危险因素,随着血浆Sfrp5水平的降低,受试者体内TC水平升高的风险增加约2倍。此过程与Sfrp5下调PPARγ、C/EBPα的表达相关。此外,该研究发现平均年龄越低的人群,其对低水平Sfrp5引起TC水平升高的敏感性越高。在体内试验方面,Li等[13]发现用高脂喂养代谢障碍的大鼠表现出明显的肝脏脂质累积,若向侧脑室注射Sfrp5治疗则抑制了此过程。该研究发现Sfrp5通过作用于胰岛素受体通路(InsR-PI3K-Akt-KATP),减少大鼠体内极低密度脂蛋白(very low-density lipoprotein,VLDL)和TG的分泌。Sfrp5抑制Wnt5a/JNK可使丝氨酸/苏氨酸激酶Akt磷酸化增强,该通路的激活可改善胰岛素抵抗(insulin resistance,IR)带来的脂肪细胞线粒体代谢障碍。综上,最新研究表明Sfrp5在患有代谢功能障碍的人体或大鼠体内可明显下调脂质的分泌和在器官内的堆积,且Sfrp5对青少年时期的血脂水平有显著影响,并具有明显的年龄差异性。
1.2 Sfrp5调节内皮细胞功能
人脂肪细胞分泌的Wnt5a可增强动脉NADPH氧化酶活性,使血管发生氧化还原反应,并诱导内皮功能障碍和内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)解偶联[14]。研究[15]发现给予一定剂量的Sfrp5可改善Wnt5a诱导的人内皮细胞功能障碍,此过程与eNOS依赖性机制相关,且Sfrp5对eNOS的激活作用是通过抑制Wnt5a实现的。最近,Liu等[16]研究了儿童体内Sfrp5和Wnt5a与血管内皮损伤的相关性,在用氧化低密度脂蛋白诱导人脐静脉内皮细胞(human umbilical vein endothelial cell,HUVEC)损伤后,试验发现Sfrp5过表达组,其内皮细胞凋亡率明显下降。这是由于Sfrp5逆转了Wnt5a/JNK对血管内氧化还原的增强效应。在另一项HUVEC模型中,发现Sfrp5过表达时,HUVEC的迁移距离和细胞长度增加,Wnt5a和JNK的表达上调,加用JNK抑制剂后则呈现相反的效果,说明Sfrp5竞争性抑制Wnt5a/JNK通路并促进HUVEC的迁移和生成[17]。此外,Wang等[18]在用血管紧张素Ⅱ、氧化低密度脂蛋白等不同的氧化因素刺激人主动脉内皮细胞后发现,过表达的Sfrp5可通过抑制Wnt通路阻止NADPH氧化酶对血管活性氧的生成,下调细胞凋亡促进基因Bax的表达等方式,保护血管内皮细胞免受氧化刺激的损伤。另外,Wnt5a是评估全身炎症反应的重要标志物,有报道说明Sfrp5抑制Wnt5a对内皮细胞炎症反应有益。Krüger等[19]发现,心脏手术后内皮细胞炎症反应增强,Wnt5a很快达到峰值,Sfrp5使促炎因子Wnt5a被抑制,且在48 h内恢复到基线水平,降低内皮细胞炎症反应,从而减少内皮细胞和心肌受损,但目前尚需更多的临床试验验证Wnt5a是否可用于预测和评估患者心脏手术后全身炎症程度。
1.3 Sfrp5减少动脉粥样硬化形成
动脉粥样硬化是慢性CAD发生的病理生理基础。作为一种慢性血管炎症反应,动脉粥样硬化可涉及全身多处微小动脉,其潜在危险因素包括脂质沉积、内皮细胞损伤、平滑肌细胞和纤维基质成分增生等。Sfrp5对于动脉硬化的保护作用,近年来也引起众多研究者的关注。Tong等[1]的研究表明,低水平Sfrp5和高水平Wnt5a是慢性CAD患者动脉粥样硬化形成的独立危险因素,心外膜脂肪组织Sfrp5 mRNA水平和血清Sfrp5水平均与慢性CAD患者冠状动脉硬化的存在呈负相关,与其他常规危险因素无明显关联。Miyoshi等[20]针对65岁以下人群的研究表明,用ELISA法测定受试者血清内Sfrp5含量后发现,血清Sfrp5较低的人群患动脉硬化性心血管疾病的风险越高。对于65岁以上人群,在Teliewubai等[21]的研究中做出了相应补充,该试验针对65岁以上无症状靶器官损害老年受试者血浆Sfrp5水平统计分析后发现,血浆Sfrp5与颈动脉内膜中层厚度(carotid artery intima-media thickness,CIMT)和脉搏波传导速度(pulse wave velocity,PWV)呈负相关,体内Sfrp5水平较低的老年人CIMT、PWV值更高,动脉硬度增加更为显著,同时发现男性血浆Sfrp5水平较女性普遍降低。该项研究明确了Sfrp5对动脉硬化的保护作用,并提出血浆Sfrp5水平具有性别差异性,可作为老年人动脉硬化的潜在预测因子。而对于代谢功能障碍的患者,Cho等[15]发现在2型糖尿病(type 2 diabetes,T2DM)患者血清中Sfrp5与PWV呈正相关且独立相关,试验结果表明Sfrp5可对代谢功能障碍患者的动脉硬化产生代偿作用。此外,在外周动脉方面,Wang等[22]发现血清和动脉周围脂肪组织中的Sfrp5在外周动脉闭塞性疾病(peripheral arterial occlusive disease,PAOD)患者中表达也显著降低,高水平Wnt5a和低水平Sfrp5是PAOD发病的独立危险因素。综上,Sfrp5能有效减少循环及外周血管动脉粥样硬化的形成,降低患慢性CAD的风险且可作为其预测因子。
2 Sfrp5与急性冠脉综合征
急性冠脉综合征(acute coronary syndrome,ACS)是中国心血管疾病患者死亡的常见原因之一,主要涉及一系列心肌缺血状态。ACS病程进展迅速,目前关于Sfrp5与不稳定型心绞痛和非ST段抬高型心肌梗死相关性的研究甚少,而ST段抬高型心肌梗死(ST segment elevation myocardial infarction,STEMI)因其高发病率、高死亡率的特点,给医疗保健系统带来巨大的经济负担,临床上如何降低STEMI的发生率、改善患者预后显得尤为重要。
近10年来,STEMI患者的诊断数量较前有下降趋势,目前指南侧重于推荐对STEMI患者早期诊断和使患者及时获得缺血再灌注治疗的机会,此类患者在诊断上具有挑战性,病情更复杂且预后更差[23]。Du等[24]指出,患者在发生首次前壁STEMI后,血清Sfrp5水平会显著升高,并在及时接受经皮冠状动脉介入治疗(percutaneous coronary intervention,PCI)后3 d内持续下降至基线水平,对应肌钙蛋白、高敏C反应蛋白水平峰值降低。在后期随访中,超声心动图显示此类患者心脏射血分数值与术前血清Sfrp5水平呈正相关。此研究表明急性期STEMI患者血清Sfrp5水平呈短暂升高趋势,并能有效减少心脏受损和炎症反应,改善STEMI后心肌收缩功能。研究提出Sfrp5是STEMI急性期的潜在治疗靶点和评估预后的有力指标。在用药物对PCI后STEMI患者进一步治疗发现,治疗组患者血清Sfrp5水平较对照组明显升高,相对治疗效果更好。Sfrp5水平的变化可作为评估药物治疗STEMI效果的标准[25]。在多项动物心肌梗死(myocardial infarction,MI)模型中也得到类似验证。Nakamura等[26]构建小鼠缺血再灌注损伤模型,发现在Sfrp5基因敲除的小鼠体内出现更大的梗死面积和更多的心肌细胞凋亡,且伴随着大量炎性细胞浸润和趋化因子的表达,用Sfrp5治疗可显著改善MI后小鼠心脏功能,缩小心脏缺血再灌注损伤后的梗死范围。另一项MI模型研究[27]也表明,随着MI发生的时间推移,Sfrp5的表达起初较高,在7~14 d后逐渐降低。在Sfrp5过表达小鼠体内发现明显的心肌缺血性损伤面积减少,左心功能改善,心脏破裂风险降低,该研究同样发现Sfrp5通过AMPK通路介导线粒体裂变/融合来改善线粒体功能障碍,发挥MI后Sfrp5对心脏功能的保护作用。
3 Sfrp5与心力衰竭
心力衰竭(heart failure,HF)目前仍是一个主要的临床和公共卫生问题[28],呈现出发病率、死亡率高和生活质量差的流行病学特征[29]。作为一种心脏代谢相关的慢性低度炎症性疾病,HF的发生和发展及预后与抗炎因子Sfrp5密切相关。
慢性炎症可视为HF的独立危险因素,多种炎症因子对心血管的长期损害加剧了HF的发生[30]。Wnt5a/JNK信号通路参与了体内炎症因子的表达,该信号通路的激活,以自分泌或旁分泌的方式促进肿瘤坏死因子、白细胞介素等炎症因子的生成[31]。Sfrp5通过特异性抑制此途径,有效改善炎症反应引起的心脏损害。Hong等[32]使用异丙肾上腺素诱导的小鼠HF模型,结果显示Sfrp5通过抑制Wnt5a/JNK信号通路,减轻氧化应激和炎症反应,从而降低小鼠HF发生率。在HF发生后,心肌纤维化和心室重塑的发生、心脏泵血功能的降低等,都对HF患者远期生存率和预后情况有着至关重要的影响。目前一些研究已表明Sfrp5在HF预后过程中的作用。Wu等[30]的研究中选取833例HF患者,其中37.5%患有T2DM,在对多个危险因素进行调整后,研究发现Sfrp5水平每增加1倍,受试者再发HF或死亡的风险便会降低21%。且T2DM患者的HF复发率较非T2DM患者高,与Sfrp5的关联性也更高。提示Sfrp5可作为评估HF或T2DM合并HF患者预后风险的独立生物标志物。An等[33]的试验发现在慢性HF患者体内Sfrp5水平显著高于健康对照组,与纽约心功能分级呈正比,提示Sfrp5与慢性HF患者病情严重程度相关,且在预后不良的患者体内表达升高。另外,Sfrp5可抑制心脏成纤维细胞活化、增殖和迁移,JNK信号通路参与调控细胞的增殖、分化与凋亡。近期有研究[17]发现Sfrp5下调Wnt5a、p-JNK1/JNK1、p-JNK2/JNK2、p-JNK3/JNK3的水平,通过抑制Wnt5a/JNK通路抑制糖尿病小鼠的心肌病理损伤和纤维化。Sfrp5对心脏成纤维细胞的调控功能,能有效降低MI后心肌纤维化带来的心室重塑和HF的发生。
4 Sfrp5与高血压
高血压作为临床最常见慢性病之一,通常不易很早被识别,导致患者就诊率低、依从性差。长期高血压状态加重心脏后负荷,易诱发HF、卒中等严重并发症[34]。最新的研究表明,高血压患者Sfrp5水平均值随血压升高而下降,多元线性回归分析表明,Sfrp5与血压的控制密切相关[35],高血压患者体内Sfrp5水平越低,其发生高血压合并靶器官损害及动脉硬化的风险越高[21]。Yin等[36]的试验包含263例肥胖儿童,其中89例患有高血压,试验发现肥胖伴高血压组患儿血清内Sfrp5水平较肥胖组明显降低,Wnt5a水平明显升高,且Sfrp5水平随着患儿收缩压和舒张压升高而降低,在对患儿的生活方式进行干预后发现,Sfrp5水平显著升高,Wnt5a无明显变化。Sfrp5水平在高血压合并代谢功能障碍患儿体内可因行为干预而受到影响,与血压水平呈负相关。目前已证明炎症可诱发IR,改善胰岛素敏感性可改善内皮细胞功能障碍[37],IR和炎症反应引发内皮细胞生成一氧化氮减少,心血管舒张和弹性功能维持能力降低,从而诱发动脉粥样硬化的发生。血管弹性下降和动脉粥样硬化的形成是高血压的重要危险因素[38],Sfrp5逆转Wnt5a/JNK信号通路对Akt磷酸化的抑制作用,降低动脉粥样硬化的发生率,从而降低人群患高血压的风险。
5 小结与展望
心血管疾病作为一种代谢相关性疾病,近年来多项研究发现其受到多种因素的影响。本综述总结了关于Sfrp5作用于非经典Wnt信号通路(见图1),调控不同心血管疾病的发生、发展及预后,提示临床可加强Sfrp5因子对于心血管疾病干预的关注。虽然部分研究机制尚不完善,例如Sfrp5在脂肪细胞内促进细胞扩张和脂质累积,但是在人体试验及大鼠实验中均发现高水平的Sfrp5可降低患者体内血脂水平,减少脂质在肝脏的累积。部分研究已证实Sfrp5主要通过抑制Wnt5a/JNK信号通路防止心室重塑的生成,目前该类研究甚少,证据尚不充足;暂未发现Sfrp5水平对原发性高血压患者血压水平及靶器官损害的影响等。基于以上研究(见表1),目前仍普遍认为体内高水平Sfrp5有助于改善炎症反应和代谢紊乱对心血管疾病的危害,降低慢性CAD、ACS、HF、高血压的发生率,并在疾病预后方面同样有益。现多项研究将其作为心血管疾病新的预测因子,临床或可利用循环Sfrp5水平作为评估心血管疾病发生、严重程度及预后的手段。Sfrp5有望成为后续治疗心血管疾病的靶向因子。
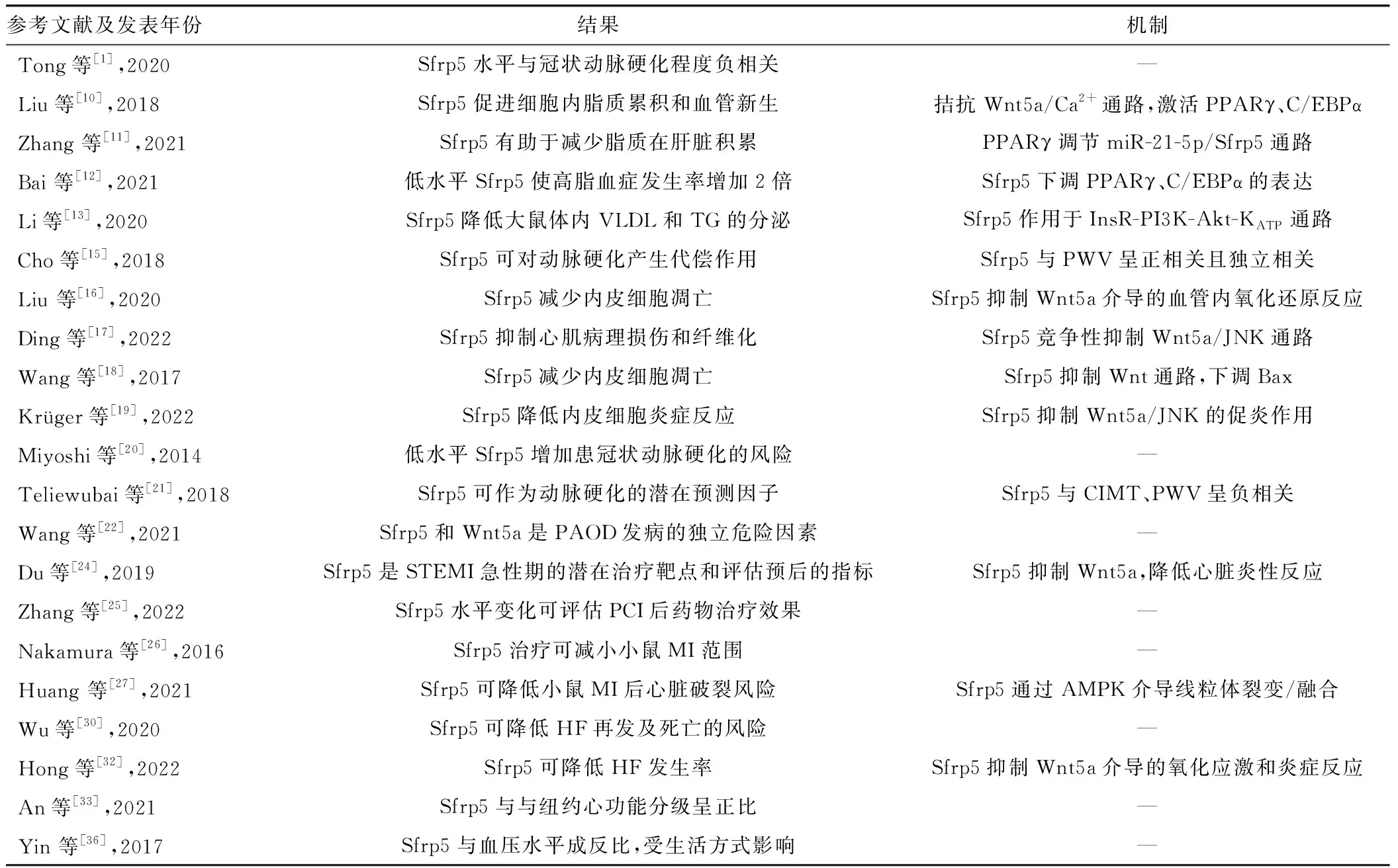
表1 Sfrp5与心血管疾病的相关性报道
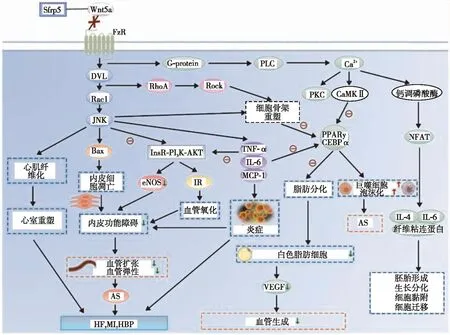
注:FzR,Frizzled受体;DVL,Dishevelled蛋白;Rac1,Ras相关C3肉毒素底物1;Bax,B细胞淋巴瘤-2相关X蛋白;NO,一氧化氮;AS,动脉粥样硬化;HBP,高血压;RhoA,Ras同源基因家族成员A;Rock,Rho相关卷曲螺旋蛋白激酶;TNF-α,肿瘤坏死因子-α;IL,白细胞介素;MCP-1,单核细胞趋化蛋白-1;VEGF,血管内皮生长因子;G-protein,G蛋白;PLC,磷脂酶C;PKC,蛋白激酶C;CaMKⅡ,Ca2+-钙调蛋白依赖性蛋白激酶Ⅱ;NFAT,活化T细胞核因子。图1 Sfrp5与心血管疾病的发病机制