重组人生长激素对特发性矮小症儿童血清IGF-1/IGFBP-3摩尔比的影响及其临床意义
2023-11-18张静静贾媛媛胡苗苗成胜权
张静静,贾媛媛,胡苗苗,成胜权
(中国人民解放军空军军医大学第一附属医院 儿科,陕西 西安 710032)
特发性矮小症(idiopathic short stature,ISS)是我国最常见的生长发育障碍疾病之一,占矮小儿童的60%~80%,临床实践中没有明确的病因[1-2]。重组人生长激素(recombinant human growth hormone,rhGH)被广泛用于治疗由各种原因导致的矮小,包括ISS[2]。其作用机制在于刺激肝脏和其他器官产生胰岛素样生长因子-1(insulin-like growth factor-1,IGF-1),作用于骨骺板中的软骨细胞,促进胶原蛋白和硫酸黏多糖的合成,从而起到促进骨生长的作用[3-4]。目前许多研究人员在努力寻找可以反映rhGH安全性和有效性的合适因子[3-6]。IGF-1浓度是监测和调控rhGH治疗应用最广泛的参数[7]。但由于操作技术困难,很难测定活性形式的游离IGF-1。IGF结合蛋白(IGF binding protein,IGFBP)-3是目前已知与IGF-1亲和力最强的载体蛋白之一[6,8],被认为可提供生长激素(growth hormone,GH)分泌能力的额外信息[7]。然而IGFBP-3的临床价值仍然存在争议,可能是因为IGFBP-3检测数据的参考标准不同。已知IGF-1和IGFBP-3之间的摩尔浓度显著相关,IGF-1/IGFBP-3摩尔比似乎更能准确反映两者的真实结合能力[9]。因此本研究选择学龄期ISS儿童作为研究对象,通过检测rhGH治疗期间血清IGF-1、IGFBP-3水平及IGF-1/IGFBP-3摩尔比变化,希望为预测治疗2年内的生长反应提供更可靠的指标。
1 对象与方法
1.1 研究对象
收集2016年6月至2020年6月我院收治的132例学龄期(6~12岁)ISS儿童的临床和实验室记录并进行回顾性分析。患儿中男82例,女50例。ISS的诊断标准[10]:(1) 根据最新中国儿童生长图表,与年龄、性别和种族相匹配的儿童相比,身高小于平均值的2个标准差或低于平均值的第3百分位数;(2) 出生时体长和体重发育正常,四肢发育良好,无宫内发育迟缓;(3) 无明显的慢性器质性疾病,无染色体异常,无营养不良,无明显或严重的情绪障碍;(4) 使用胰岛素、可乐定、左旋精氨酸、左旋多巴或胰高血糖素进行两种独立的生长激素激发试验,GH峰值超过10 μg·L-1,并且血清IGF-1浓度正常。纳入标准:符合ISS诊断标准;年龄6~12岁;生长缓慢;临床数据完整;按计划接受≥2年的rhGH治疗;已将研究内容告知家属或法定监护人。排除标准:(1) 诊断时的生长学数据不适用;(2) 营养不良,垂体或下丘脑病变,内分泌遗传代谢疾病,各种慢性疾病导致的生长迟缓;(3) 有rhGH治疗史,确诊后1个月内未进行rhGH治疗或rhGH治疗时间不足2年;(4) 在接受2年rhGH治疗前出现青春期体征;(5) 严重肝肾功能障碍、Turner综合征或性早熟。
1.2 治疗方法
基于矮小儿童的诊断和治疗指南[9],rhGH治疗剂量范围为0.10~0.20 IU·kg-1·d-1,0.10~0.15 IU·kg-1·d-1视为低剂量,0.16~0.20 IU·kg-1·d-1为高剂量。所有ISS儿童于每晚睡前1h皮下注射rhGH,注射部位选择大腿外侧到肚脐,每次更换注射部位,至少治疗2年。在治疗过程中,需遵医嘱合理安排患儿健康饮食,充足睡眠,并引导孩子适量进行特定运动。
1.3 生长学和临床数据
入组后获取人体测量数据和病史,包括性别、实际年龄、骨龄、身高、体重、体重指数(body mass index,BMI)、父母身高中位值(mid-parental height,MPH)、青春期状态、rhGH剂量(mg·kg-1·周-1)、GH激发试验中血清GH峰值以及血清IGF-1和IGFBP-3水平。数据从各自的数据管理系统中收集,所有参与中心均提供按照标准程序生成的实验室数据。身高、体重和BMI的标准差分值(standard deviation score,SDS)转换基于《国家学生体质与健康标准》[11],SDS=(儿童的实际值-相同性别和年龄的正常儿童的中位数)/相同性别和年纪的正常儿童的标准差。MPH(cm)计算公式:女童(父亲身高-13+母亲身高)/2;男孩(父亲身高+母亲身高+13)/2。然后将MPH转换为SDS值。骨龄由主治医师使用Greulich-Pyle法[12]对左手腕X线片进行评估。使用Prader睾丸体积器测量睾丸体积。治疗前后数据差值(Δ)=治疗后值-治疗前值。在治疗后(6±1)个月、(12±3)个月和(24±3)个月测定Δ身高、ΔIGF-1和ΔIGFBP-3SDS。根据治疗1年后Δ身高SDS评估儿童生长反应,Δ身高SDS<0.3定义为ISS儿童治疗反应不良,Δ身高SDS≥0.3定义为ISS儿童治疗反应良好。
1.4 血清IGF-1和IGFBP-3水平检测
于治疗前及治疗后6、12、24个月采集禁食8 h静脉血3 ml,与GH不同,血清IGF-1和IGFBP-3水平在一天中不会有太大波动,因此在上午9~11点之间采血即可。2 h内离心分离血清,并储存在-80 ℃。样品保存不超过4个月。采用化学发光法测定血清IGF-1和IGFBP-3浓度,并将IGF-1和IGFBP-3转换为SDS值,具体操作严格按照说明进行。
1.5 统计学处理
所有统计分析均采用SPSS 23.0软件进行。首先进行Shapiro-Wilk正态性检验,文中所用数据均符合正态分布,以平均值±标准差表示,使用重复测量的方差分析比较不同时间点的数值,然后进行事后Bonferroni校正法调整显著性;两组间比较采用独立t检验。Pearson相关分析用于评估正态分布指标之间的相关性。在rhGH治疗的第2年,使用Δ身高 SDS和ΔIGF-1 SDS、ΔIGFBP-3 SDS作为固定因素变量,基线时身高作为协变量,进行协方差(ANCOVA)分析。P<0.05被认为差异有统计学意义。
2 结 果
2.1 ISS患儿基线实验室结果
所有ISS患儿平均年龄(9.14±2.17)岁,平均骨龄(8.35±2.11)岁,平均BMI(14.72±1.57)kg·m-2,平均身高(121.45±15.08)cm,基线血清IGF-1水平为(120.11±59.50)ng·ml-1,血清IGFBP-3水平为(2 374.61±1 082.65)ng·ml-1,IGF-1/IGFBP-3摩尔比为0.07±0.01;rhGH初始剂量为(0.25±0.06)mg·kg-1·周-1,GH峰值水平为(20.26±12.93)ng·ml-1。
2.2 身高及血清IGF-1、IGFBP-3水平变化
在rhGH治疗前,ISS患儿身高SDS为-2.75±0.62(-4.73~-1.91),在整个治疗过程中,患儿身高SDS有显著改善(P<0.001)。rhGH治疗1年和2年后,IGF-1 SDS、IGFBP-3 SDS以及IGF-1/IGFBP-3摩尔比SDS均增加,与基线相比差异有统计学意义(P<0.05);然而治疗2年时,血清IGF-1 SDS和IGFBP-3 SDS与治疗1年时相比差异均无统计学意义(P>0.05)。见表1、图1。
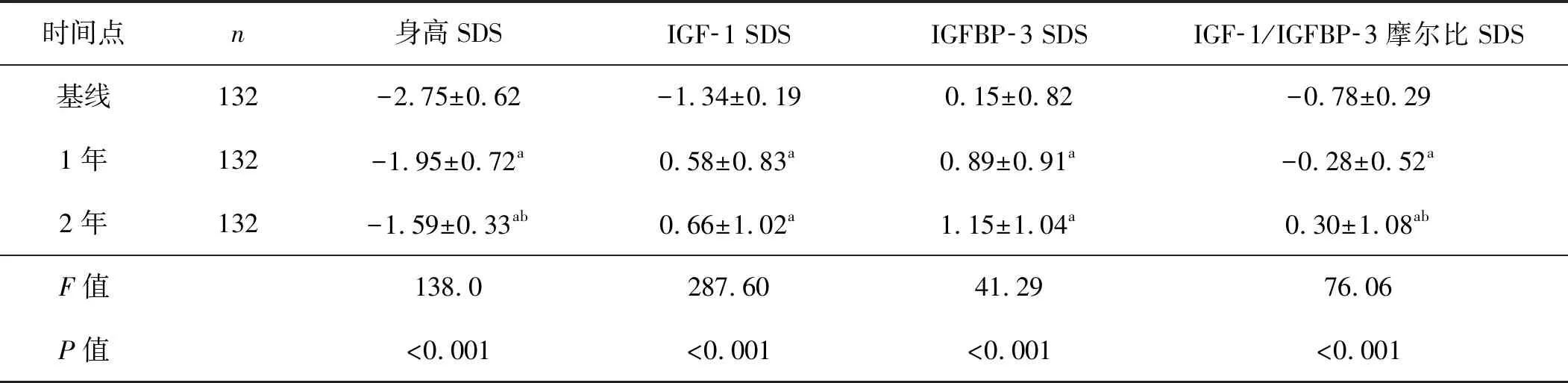
表1 ISS患儿rhGH治疗开始时和治疗期间的身高及血清IGF-1、IGFBP-3水平
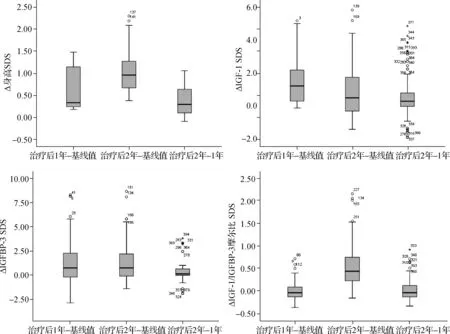
图1 ISS患儿rhGH治疗开始时和治疗期间的身高及血清IGF-1、IGFBP-3水平变化趋势
2.3 基线时血清IGF-1/IGFBP-3水平与rhGH治疗1年后生长反应的关系
共有12例儿童治疗反应不良,120例儿童治疗反应良好。反应不良的ISS儿童在rhGH治疗开始时的实际年龄(P=0.007)、骨龄(P=0.006)明显大于反应良好儿童,IGF-1/IGFBP-3摩尔比(P<0.001)和IGF-1/IGFBP-3摩尔比SDS(P=0.014)明显低于反应良好儿童,而两组患儿性别、MPHSDS、BMI SDS、血清IGF-1和IGFBP-3水平差异无统计学意义(P>0.05,表2)。进一步校正年龄因素对IGF-1/IGFBP-3摩尔比的影响,经多因素Logistic回归分析后,基线时IGF-1/IGFBP-3摩尔比SDS较低仍是影响rhGH治疗反应不良的独立危险因素(非标准化系数=-5.686,Exp(b)=0.003,95%置信区间0.001~0.058,P<0.001)。

表2 rhGH治疗1年后反应良好和反应不良儿童的基线特征
2.4 Δ身高SDS与血清ΔIGF-1、ΔIGFBP-3水平及ΔIGF-1/IGFBP-3摩尔比的相关性
治疗1年后ISS患儿Δ身高 SDS与ΔIGF-1(r=0.131 9,P=0.023 9)、ΔIGF-1/IGFBP-3摩尔比(r=0.133 1,P=0.022 5)、ΔIGF-1/IGFBP-3摩尔比SDS(r=0.153 9,P=0.008 2)呈正相关;而治疗2年后ISS患儿Δ身高 SDS与ΔIGF-1/IGFBP-3摩尔比(r=0.129 8,P=0.034 8)、ΔIGF-1/IGFBP-3摩尔比SDS(r=0.124 5,P=0.036 7)呈正相关。在治疗1年和2年后,ISS患儿Δ身高SDS与血清ΔIGFBP-3或ΔIGFBP-3 SDS水平无相关性(表3)。在ANCONA分析中,进一步校正作为协变量的基线身高后,治疗2年后Δ身高SDS与ΔIGF-1/IGFBP-3摩尔比SDS(r=0.035 2,P=0.046 7)呈正相关(表4)。
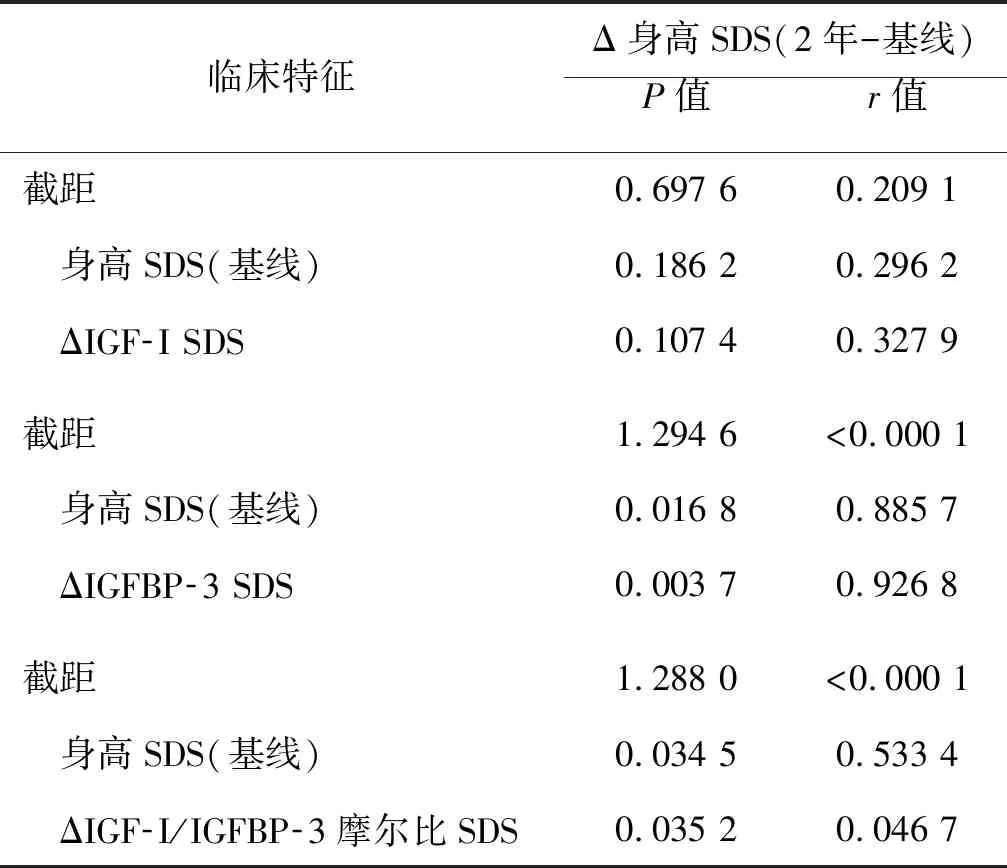
表4 rhGH治疗2年后Δ身高SDS的协方差(ANCOVA)分析
3 讨 论
在本研究中,我们初步证明了血清IGF-1/IGFBP-3摩尔比在充分反映学龄期ISS儿童rhGH治疗2年身高结局方面的有用性。我们发现,ISS患儿对rhGH治疗的反应与ΔIGF-1/IGFBP-3摩尔比和ΔIGF-1/IGFBP-3摩尔比SDS呈正相关,但是与IGF-1或IGFBP-3单独指标浓度变化的相关性并不十分密切。这提示治疗2年期间ISS儿童身高的持续增加与血清IGF-1/IGFBP-3摩尔比SDS的升高有关。
rhGH治疗第1年的生长反应是长期身高增长的最佳指标之一[7]。初始生长速率、rhGH治疗3个月后的骨重塑标志物水平和身高SDS已被用于评估治疗反应[13]。在本研究中,使用身高SDS作为治疗反应评估指标,发现ISS患儿在治疗1年后呈现良好的Δ身高SDS。说明大多数学龄期ISS儿童在接受rhGH的第1年时都获得了满意的身高增益反应。此外,rhGH治疗1年后,治疗反应良好的患儿开始治疗时的实际年龄和骨龄相对较低,提示早期诊断和rhGH治疗在ISS儿童中的重要性;然而两组不同治疗反应的患儿MPH无差异。因此仅通过MPH等临床数据判断生长反应性是不够的。
GH-IGF-1轴是控制儿童线性生长的内分泌系统的关键[14]。GH通过作用于肝脏来调节IGF-1的释放,从而调节儿童期的骨生长[15]。IGF-1分泌不依赖于昼夜节律或脉动[8]。然而,循环IGF-1水平却受到许多激素的影响,如胰岛素[16]、甲状腺激素[17]和性激素[18]。低水平的雌激素会刺激IGF-1的分泌,而高水平的雌激素会减少IGF-1的分泌[18]。在本研究中,受试者均无营养不良、慢性内分泌/营养/炎症疾病和青春期前疾病。IGF-1与循环中的特定IGFBP结合,其中IGFBP-3在IGF-1的代谢中起重要作用[7]。IGFBP-3通过结合抑制IGF-1的生物活性,从而降低循环中游离IGF-1的浓度[7]。IGFBP-3通过其酸不稳定亚基与IGF-1形成三元复合物,这种复合物的形成延长了其在循环中的半衰期[19]。IGF-1游离形式的半衰期约为10 min,三元复合物形式的半衰期为12~15 h[20]。因此在本研究中,我们将IGF-1/IGFBP-3摩尔比作为生长标志物。
本研究结果显示,基线时血清IGF-1/IGFBP-3摩尔比SDS较低是影响ISS儿童rhGH治疗反应不良的独立危险因素,提示基线时低血清IGF-1/IGFBP-3摩尔比SDS与身高增加反应不良有关。此外,rhGH治疗1年和2年后的ISS患儿Δ身高 SDS与ΔIGF-1/IGFBP-3摩尔比(r=0.133 1,P=0.022 5)、ΔIGF-1/IGFBP-3摩尔比SDS(r=0.153 9,P=0.008 2)均呈正相关;而且校正作为协变量的基线身高后,治疗2年后Δ身高SDS与ΔIGF-1/IGFBP-3摩尔比SDS(β=0.035 2,P=0.046 7)也呈正相关,提示学龄期ISS儿童rhGH治疗后的身高反应与IGF-1/IGFBP-3摩尔比及其SDS变化有关。此外,我们还发现治疗1年后ISS患儿Δ身高 SDS与ΔIGF-1呈正相关,但是未观察到与ΔIGFBP-3浓度的关系,这可能是因为IGFBP-3在某些条件下(如炎症)分泌后会被蛋白酶裂解[9]。此外,片段化的IGFBP-3没有功能[7]。这些都增加了使用血清IGFBP-3水平作为监测rhGH疗效工具的不确定性。在本研究中,与rhGH治疗反应不良的儿童相比,治疗反应良好的儿童具有更高的基线IGF-1/IGFBP-3摩尔比及其SDS,提示基线IGF-1/IGFBP-3摩尔比及其SDS越高,rhGH治疗反应良好的可能性越大。而IGF-1/IGFBP-3摩尔比越高意味着IGF-1相对于IGFBP-3的不平等增加,提示他们体内游离IGF-1的比例更高,这可能反映了IGF-1基因对GH作用的更高敏感性。总之,本研究结果提示IGF-1/IGFBP-3摩尔比,尤其是IGF-1/IGFBP-3摩尔比SDS可能更适合作为监测接受rhGH治疗的学龄期ISS儿童身高反应的工具。
本研究也有几个局限性。首先,回顾性研究的设计导致收集的一些数据相对不完整,因此本研究只能尽可能地纳入基础信息相对较完整的患者。下一步的工作重点还是需要进行前瞻性研究,以证实该结论的可靠性。第二,入组ISS患儿数量有限,且研究周期较短。因此我们会在达到成年身高后进行进一步的回顾性研究,以验证基于前2年生长和激素反应预测的成人身高是有用和准确的。第三,缺乏血清胰岛素、IGF-2、游离IGF-1等指标。第四,尽管已经将诊断出基因异常的儿童排除在外,但并非所有患者都接受了矮小基因测试。由于儿童的身高是通过多基因的方式遗传自父母[21],因此需要通过基因分析来找到一个良好反应群体。尽管如此,本研究结果对于分析IGF-1/IGFBP-3摩尔比与生长反应的关系亦有一定的参考意义。
综上,本研究中大多数学龄期ISS儿童在接受rhGH治疗的前2年,身高都有一定程度的增加,且血清IGF-1和IGFBP-3逐渐正常化,然而治疗反应良好的儿童基线时IGF-1/IGFBP-3摩尔比及其SDS更高,且基线IGF-1/IGFBP-3摩尔比SDS较低是影响rhGH治疗反应不良的独立危险因素,此外校正作为协变量的基线身高后,治疗2年后Δ身高SDS与ΔIGF-1/IGFBP-3摩尔比SDS呈正相关。因此,我们有理由认为血清IGF-1/IGFBP-3摩尔比SDS可能更适合作为预测学龄期ISS儿童接受rhGH治疗后身高反应的生物标志物。此外,本研究结果可能有助于改善接受个性化rhGH治疗儿童的总体生长结局。
