脑卒中伴吞咽障碍患者行胃造瘘术后营养状况的影响因素及列线图分析
2023-11-18高艳芳康春博邓海连
高艳芳,康春博,邓海连,高 雅
高艳芳,康春博,邓海连,首都医科大学附属北京康复医院胃肠康复中心 北京市 100144
高雅,首都医科大学附属北京康复医院神经康复中心 北京市 100144
0 引言
我国每年约有300万例新发脑卒中病人,死亡人数达110万人,死亡率为36.67%,脑卒中已成为我国人群的主要死因之一,给患者家庭和社会医疗带来了巨大负担[1].有近50%的脑卒中患者因脑桥或延髓损伤导致迷走神经或舌咽神经受损而引起吞咽障碍,或因广泛的大脑皮层及白质损伤出现意识障碍而无法自主吞咽[2].早期吞咽困难易诱发患者发生吸入性肺炎、内环境紊乱和营养质量欠佳,进一步导致患者功能下降和生活质量降低,甚至增加致残率和死亡率.临床上,对于合并吞咽障碍的患者多采用管饲肠内营养的方法来维持患者所需营养.行经皮内镜下胃造瘘置管术(percutaneous endoscopic gastrostomy,PEG)[3]是管饲肠内营养的方法之一,具有创伤小、维持时间长等优点,已被广泛应用于无法长期经口进食患者的长期营养干预中[4].由于患者的特殊性,在脑卒中伴长期吞咽障碍的患者中,接受PEG后影响营养状态的因素仍不明确,这都增加了此类患者的不良预后风险.鉴于此,本研究评估了我院收治的PEG术后脑卒中伴吞咽障碍患者营养状况的影响因素并构建列线图预测模型,以期为脑卒中伴吞咽障碍的营养干预提供参考.
1 材料和方法
1.1 材料 本研究已得到医院伦理委员会的审批(审批号:2018bkkyLW021)并获得了患者与家属的知情同意,所有研究对象均签署知情同意书.采用回顾性队列研究的方法,纳入2018-06/2022-06间于首都医科大学附属北京康复医院接受PEG术并完成随访12 wk的108例脑卒中合并吞咽障碍患者为研究对象,利用营养风险筛查2002量表(Nutrition Risk Screening 2002,NRS 2002)调查研究对象的营养不良发生风险状况.
纳入标准:(1)符合脑卒中合并吞咽障碍临床诊断标准,且需要长期(3 mo以上)营养支持者;(2)急性脑卒中后均给予了鼻胃管饲,鼻饲营养3 wk-4 wk吞咽功能仍未恢复后行PEG者;(3)于我院顺利完成PEG术并建立有效随访至术后12 wk者;(4)年龄≥18岁;(5)预计生存期不低于6 mo.排除标准为:(1)合并有其他典型器质性病变如心脏、肾脏、肺功能异常者,癌症患者;(2)合并严重消化道、腹膜炎、凝血功能障碍、败血症及器官功能障碍者;(3)妊娠或者哺乳期妇女等;(4)有精神病史,长期卧床者.
1.2 方法 PEG置管与肠内营养方案:所有纳入的研究对象均统一遵照相关临床标准由专业医师进行PEG置管和给予肠内营养干预.行PEG置管前患者要严格禁食12 h以上,由操作经验丰富的医师从口腔插入胃镜,观察胃粘膜情况,胃充气后再选择胃前壁为穿刺点,用2%的利多卡因进行局部麻醉,切开腹壁皮肤,用胃镜光纤定位后,用穿刺针从腹壁刺入胃内,穿入导丝,用活检钳拉出导丝到口腔外后退出胃镜,用导丝引导胃造瘘管(美国强生)从胃内拉至体外,消毒后固定.再次插入胃镜观察胃造瘘导管的固定及在位情况,是否有胃内壁出血等并发症,并调整胃造瘘管指向十二指肠方向.术后指导患者或家属进行瘘口的护理和管饲喂养.行PEG患者均在术后给与适量匀浆膳粉配合肠内营养乳进行营养支持,根据患者病情及体质,每日管饲液量在2500 mL-3500 mL间,管饲量应根据患者胃肠道及心肾功能酌情调整,并核算其所需营养[5],重症急性应激期患者能量供给20-25 kcal/(kg·d)(1 kcal=4.184 kJ,下同),轻症非卧床患者能量供给25-35 kcal/(kg·d),膳食纤维摄入应尽可能接近到25-30 g/d,且脂肪量低于总摄入能量的35%,饱和脂肪酸低于10%,多不饱和脂肪酸6%-11%.
1.3 资料搜集方法
1.3.1 一般资料表:用自制的包含患者年龄、性别、卒中类型、体质量指数(body mass index,BMI)指数、进一步医治情况(若患者就自身营养状况接受了任何相关治疗如皮下注射胰岛素、辅助肠外营养、使用糖皮质激素或免疫抑制剂、输血治疗、中医内科治疗等则被认为是接受了进一步的治疗)、家庭经济条件(差:收入<2万元/年,中等:2-10万元/年,良好:>10万元/年)等资料统计表,部分临床资料来自住院部或门诊电子病历档案.
1.3.2 NRS 2002:利用NRS 2002对患者术前(术前一天)及行PEG术12 wk后营养风险进行评估,量表包括营养状态受损程度(由人体质量、近期体重减轻、饮食摄入量减少3个变量进行评估)和疾病严重程度2个部分评分组成,得分范围为0-7分,具有较高的适用性.其中,NRS 2002评分<3分则为低营养风险,NRS 2002评分³3分则为高营养风险[6],并以此标准对入组患者的营养风险等级进行划分.
1.3.3 血清营养指标:对患者术前(术前一天)及行PEG术12 wk后晨起空腹静脉血中的血清总蛋白、白蛋白、血红蛋白等血清营养指标进行采集.
1.3.4 术后12 wk内感染、并发症及疾病进展情况:统计患者PEG术后12 wk内发生感染、并发症及疾病进展情况,其中,感染包括局部/系统如造瘘口感染、中枢神经系统感染、肺部感染、消化道感染、泌尿系感染等;PEG营养相关并发症包括消化道出血/血肿、伤口感染、反流性食管炎、造瘘口旁渗出、瘘口堵塞等;病情进展:若患者有新发颅内出血灶出现(原发出血或继发出血)可认为出血灶存在进展[7];存在神经功能的重度缺损与恶化如出现走路不稳、认知下降,伴随有全身性的症状如意识障碍、瞳孔散大、生命体征不稳定或斯堪的纳维亚卒中量表(scandinavian stroke scale,SSS)增加2分和/或NIHSS评分增加2分及以上,可认为梗死灶存在进展[8,9].
1.4 机器学习预测营养状态影响因素 由NRS 2002评分结果可将患者分为高、低危营养风险组.通过随机森林算法(random forest,RF)将患者按照7:3的比例随机分为训练集和验证集,在训练集患者中对纳入变量进行权重评估和重要性打分,并在验证集中报告RF的灵敏性和特异性并绘制混淆矩阵,之后对纳入变量的重要性进行排序.
1.5 列线图构建与效能检测 采用“rms”的R包绘制列线图模型,绘制受试者工作者特征曲线(receiver operating curve,ROC),采用ROC曲线下面积(area under the curve,AUC)、校准曲线和决策曲线分析(decision curve analysis,DCA)来评估列线图预测模型的准确性,用Bootstrap法进行内部验证.
统计学处理利用SPSS 25.0软件进行数据分析,计量资料采用Shapiro-Wilk检验进行正态性检验,计量资料以mean±SD表示,行t检验,计数资料用n(%)表示,行χ2检验.对高、低营养风险患者间的差异变量利用Logistic回归分析筛选.以P<0.05为差异有统计学意义.
2 结果
2.1 一般基线资料比较 纳入的108例行PEG脑卒中伴吞咽障碍患者中男58例、女50例,术前平均年龄为(64.55±5.85)岁,术前BMI为(22.36±1.37) kg/m2,术前血清总蛋白为(64.29±2.63) g/L、血清白蛋白为(34.42±1.58) g/L、血红蛋白为(129.57±16.28) g/L,术前NRS2002评分为(3.47±0.41)分.行PEG术后12 wk,低营养风险有70例(低营养风险组),高营养风险有38例(高营养风险组).术后12 wk,两组性别、脑卒中类型、病程、血清总蛋白、血红蛋白、伴有PEG营养并发症占比、病情进展情况等比较,差异无统计学意义(均P>0.05);两组在年龄、感染发生比例、血清白蛋白水平、BMI指数、接受进一步医治占比、家庭经济条件等比较,差异有统计学意义(均P<0.05).见表1.
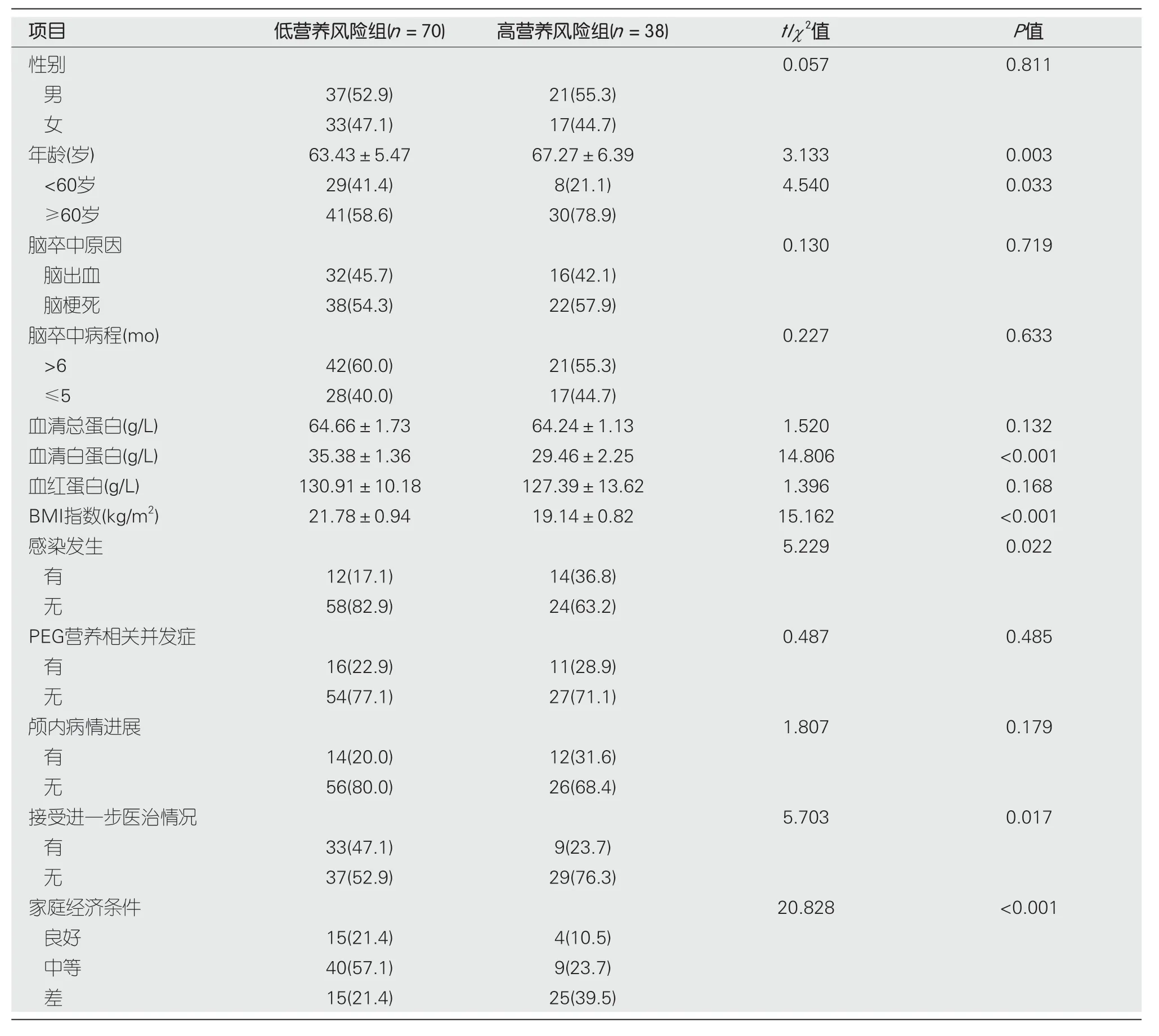
表1 两组一般基线资料比较
2.2 行PEG脑卒中伴吞咽障碍患者营养风险的多因素Logistic回归分析 以单因素分析中差异有统计学意义的年龄(赋值:<60岁=0,≥60岁=1)、血清白蛋白(赋值:实测值代入)、BMI指数(赋值:实测值代入)、感染情况(赋值:无=0,有=1)、接受进一步医治情况(赋值:无=0,有=1)和家庭经济条件(赋值:良好=0,中等=1,差=2)为自变量,以营养风险(赋值:低风险=0,高风险=1)为因变量进行多因素Logistic回归分析.结果显示,年龄(³60岁)、血清白蛋白、BMI指数、发生过感染、家庭经济条件(差)是行PEG脑卒中伴吞咽障碍患者营养风险的独立影响因素(均P<0.05),见表2.

表2 行PEG脑卒中伴吞咽障碍患者营养风险的多因素Logistic回归分析
2.3 营养风险因素的权重和排序分析 采用RF机器学习算法,对纳入的108例患者按照7:3的比例随机分为训练集(n=75)和验证集(n=33).纳入年龄(是否<60岁)、血清白蛋白、BMI指数、感染情况、接受进一步医治情况、家庭经济条件,按照各变量的权重排序,营养风险因素的风险性由高到底分别是:年龄、家庭经济条件、接受进一步医治情况、感染情况、血清白蛋白和BMI指数,见图1A.ROC曲线证实了RF模型的预测优越性(AUC=1000),并且展示出了RCO曲线拐点的预测能力,见图1B.由混淆矩阵可知,RF预测模型的灵敏性为100%、特异性为100%、阳性预测值为100%,准确度为100%,见图1C.

图1 随机森林的预测结果.A:随机森林对各纳入变量的权重排序;B:随机森林的ROC曲线;C:随机森林算法的混淆矩阵、灵敏性和特异性.ROC曲线:受试者工作特征曲线;AUC:ROC曲线下面积.
2.4 列线图模型构建与效能验证 根据RF机器学习算法和Logistic回归分析结果,针对年龄、家庭经济条件、进一步的医治情况、感染情况等较为重要的因素变量开发营养风险预测列线图.根据每个变量对应的第一排分值相加,即可得到总分.再对照最下面两排的总分和营养不良发生风险.当患者营养不良发生风险越高,则认为患者接受PEG术后出现营养不良风险事件的概率越高,越倾向与被分入高营养风险组;当营养不良发生风险越低,则相反,见图2A.利用Bootstrap法重复抽样2000次,对列线图进行内部验证,模型的C-index为0.823.由ROC曲线知列线图的AUC=0.819,模型拐点的灵敏性和特异性分别为64.8%和94.8%见图2B.拟合曲线显示列线图对本研究的拟合程度良好,说明模型预测与实际观察结果有良好的一致性,平均误差可以接受见图2C.该模型稳定,校准能力较高,预测效力可靠且有效.决策曲线分析显示列线图模型有着良好的净获益率见图2D和E.

图2 列线图预测模型结果.A:构建的列线图模型;B:列线图模型的ROC曲线,AUC=0.819,曲线拐点的特异性为0.648,灵敏性为0.948;C:列线图的校准曲线;D:列线图的决策曲线;E:列线图模型中高风险人群的成本—获益情况.ROC:受试者工作特征曲线;AUC:ROC曲线下面积.
3 讨论
脑卒中患者行PEG进行肠内营养比其他管饲营养方式能够获取更多营养,也减少了患者外出时的不适与尴尬[10].既往研究表明[11],相对于鼻胃管,PEG有更低的食管反流率,且操作失败率、不良反应发生率与患者死亡率等均较低[12].PEG也在一定程度上保护了患者吞咽功能和构音功能,利于患者病情恢复和生活质量的提升[13,14].此外,PEG途径进行肠内营养的患者照顾者负担水平也显著低于其他管饲方式的患者[15].PEG在改善脑卒中伴吞咽障碍患者营养状况和减少照顾者负担者虽有一定优势,但能否使患者营养状况获益最大在学术界仍有争议[16],因此探索脑卒中伴吞咽障碍患者行PEG术后营养风险的影响因素,对于改善预后和促进脑卒中患者康复意义重大.
本研究结果表明,年龄、家庭经济条件、感染情况是脑卒中合并吞咽障碍患者行PEG术后12 wk发生高营养风险的独立影响因子.分析原因:(1)年龄:年龄增加是脑卒中患者营养不良的独立危险因素,与唐容等[17]研究结果相似.年龄越大则增龄性合并发症也较多,一旦发病,老年人由于各项机能的衰退易受到如自理能力的下降、高血压、糖尿病胰岛素抵抗、代谢紊乱、心情压抑等综合因素会对自身营养形成的竞争风险而增大营养不良风险[18];(2)家庭经济条件:脑卒中病程长,医疗费用支出大及因疾病而产生的交通费、误工费、营养费等对多数家庭经济承受能力影响很大[19],而经济条件是健康的基本物质保障,只有在满足日常需求后,才会有足够的经济实力来满足患者的综合康复要求.家庭经济条件良好的患者,家庭能够承担长期的营养支持及护理费用,营养干预的积极性及及时性也相对较高,因而其营养改善的概率也会增大;(3)感染情况PEG虽在一定程度上降低吞咽障碍造成的经口饮食误吸的风险,但是仍无法避免流质口咽分泌物及胃内容反流物造成的误吸,造成吸入性肺炎发生,降低患者抵抗力,进而加重身体消耗,不利于身体营养吸收而诱发营养不良.此外,营养不良会进一步削弱患者的机体免疫功能,加大患者感染的风险和死亡率[20],从而形成了恶性循环.因此,感染不仅是营养不良患者的危险因素,也干扰了脑卒中患者的营养状态的维持和纠正.提示,医护人员及患者家属应密切关注年龄大、感染发生的患者营养状况,及时做好营养风险评估及干预,对家庭经济条件差的患者可协助其发起社会募捐、增加社区医疗服务次数等方式给予患者关怀和社会支持以增强其预后质量.
本研究还发现,接受了进一步的医治、血清白蛋白水平越高、BMI指数越大则脑卒中合并吞咽障碍行PEG术后患者的营养不良风险也较小.分析原因:(1)接受了进一步的医治 脑卒中伴吞咽障碍患者病情复杂多变,且进展迅速,患者自身反馈也普遍滞后,故出现部分症状后如腹泻、感染等,及时接受医护人员的医治则有助于降低病情对患者营养状况造成的下降风险[21];(2)血清白蛋白水平 血清白蛋白水平的高低可以反映躯体的免疫及营养状况,是判断营养不良的重要客观指标[22].过低的白蛋白水平会引发水肿,造成电解质紊乱,降低患者的抵抗力和活动能力,对促进患者病情恢复极为不利,及时补充高蛋白类制剂或流质食物则有助于改善患者的白蛋白水平.有研究表明[23],通过实施有效的营养干预,在有助于提高患者营养水平的同时,也能够有效改善因炎症导致的T淋巴细胞功能抑制情况,进而从根本上促进患者免疫功能的恢复;(3)BMI指数 BMI指数是反映人体营养状态的直观表现.由于脑卒中患者发病恢复期活动量普遍减少,机体需求热量也降低[24],胃肠蠕动能力及其功能不可避免的下降,造成患者摄入热量减少,机体逐渐出现消瘦,出现营养风险,表现为BMI指数的降低.有研究表明[25],增加有效的营养管理策略则有助于提升脑卒中患者的BMI指数和预后质量.提示医护人员应对脑卒中患者的血清白蛋白水平、BMI指数进行观测,排除不良因素影响,及时给予干预,进而降低患者营养风险.
本研究首次通过机器学习筛选影响PEG术后营养状态的因素并构建列线图模型,定量化、可视化地分析营养风险因子的影响权重.机器学习算法极大地提升了预测模型的准确性,并为影响患者营养状态的因素做了排序,为临床管理的优先性提供了依据,可有效节约医疗成本.但本研究也有一定的局限性:(1)本研究属于单中心的回顾性研究,纳入的单中心数据虽在一定程度上避免了来自不同医师操作和评估的偏倚,但是限制了证据的外推应用性;(2)本研究纳入的样本量稍少,且其他生化检验指标(如血糖、HbA1C、多种激素水平等)和影像学指标未能纳入分析,一定程度削弱了结果的稳定性和临床应用前景.
4 结论
综上所述,当脑卒中伴吞咽障碍患者年龄≥60岁、家庭经济条件较差、存在感染则在PEG术后发生高营养不良风险的概率较高;当接受了进一步的医治、血清白蛋白越高、BMI指数越大则患者发生高营养风险的概率较低.受限于单中心、回顾性研究的限制,上述结论仍需大宗数据进行验证.
文章亮点
实验背景
对于需长期营养支持的脑卒中伴吞咽障碍的患者来说,行内镜下经皮胃造瘘管术(percutaneous endoscopic gastrostomy,PEG)进行肠内营养支持在降低患者出门不适感,管饲操作失败率和减轻照顾者负担等方面有一定优势,但能否使患者的营养改善获益最大仍有争议,积极探索脑卒中伴吞咽障碍患者行PEG术后营养风险因子,对于改善患者预后和促进康复意义重大.
实验动机
由于疾病的特殊性,在脑卒中伴长期吞咽障碍的患者中,影响PEG术后患者营养风险的因素仍不明确,这无疑增加了此类患者的不良预后风险.通过调查脑卒中伴吞咽障碍患者行PEG术后的营养状况,以明确PEG术后的营养风险因素,为进一步提高脑卒中伴吞咽障碍患者营养干预质量提供参考.
实验目标
初次尝试利用Logistic回归分析和RF机器学习法分析脑卒中伴吞咽障碍患者行PEG术后的营养风险因子及其权重排序,旨在为脑卒中伴吞咽障碍患者营养干预获益最大提供科学依据.
实验方法
利用营养风险筛查2002量表调查纳入的108例脑卒中伴吞咽障碍患者行PEG术后12 wk的营养风险,利用一般资料问卷调查表、Logistic回归分析、门诊回访检查、病案回查等方法分析影响患者的营养风险因素,并尝试利用机器学习算法分析营养风险因素的权重及排序.
实验结果
本研究结果表明,年龄≥60岁、家庭经济条件差、存在感染与脑卒中伴吞咽障碍患者行PEG术后12 wk的高营养风险呈显著正相关(均β>0,P<0.05);接受了进一步医治、高血清白蛋白水平、体质量指数(body mass index,BMI)与高营养风险呈显著负相关(均β<0,P>0.05),各因素的风险性由高到底分别是:年龄、家庭经济条件、接受进一步医治情况、感染情况、血清白蛋白和BMI指数.
实验结论
年龄、家庭经济条件、接受进一步医治情况、感染情况、血清白蛋白水平、BMI指数等能有效预测脑卒中伴吞咽障碍患者行PEG术后的营养风险,应注重对此类患者的营养风险评估和加强营养支持.
展望前景
本研究首次通过机器学习探讨影响PEG术后营养状态的因素并构建列线图模型,定量化、可视化地分析营养风险因子的影响权重,为患者营养支持管理的优先性提供了一定借鉴.由于本研究为单中心的回顾性研究,且纳入的样本量稍少,对于客观、全面地反映患者的营养风险状况难免有一定的偏倚,期望后续能开展多中心、大样本量的此类研究,以确保结果的稳定性和扩大应用前景.
