Ⅲ期非小细胞肺癌两种同步化疗方案临床研究*
2023-11-18李为之肖春晖陈正聪张群贵丁金泉曾莺婷陈小妹
李为之 肖春晖 陈正聪 张群贵 丁金泉 曾莺婷 陈小妹
非小细胞肺癌(NSCLC)为肺癌常见类型,主要起源于支气管黏膜、肺泡上皮等组织,随瘤体不断增大,患者可逐渐出现咳嗽、咯血、呼吸困难等症状,增加临床治疗难度[1-2]。Ⅲ期NSCLC 属于中晚期癌症,临床对于该类患者多予以同步放化疗治疗,以增强肿瘤抑制效果,延长生存时间[3-4]。但NSCLC 的化疗方案较多,不同化疗方案间的疗效及安全性也存在较大差异。EP 为NSCLC 首选化疗方案,是由依托泊苷与顺铂组成,其可行性已被临床证实,能够较好抑制肿瘤进展,提高患者生存率,但该方案的骨髓抑制风险较高[5]。注射用紫杉醇(白蛋白结合型)联合奈达铂的TP 方案为当前NSCLC 治疗的新一代方案,其在乳腺癌、子宫颈癌等治疗中均取得了良好成效,但在NSCLC 中的疗效及安全性相关研究较少[6]。鉴于此,本研究旨在分析Ⅲ期NSCLC 两种同步化疗方案的治疗效果,现报道如下。
1 资料与方法
1.1 一般资料
选取2019 年8 月—2020 年8 月赣州市肿瘤医院收治的88 例Ⅲ期NSCLC 患者,纳入标准:经病理检查明确NSCLC 诊断;临床分期为Ⅲ期;均为初治患者;难以行手术治疗;开展同步放化疗;卡氏评分>70 分。排除标准:肝肾衰竭;精神严重衰竭;合并其他恶性肿瘤;对本研究化疗药物过敏;临床资料不完整;中途随访失联。按随机数字表法分为两组,各44 例。研究经本院医学伦理委员会批准。患者及家属知情同意。
1.2 方法
两组均开展调强放疗。采用真空垫固定体位,行CT 模拟定位,根据CT 图像在Eclipse 系统内勾画,(1)肿瘤靶区(GTV):肺窗(窗宽1 600 HU,窗位-600 HU)中所见的肺内肿瘤范围及纵隔窗(窗宽400 HU,窗位20 HU)中所见的纵隔所见转移淋巴结区域,病变的毛刺根部应包括在GTV 中,应基于CT 所见勾画GTV 范围,PET 仅可用于分期及参考。(2)临床靶区(CTV):鳞癌GTV 基础上外放6 mm,腺癌外放8 mm,根据解剖屏障及淋巴引流区做适当调整。计划靶区(PTV)在CTV 的基础上加上肿瘤的运动范围;剂量:PGTV 60~66 Gy,PCTV 50 Gy;每周5 次,共6 周。对照组同步EP方案化疗:静脉滴注依托泊苷注射液(生产厂家:神威药业集团有限公司,批准文号:国药准字H13023724,规格:5 mL∶0.1 g)50 mg/m2,第1~3 天、第29~31 天用药;静脉滴注顺铂注射液(生产厂家:齐鲁制药有限公司,批准文号:国药准字H37021358, 规格:10 mg)50 mg/m2, 第1~3 天、第29~31 天用药。观察组同步TP 方案化疗:静脉滴注注射用紫杉醇(白蛋白结合型)(生产厂家:江苏恒瑞医药股份有限公司,批准文号:国药准字H20183378,规格:100 mg)20 mg/m2+注射用奈达铂(生产厂家:江苏奥赛康药业有限公司,批准文号:国药准字H20064294,规格:10 mg)20 mg/m2,每周1 次。两组均于放疗结束8 周后复查,并随访2 年。
1.3 观察指标及评价标准
(1)临床疗效:放疗结束8 周后评估。完全缓解,病灶消失,持续≥4 周,且未出现新病灶;部分缓解,病灶最长径总和减少≥30%,持续≥4 周;进展,目标病灶最长径总和增大≥20%,或出现新的病灶;稳定,处于部分缓解及进展之间。总有效率=(完全缓解+部分缓解)例数/总例数×100%;疾病控制率=(完全缓解+部分缓解+稳定)例数/总例数×100%。(2)肿瘤标志物水平:治疗前及治疗3 个月后,两组均采集3 mL 空腹血,离心处理后,以全自动分析仪测定糖类抗原125(CA125)、癌胚抗原(CEA)、细胞角蛋白19 片段(CYFRA21-1)水平变化。(3)生存质量:治疗前及治疗3 个月后,两组均以世卫组织生活简易量表评价生存质量,包括生理、心理、环境及社会领域,各100 分,得分越高越好。(4)无进展生存率及总生存率:随访2 年,统计1、2 年无进展生存率及总生存率。(5)不良反应:骨髓抑制、恶心呕吐、放射性食管炎、肝功能损伤等。
1.4 统计学处理
2 结果
2.1 两组一般资料比较
对照组男26 例,女18 例;年龄49~70 岁,平均(60.38±4.29)岁;病理类型:腺癌14 例,鳞癌20 例,腺鳞癌10 例;临床分期:ⅢA 期13 例,ⅢB 期19 例,ⅢC 期12 例。观察组男24 例,女20 例;年龄47~70 岁,平均(60.42±4.34)岁;病理类型:腺癌15 例,鳞癌21 例,腺鳞癌8 例;临床分期:ⅢA 期12 例,ⅢB 期19 例,ⅢC 期13 例。两组一般资料比较,差异均无统计学意义(P>0.05),具有可比性。
2.2 两组临床疗效比较
观察组疾病控制率、总有效率均较对照组高,差异均有统计学意义(χ2=4.062、3.927,P=0.044、0.048),见表1。

表1 两组临床疗效比较[例(%)]
2.3 两组肿瘤标志物水平比较
治疗前两组CA125、CEA、CYFRA21-1 差异均无统计学意义(P>0.05),观察组治疗后CA125、CEA、CYFRA21-1 水平均较对照组低,差异均有统计学意义(P<0.05),见表2。
表2 两组血清肿瘤标志物比较(±s)
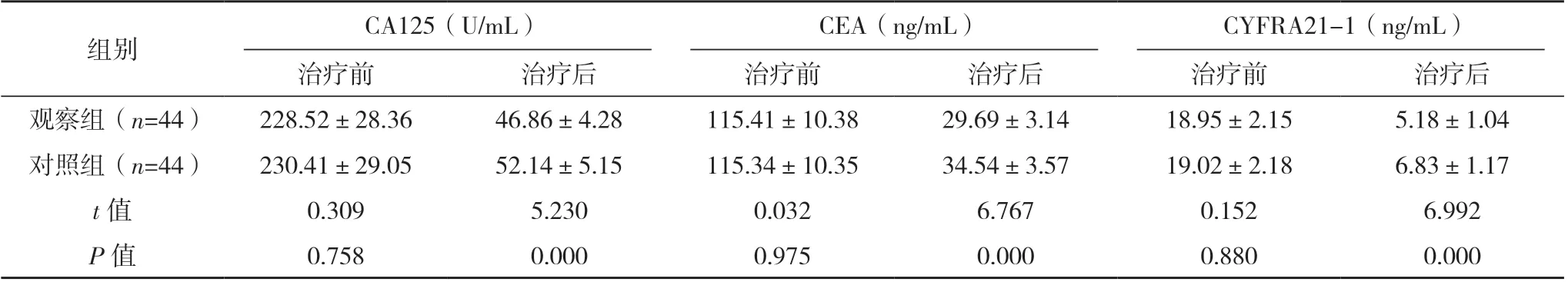
表2 两组血清肿瘤标志物比较(±s)
组别CA125(U/mL)CEA(ng/mL)CYFRA21-1(ng/mL)治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=44)228.52±28.3646.86±4.28115.41±10.3829.69±3.1418.95±2.155.18±1.04对照组(n=44)230.41±29.0552.14±5.15115.34±10.3534.54±3.5719.02±2.186.83±1.17 t 值0.3095.2300.0326.7670.1526.992 P 值0.7580.0000.9750.0000.8800.000
2.4 两组生存质量比较
治疗前两组生存质量各领域评分差异均无统计学意义(P>0.05),观察组治疗后生存质量各领域评分均较对照组高,差异均有统计学意义(P<0.05),见表3。
表3 两组生存质量比较[分,(±s)]

表3 两组生存质量比较[分,(±s)]
组别生理心理环境社会治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后观察组(n=44) 58.69±5.2284.35±7.1255.76±5.1282.04±6.8965.78±6.0488.96±5.0562.34±5.8986.32±5.18对照组(n=44) 59.02±5.2576.65±7.0256.02±5.1674.34±6.5266.02±6.1280.45±6.1962.48±5.9378.63±5.95 t 值0.2965.1080.2375.3840.1857.0660.1116.466 P 值0.7680.0000.8130.0000.8540.0000.9120.000
2.5 两组无进展生存率及总生存率比较
观察组随访1 年无进展生存率、总生存率均较对照组高,随访2 年总生存率较对照组高,差异均有统计学意义(P<0.05),两组随访2 年无进展生存率比较,差异无统计学意义(P>0.05),见表4。
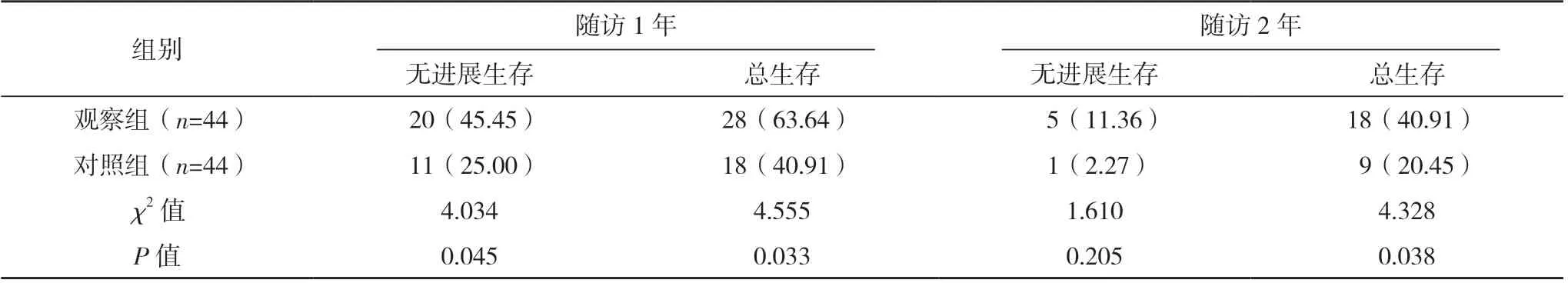
表4 两组无进展生存率及总生存率比较[例(%)]
2.6 两组不良反应比较
观察组骨髓抑制发生率较对照组低,差异有统计学意义(P<0.05),见表5。
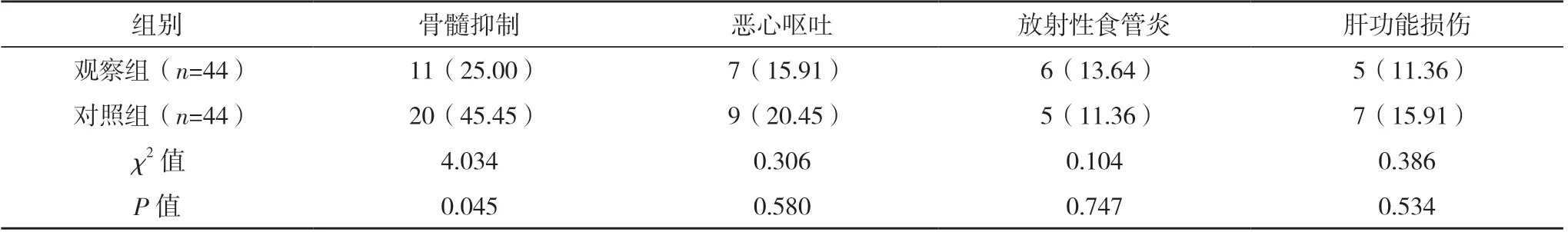
表5 两组不良反应比较[例(%)]
3 讨论
3.1 NSCLC 发病机制及治疗现状
NSCLC 病因复杂,临床认为环境因素为该病的始动因素,加之年龄、免疫、遗传、营养状况等多种因素影响下,可促使体内致癌物难以被代谢酶溶解,持续刺激下则易引起基因突变[7-9]。而该状态下的基因突变无法被体内DNA 修复系统修复,久之则会引起抑癌与癌基因失衡,导致细胞增殖失控,最终形成肺癌组织[10-12]。而肺癌发病后的症状不典型,待症状明显后多数患者已错失手术治疗机会,仅可通过放化疗等综合治疗来抑制肿瘤进展,延长患者生存时间[13-14]。
3.2 NSCLC 常规放化疗方案
调强放疗为NSCLC 常用放疗方式,借助放射线照射肿瘤组织,能够直接损伤肿瘤细胞DNA,阻断肿瘤细胞增殖,使肿瘤细胞凋亡,从而缩小肿瘤病灶,达到控制肿瘤生长及扩散目的[15-17]。同时,在此基础上联合化疗药物治疗,能最大限度地提高肿瘤抑制效果,以避免其扩散或转移,改善患者预后。EP 化疗方案中依托泊苷属于细胞周期特异性抗肿瘤药物,可直接作用于DNA 拓扑异构酶Ⅱ,形成稳定可逆性复合物,阻碍肿瘤细胞DNA 修复,从而抑制肿瘤增殖及生长[18-19]。顺铂为第一代铂类药物,是以肿瘤细胞DNA 为靶点,可促使DNA双链间及链内交联,阻碍DNA 分子持续复制,达到良好抗肿瘤作用,且该药具有放疗增敏效果[20]。但EP 方案细胞毒性较大,易增加骨髓抑制风险,且其获得的远期生存率已无法满足临床当前更高的需求。
3.3 TP 化疗方案
本研究结果显示,相比对照组,观察组疾病控制率、总有效率均高,治疗后CA125、CEA、CYFRA21-1 水平均低,治疗后生理、心理、环境及社会领域评分均高,随访1 年无进展生存率、总生存率均高,随访2 年总生存率高,骨髓抑制发生率低;提示注射用紫杉醇(白蛋白结合型)联合奈达铂组成的TP 方案疗效更佳,可增强疾病控制效果,降低肿瘤标志物水平,减少骨髓抑制发生,提高远期生存率。分析原因为,注射用紫杉醇(白蛋白结合型)联合奈达铂的TP 方案在NSCLC 中应用尚不多见,注射用紫杉醇(白蛋白结合型)是将紫杉醇与白蛋白经高压震动技术制成的纳米颗粒,给药后可经肿瘤摄取营养的机制吸附于细胞表面,具有靶向聚集效应,可形成局部高浓度药物环境,加快肿瘤灭杀[21]。相较于常规紫杉醇,其可更好地深入肿瘤细胞,增强肿瘤抑制效果,且无需行过敏预处理,不良反应低。奈达铂则为第3 代铂类抗肿瘤药物,与顺铂的结构及作用机制基本一致,但其水溶性更强,无需水化处理,且该药代谢物可更快排出体外,细胞毒性较顺铂更低,故与注射用紫杉醇(白蛋白结合型)联用后可进一步提高抗肿瘤效果,且安全性更高。
综上所述,TP 方案同步化疗可提高Ⅲ期NSCLC 控制效果及远期生存率,降低肿瘤标志物水平,减少骨髓抑制发生,有助于改善患者生存质量。
