支气管动脉化疗栓塞介入治疗非小细胞肺癌患者的临床效果研究
2023-11-17王兆映杨培培袁牧谢波谭玉林
王兆映 杨培培 袁牧 谢波 谭玉林
根据2020 全球癌症统计数据显示,每年全球180 万人死于肺癌,是高致死率癌症之一,也是我国癌症相关死亡的首要原因[1]。非小细胞肺癌(NSCLC)约占所有新诊断肺癌病例的85%,是肺癌中最常见的组织学类型[2]。肺癌早期起病具有隐匿性,多数患者对症状感知不明显,即使存在发热、咳嗽、气促等症状,通常也会将该病症和常见的支气管炎归为一类,未引起重视。后期就诊时病症恶化,多数患者肿瘤已经侵犯大血管,并伴有明显的肺门和纵隔淋巴结转移、心肺功能差等,从而失去根治性手术治疗的机会[3]。对于不能接受根治性手术的患者,化疗或放化疗联合通常作为首选治疗方法,能够在一定程度上改善患者症状,延长生存期。但由于晚期患者肿瘤负荷较重,且放化疗的相关并发症较多,放射性肺炎、继发性支气管狭窄、胃肠道反应、骨髓抑制等不良反应严重降低了患者生活质量,影响患者预后,且总体疗效并不理想[4]。支气管动脉化疗栓塞术(BACE)作为肺癌治疗的微创介入方法,通过导管将化疗药物直接注入肿瘤,可以延长化疗药物特异性作用于肿瘤部位的时间,降低全身毒副反应[5]。BACE 还会导致肿瘤供血动脉血流受阻,使肿瘤缺血坏死,从而显著提高临床疗效[6]。然而,目前关于BACE 和常规化疗对NSCLC 患者治疗效果的对比研究较少。因此,本研究回顾性分析在我院介入科接受BACE 治疗的原发性NSCLC患者的临床资料,以探究BACE 治疗NSCLC 的临床效果和安全性。
1 材料与方法
1.1 一般资料选取2021 年5 月~2022 年5 月我院收治的、组织学证实为NSCLC 的患者92 例作为研究对象,TNM 分期ⅢA~Ⅳ期,患者年龄45.9~77.4 岁,平均(61.89±2.83)岁。根据治疗方法不同分为观察组和对照组,各46 例。纳入标准:①经组织病理学证实的NSCLC 患者;②TNM 分期ⅢA~Ⅳ期,不能耐受或拒绝手术者;③预期生存期>3 个月的患者;④无化疗禁忌证者;⑤无其他原发性恶性肿瘤及并发症者;⑥美国东部肿瘤协作组体能状态(ECOG PS)评分≤2 分的患者。排除标准:①1 个月内使用其他化疗或放疗方案;②广泛且无法控制的肺外转移病灶;③恶病质或心、肺、肝、肾衰竭;④严重感染或严重血小板减少等化疗禁忌证;⑤有严重出血倾向、碘过敏等血管造影禁忌证;⑥术中血管造影检测到支气管动脉和脊髓动脉共干或两者之间有吻合无法避开者。本研究患者或家属接受治疗前均签署治疗知情通知书,且经过我院伦理委员会批准。对两组性别、年龄、TNM 分期、ECOG 评分和病理类型基线资料进行对比,差异无统计学意义(P>0.05),见表1。

表1 两组患者一般资料对比[n(%)]
1.2 治疗方法对照组接受常规静脉化疗,根据不同病理类型选取合适方案。腺癌(ADC)患者给予培美曲塞(500mg/m2)+顺铂(75mg/m2)方案;鳞状细胞癌(SCC)患者采用吉西他滨(1 000mg/m2)+顺铂(75mg/m2)方案。观察组接受BACE 治疗,患者接受术前指导后,局麻下采用Seldinger 技术穿刺右侧股动脉。通过动脉血管鞘引入导管至主动脉弓,找到支气管动脉开口后行血管造影以确定肿瘤的血液供应,未见肿瘤染色者可进一步行肋间动脉及胸廓内动脉造影明确有无异位血供,确定肿瘤的供血动脉后,引入微导管超选插管技术对肿瘤供血动脉进行超选,导管位置固定后灌注稀释后的化疗药物,化疗方案与对照组相同。灌注结束后,根据肿瘤大小和血供丰富程度选择适当大小的栓塞微球颗粒(直径100~500μm),与适量的造影剂混合栓塞供血动脉,直至肿瘤供血动脉闭塞并出现造影剂潴留时停止栓塞。每3 周为1 个治疗周期,每个治疗周期结束后进行计算机对比增强断层扫描(CT)以观察肿瘤病灶大小及活性。如果供应血管和肿瘤强化消失,则不需要其他医疗干预。如果肿瘤仍有强化,则重复上述介入治疗,并在4 个周期的治疗后评估疗效。在接下来的6 个月中,患者每个月随访1 次,随访内容包括影像学检查(增强CT)以及实验室血清学指标检查。6 个月后,患者每隔3 个月随访1 次。
1.3 观察指标①临床疗效:根据实体瘤反应评价标准(RECIST)1.1 版评估治疗效果,分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD),计算两组患者的客观有效率(ORR)和疾病控制率(DCR)。②炎症因子:留取患者治疗前及治疗后1 周内空腹静脉血,采用酶联免疫吸附法(ELISA)检测两组患者的血清粒细胞-巨噬细胞集落刺激因子(GM-CSF)、肿瘤坏死因子-α(TNF-α)、白细胞介素-2(IL-2)、白细胞介素-8(IL-8)指标水平变化。③生活质量评价:采用SF-36 量表计算两组患者治疗前后的生理机能、情感功能、社会功能以及一般健康状况得分。④不良反应发生率:统计两组患者治疗后发烧、胸痛、骨髓抑制以及恶心呕吐的不良反应发生率。
1.4 统计学方法使用SPSS 23.0 统计学软件进行数据分析,计量资料采用表示,组间比较行t检验,计数资料以n(%)表示,组间比较采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组临床疗效比较对照组中,CR 3 例,PR 23例,SD 12 例,PD 8 例;观察组中,CR 6 例,PR 29例,SD 9 例,PD 2 例。两组ORR 和DCR 比较差异有统计学意义(P<0.05)。见表2。
2.2 两组炎症因子水平比较两组患者治疗前炎症因子水平比较差异无统计学意义(P>0.05)。治疗后两组炎症因子水平均下降,且观察组患者GM-CSF、TNF-α、IL-2、IL-8 水平均低于对照组,差异具有统计学意义(P<0.05)。见表3。
2.3 两组生活质量比较在完成治疗周期后随访患者生活质量变化,观察组SF-36 评分的生理机能、情感功能、社会功能以及一般健康状况得分均显著高于对照组,差异有统计学意义(P<0.05)。见表4。

表2 两组患者临床疗效对比[n(%)]
表3 两组患者炎症因子水平对比()
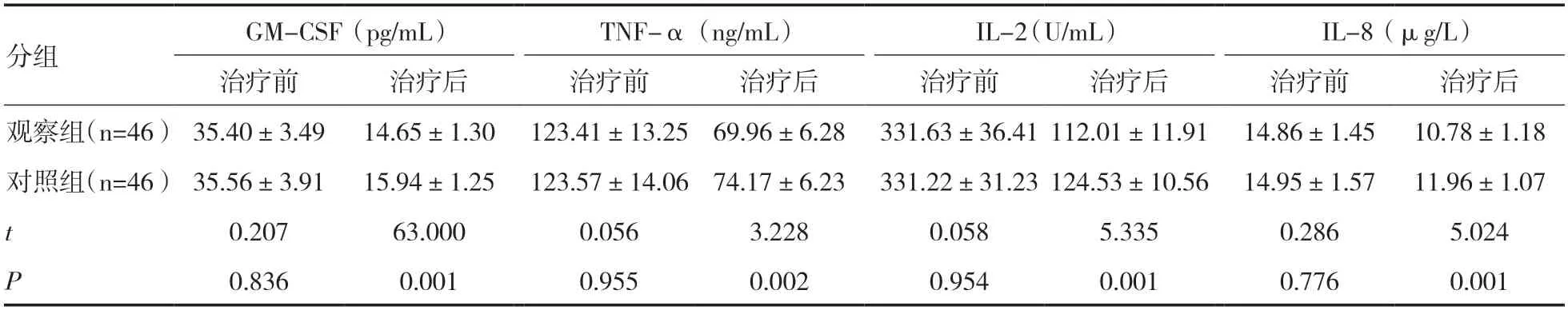
表3 两组患者炎症因子水平对比()
表4 两组患者SF-36 指标对比(分,)

表4 两组患者SF-36 指标对比(分,)
2.4 两组不良反应发生率比较两组化疗引起的恶心呕吐、厌食、发热等不良症状,口服药物均得到缓解。两组均未发生脊髓损伤等严重不良反应。观察组不良反应发生率为13.04%(6/46),低于对照组的30.43%(14/46),差异有统计学意义(P<0.05)。见表5。

表5 两组患者不良反应发生率对比[n(%)]
3 讨论
肺癌根据组织病理学的不同可以分为NSCLC和小细胞肺癌,其中NSCLC 发病率占80%以上[1],作为严重的肿瘤疾病,肺癌早期起病隐匿,不易筛查诊断。待出现明显的临床症状就诊时多数患者已失去根治性手术治疗机会。近年来,除了传统的放化疗,靶向及免疫的系统治疗作为晚期患者的非手术疗法也逐渐在临床得到应用,然而,全身放化疗治疗毒副作用较多,多数患者无法耐受,靶向及免疫治疗费用昂贵,临床推广也受到限制。BACE作为近年来新兴的局部介入治疗方法,以其微创、有效、易耐受、并发症少等优点,逐渐在肺癌的治疗中引起重视。由于肺癌是起源于支气管黏膜、腺体、气管等部位的恶性肿瘤,一般会浸润到支气管腔内或周围,而支气管黏膜的血液供应主要依靠支气管动脉。这种解剖关系的存在,为肺癌的BACE 治疗奠定了基础[7],BACE 通过将化疗药物经导管沿肿瘤供血动脉直接注入病灶内部,与浅表静脉化疗相比,一方面降低了化疗药物与外周血浆蛋白的结合率,保证了肿瘤区游离药物浓度,从而提高治疗效果[8];另一方面,肿瘤供血动脉的栓塞也会使瘤区化疗药物的作用时间延长。肿瘤的血液供应阻断后,还可以使肿瘤病灶在化疗药物的细胞毒性作用之外发生缺血性坏死。尤其对于伴有咯血的肺癌患者,既能控制原发病灶的进展,又能达到止血目的[9]。有研究显示,BACE 的局部治疗效果可以达到全身静脉化疗的2~6 倍[10]。本研究中,观察组的短期DCR高达95.65%,ORR 达76.09%,均显著高于对照组的82.61%和56.52%,这与Cao 等[11]的研究结果一致,证实了BACE 治疗肺癌的短期疗效显著。此外,有前瞻性研究表明,对于支气管动脉供血的肺转移瘤,BACE 同样有着较高的DCR,全身毒性反应更小,这可能与肺癌化疗栓塞后肿瘤内药物更长时间释放导致肿瘤大面积坏死,且局部高药物浓度可以克服化疗的耐药性有关[12]。
慢性炎症和机体免疫反应有助于肺癌的发生和发展[13]。炎症反应和免疫系统中的关键信号分子,是由外周免疫细胞或肿瘤细胞产生的细胞因子,其参与机体正常的免疫稳态,是伴随肿瘤生长、侵袭和转移的炎症过程的一部分[14]。人体内重要的细胞因子包括IL-2、IL-8、TNF-α 和GM-CSF等。其中GM-CSF 可以根据浓度及周围环境发挥促炎和抗炎作用,当由肿瘤细胞自身分泌时,GMCSF 可以通过促进骨髓抑制细胞的发育导致肿瘤的免疫逃逸[15]。TNF-α 介导机体自身免疫反应,其持续释放可能加重机体病理损伤,促进肿瘤增殖。肿瘤患者体内高水平的 TNF-α 与较高的术后复发和转移风险相关[16]。IL-2 能够激活人体自然杀伤细胞,参与机体免疫记忆和自身免疫性疾病的发生[17]。IL-8 是多种免疫细胞的化学引诱剂,也是血管生成的诱导剂[18]。有研究显示,上述细胞因子水平的高低与肺癌患者的诊断及预后相关,高水平的细胞因子往往代表着更严重的病情,与肺癌患者的不良预后呈正相关[16]。本研究结果显示,BACE 术后患者的细胞因子水平较治疗前显著下降,患者肿瘤进展得到良好控制,说明BACE 或许可以减少NSCLC 患者细胞因子的分泌,调节患者的肿瘤微环境,改善病情及预后。
对于NSCLC 患者,生活质量与生存时间同样重要,是临床治疗中不可忽视的重要因素[19]。患者在确诊肺癌晚期后,除面对死亡的恐惧而产生较大的精神心理负担外,一些肿瘤本身引起的症状以及治疗的副作用,如疼痛、恶心呕吐等同样影响患者的生活质量。在本研究中我们观察到,与接受静脉化疗的患者相比,接受BACE 治疗的患者在生理机能、情感功能、社会功能以及一般健康状况上得分均较高,总体生活质量有所提高,而在不良反应发生率上,观察组患者的恶心呕吐、骨髓抑制、发烧等不良反应发生率低于静脉化疗组,表明与化疗相比,BACE 在改善NSCLC 患者症状方面优于静脉化疗,且具有良好的安全性。但值得注意的是,BACE是微创侵入性手术,在术中要注意造影过程中有无脊髓动脉等异位交通血管存在,防止异位栓塞导致截瘫等严重并发症的发生[20],术者精确的操作技术是患者安全及疗效的保障。
综上所述,BACE 相对于静脉化疗在治疗NSCLC 患者中表现出更可靠的治疗效果,能够改善患者的生活质量,而且不良反应少、安全性高,值得在临床中推广应用。但本研究尚存在一定局限性,由于样本量少且是单中心研究,后续仍待更大样本、更多中心的进一步验证以为临床治疗提供更好的决策依据。
