转录组学分析互花米草Spartina alterniflora的高盐度抗性分子机制
2023-11-15王鹏娜何英英李文君曲长凤缪锦来
王鹏娜,何英英,李文君,赵 阳,曲长凤,缪锦来*
(1. 自然资源部 第一海洋研究所,山东 青岛 266061;2. 青岛市农业科学研究院,山东 青岛 266199)
互花米草(Spartina alternifolia)属禾本科,鼠尾粟属,二倍体、四倍体或十二倍体的多年生草本植物,原产于北美洲与南美洲的大西洋沿岸(Rolando et al, 2022)。发达的根系使得互花米草具有很强的生长繁殖能力与环境适应能力,可在各种基质上定居,使其在与其他植物在竞争资源时占据绝对优势。互花米草具有较强的连续扩散的能力,Liu等利用Landsat-8 OLI图像等技术推算出互花米草在1979年至2018年的平均扩张速率约137 km2/10 a(Liu et al, 2018) 。1979年互花米草被引进我国(王寿兵等, 2023),用于保滩护岸、促淤造陆( 钦佩等, 2012; 杨东等, 2014),因效果良好,后续在山东、广东、江苏等地的沿海滩涂上进行广泛种植,并在我国海岸带迅速扩散(王智晨等, 2006; 沈鸿坤等, 2022),目前在我国的分布面积达545.80 km2,纬度范围为39°13′~20°55′N。
互花米草的入侵与扩散诱导湿地生态退化,影响湿地生态系统的结构和功能(张雪, 2022; 宗影等, 2023)。互花米草能够竞争取代土著植物(如盐地碱蓬、芦苇和红树林等),入侵污染土著植物的基因(饶清华, 2020);且易造成原生态环境生物生存空间变窄、群落结构改变,如鸟类、鱼类及底栖无脊椎动物因食物来源和避难所发生改变而迁移;与滩涂养殖藻类争夺营养导致藻类减产,养殖水产品被冲进米草群落而无法逃生导致大量水产品减产,威胁海岸带水产养殖产业;改变潮间带地形并影响海水正常流动,引起航道堵塞(王君, 2010)。总之,互花米草的扩散造成一系列巨大的生态和经济危害,因此2003年其被列入外来入侵物种(Jiang et al, 2022; Lin et al, 2022; Shen et al, 2022)。
互花米草入侵及扩散能力与其繁殖方式和高抗盐性等密切相关。其有性繁殖体为种子,无性繁殖体为根状茎、分蘖形成的分株与折落的植株(Daehler et al, 1994)。研究表明,互花米草为适应新的环境会选择不同的繁殖方式(Winkler et al, 1999),传播通常是人工种植后的无性繁殖,在潮间带地区大多呈簇状分布(Liu et al, 2018)。互花米草作为一种强泌盐植物,盐胁迫下能通过盐腺结构将组织中的盐分排到茎叶等器官表面,因此互花米草对高盐度有较强的耐受能力(适盐范围为0~3),同其他植物相比互花米草在盐度较高的生境中竞争优势明显(何军等, 2009; 陈绿青, 2013; 赵阳,2022),这种特性也为其适应潮间带环境提供了可能(Feng et al, 2017)。
目前,对互花米草的研究主要集中在生理特性和经济价值上,如互花米草对土壤的物理和化学性质及生物群落的影响(布乃顺等, 2017)、对金属物质的吸收(李佳枚等, 2011)、藻华抑制作用(Xu et al, 2019)等。但并未有研究阐明互花米草生物入侵分子机制与其高盐度抗性之间的关系。研究发现,植物在盐胁迫下,可以通过调节自身的基因表达、信号传导、能量代谢及蛋白质合成等途径,来缓解高盐环境带来的不利影响(乔慧萍等, 2007; Badar et al, 2021; Delgado et al, 2021)。因此,本文利用Illumina高通量测序技术,从分子生物学层面揭示互花米草在不同盐度胁迫下的基因表达调控规律,深度挖掘其与高盐度抗性相关的基因及代谢通路,探讨其生物入侵分子机制与其高盐度抗性之间分子响应机制。以此为互花米草的入侵机制提供新的启示,也为互花米草及其他入侵物种的防控手段提供重要的理论参考。
1 材料与方法
1.1 实验材料及采集
互花米草(Spartina alterniflora)幼苗(3~5叶期)取自青岛滨海盐沼湿地(120°19′00″E,36°15′48″N),样本无病虫害,长势良好。取样时间为2021年8月,取样地的盐度为10。
1.2 实验方法
1.2.1 培养方法
将取样的互花米草移栽到带排水孔的塑料盆中,填充物为淤泥与砂的混合物,两者比例为3∶1,实验室培养两周后进行盐度胁迫转录组测序分析。培养条件为16 h/8 h周期的光/暗交替,温度为(24±2) ℃,相对空气湿度60%。每盆种植3棵长势一致的互花米草幼苗,每 3 d浇灌1次。
1.2.2 胁迫处理
将适应实验室环境且长势较好的互花米草随机分为3组(每组3个平行),设为对照组(Control Group,CG)(盐度为10)、低盐度组(Low Salinity Group,LG)(盐度为24)和高盐度组(High Salinity Group,HG)(盐度为32)。用NaCl、纯水和海水分别配制盐度为10、24和32的水溶液,用以浇灌3组互花米草,胁迫处理12 h后,取下叶片放入液氮中速冻,并于−80 ℃冰箱保存。
1.2.3 转录组测序方法
将互花米草叶片样本送至生工生物工程(上海)股份有限公司,采用Illumina高通量测序技术,进行转录组测序,并构建其在正常生理条件和胁迫条件下的转录组文库。将测序所得的原始序列使用Fast QC软件进行质量评估,使用Trimmomatic软件进行质量剪切,使用Trinity软件将样本有效数据进行混合拼接。采用NCBI Blast+工具将转录本与CDD、KOG、COG、NR、NT、PFAM、Swissprot和TrEMBL等数据库进行比对,得到其功能注释信息。根据转录本与Swissprot、TrEMBL的注释结果得到GO功能注释信息,利用KAAS得到转录本KEGG注释信息。根据转录本与数据库Blast比对结果和TransDecoder进行CDS(Coding Sequence)预测。以q<0.05(q:多重检验校正后的P)、|log2Fold Change|>1为条件,使用DESeq2进行Unigene表达差异分析,基于差异分析结果绘制热图。使用topGO软件进行GO富集分析,绘制显著性GO有向无环图。使用clusterProfiler进行KEGG通路和KOG分类富集分析。基于基因功能富集分析结果绘制关联分析网络图,查找差异表达Unigene参与的生化代谢途径和信号传导途径。
2 结果与分析
2.1 互花米草测序数据质量分析
对不同盐度胁迫下的9个样品进行测序分析,结果如表1所示。9组样品分别获得51852554、39508588、67375654、36726702、37468186、38988834、42742450、42941540、60585594条过滤序列,分别获得7101166661、5649247965、9605379576、5256817516、5335440311、5562196605、6072862154、6134065719、8719915050 bp过滤碱基。各样本GC含量为45.78%~54.20%,Q30碱基百分比在94.87%以上,表明测序数据质量可靠,可用于后续组装分析。
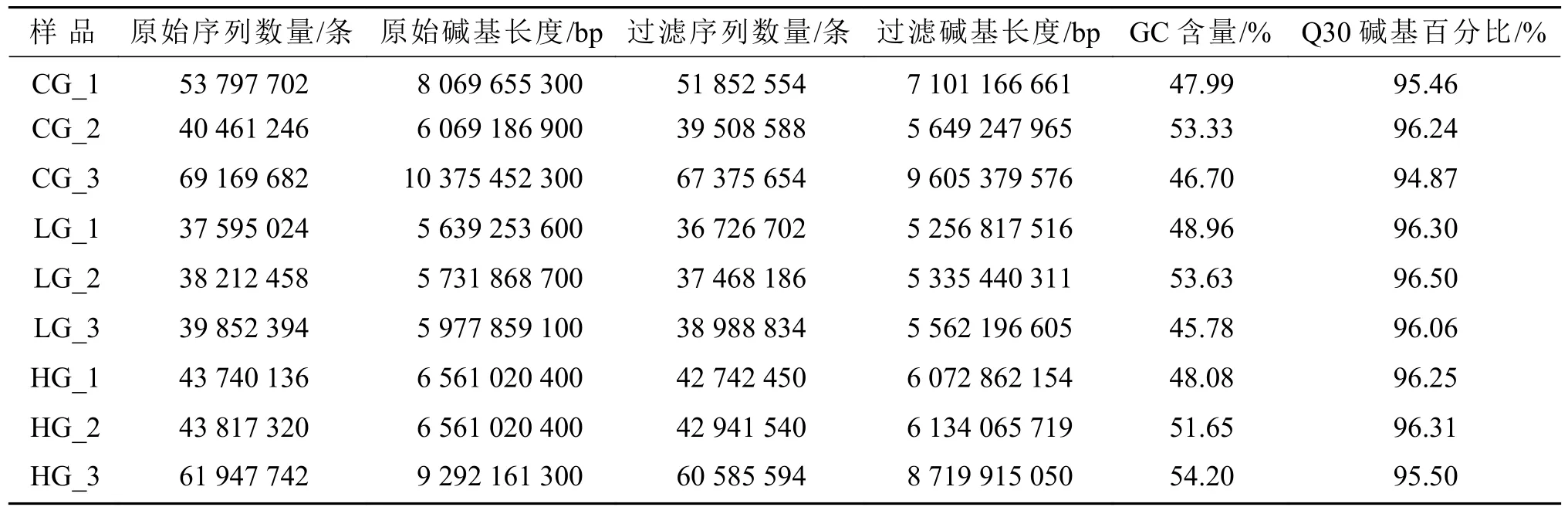
表1 9个互花米草样品的转录组测序结果Table 1 Transcriptome sequencing results of 9 Spartina alterniflora samples
对测序所得序列进行转录本拼接,共获得121760个Unigene,长度范围为201~12705 bp,平均长度为633 bp,N50为1046 bp。具体长度分布情况见图1。
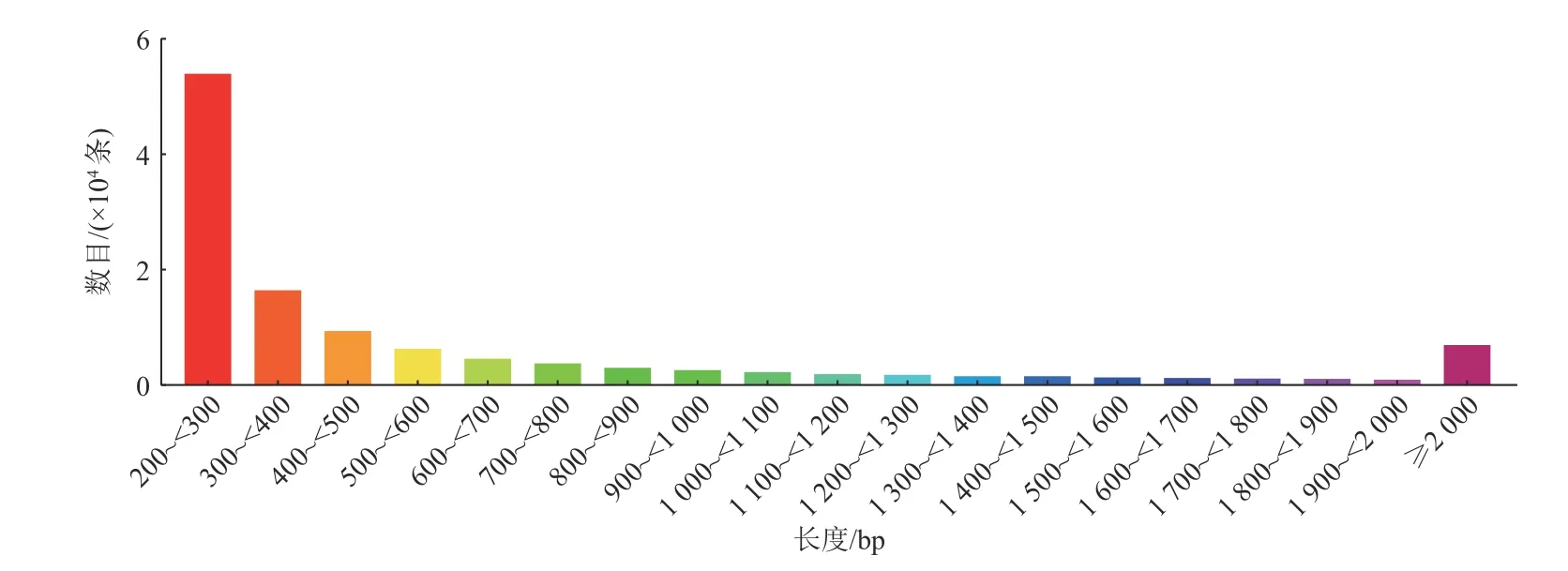
图1 Unigene长度分布Fig. 1 Distribution of unigene length
2.2 基因功能注释
将所得的单Unigene序列与NR、NT、KEGG、PFAM等8个数据库进行比对,有63750个Unigene注释到eggNOG数据库,占Unigene总数的52.36%;58875个Unigene注释到NR数据库,占总数的48.35%。其中70455个Unigene在至少一个数据库得到注释,占总数的57.86%;1812个Unigene在8个数据库均得到注释,占总数1.5%。各数据库Unigene注释数量及比例如表2所示。
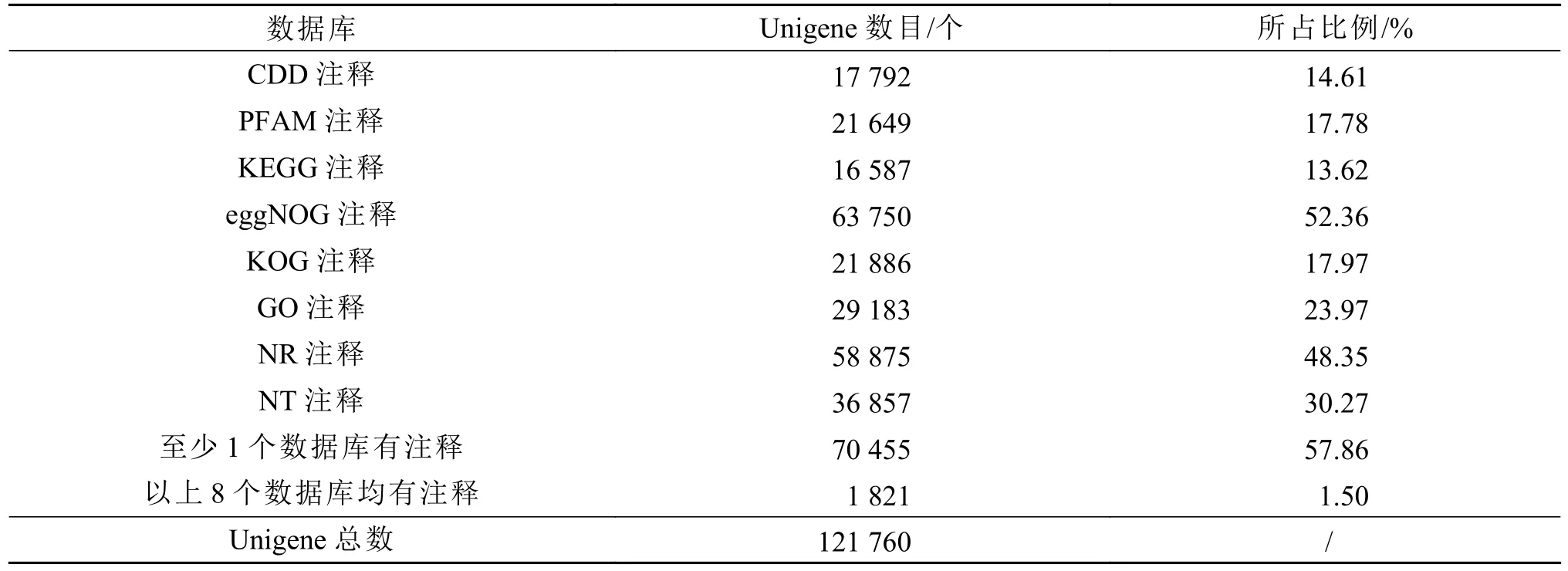
表2 Unigene注释成功率统计Table 2 Statistical result of unigene annotation
将获得的Unigene在GO (Gene Ontology)数据库中进行注释与分类(孙晶京, 2012),结果如图2所示。Unigene共分为67个功能组,根据注释功能的不同又可分为3大类:分子功能(Molecular Function)、生物过程(Biological Process)和细胞组分(Cellular Component)。其中分子功能共包含19个功能组,主要为黏合物(Binding)、催化活性(Catalytic Activity)和转运活性(Transporter Activity);生物过程共包含26个功能组,主要为细胞过程(Cellular Process)、新陈代谢过程(Metabolic Process)和生物调节(Biological Regulation);细胞组分共包含22个功能组,主要为细胞(Cell)、细胞组分(Cell Part)和细胞器(Organelle)。
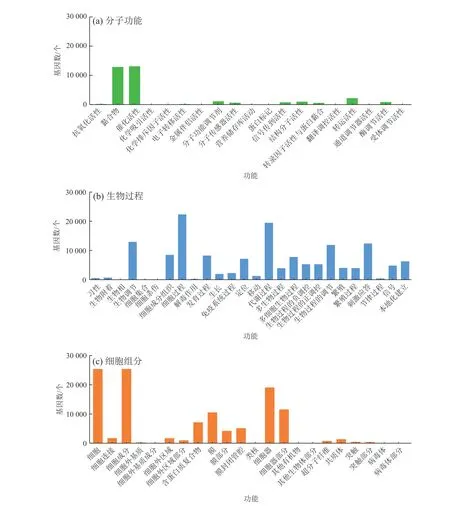
图2 Unigene的GO功能分类Fig. 2 GO functional classification of unigene
将获得的Unigene在KEGG(Kyoto Encyclopedia of Genes and Genomes)数据库中进行注释与分类(李向真等, 2012),结果如图3所示。得到注释的Unigene共划分为5大类:细胞过程(Cellular Processes)、环境信息处理(Environmental Information Processing)、遗传信息处理(Genetic Information Processing)、代谢(Metabolism)和机体系统(Organismal Systems)。细胞过程中注释Unigene较多的是运输和分解代谢(Transport and Catabolism)、细胞生长与死亡(cell growth and death);环境信息处理中注释Unigene较多的是信号传导(signal transduction)、膜转运(membrane transport);遗传信息处理中注释Unigene较多的是翻译(translation)、折叠分拣和降解(folding sorting and degradation);代谢中注释Unigene较多的是碳水化合物代谢(carbohydrate metabolism)、概述(overview)与氨基酸代谢(amino acid metabolism);机体系统中注释Unigene较多的是内分泌系统(endocrine system)、免疫系统(immune system)。
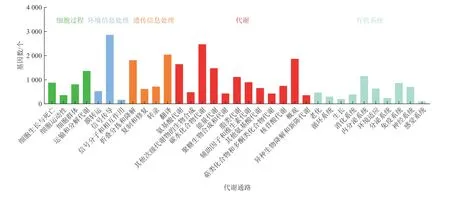
图3 Unigene的KEGG代谢通路分类Fig. 3 KEGG pathway classification of unigene
2.3 差异表达基因分析
将3组样品两两比较进行差异表达分析,以q<0.05、|log2Fold Change|>1为条件,筛选差异表达基因(Different Expression Genes,DEGs),绘制火山图如图4所示。共筛选到1190个DEGs,统计结果如表3所示。 LG组与CG组中有411个DEGs,其中上调Unigene 169个,下调Unigene 242个;HG组与CG组中有56个DEGs,其中上调Unigene 9个,下调Unigene 47个;HG组与LG组中有723个DEGs,其中上调Unigene 319个,下调Unigene 404个。与互花米草耐盐有关的上调表达Unigene有脯氨酸代谢相关基因(SaP5CS2)、稳定Na+/K+比例的阳离子转运体基因(HKT7)、钠/氢交换器基因(NHX2)、抗K+外流基因(K+efflux antiporter 5)、叶绿体中脂氧合酶基因(Lipoxygenase,LOX2)、光系统Ⅱ稳定性基因(Photosystem II stability/assembly factor HCF136)、泛素连接酶E3基因(E3 ubiquitin-protein ligase)等。
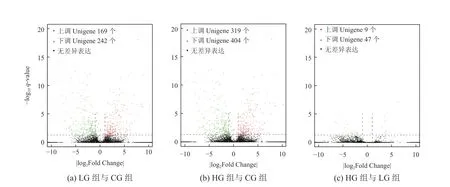
图4 样品组间基因差异表达分析火山图Fig. 4 Volcano plot of differentially expressed genes between the two groups

表3 样品组间的差异表达基因数量Table 3 Number of differentially expressed gene between the two groups
2.4 差异表达基因的GO功能富集分析
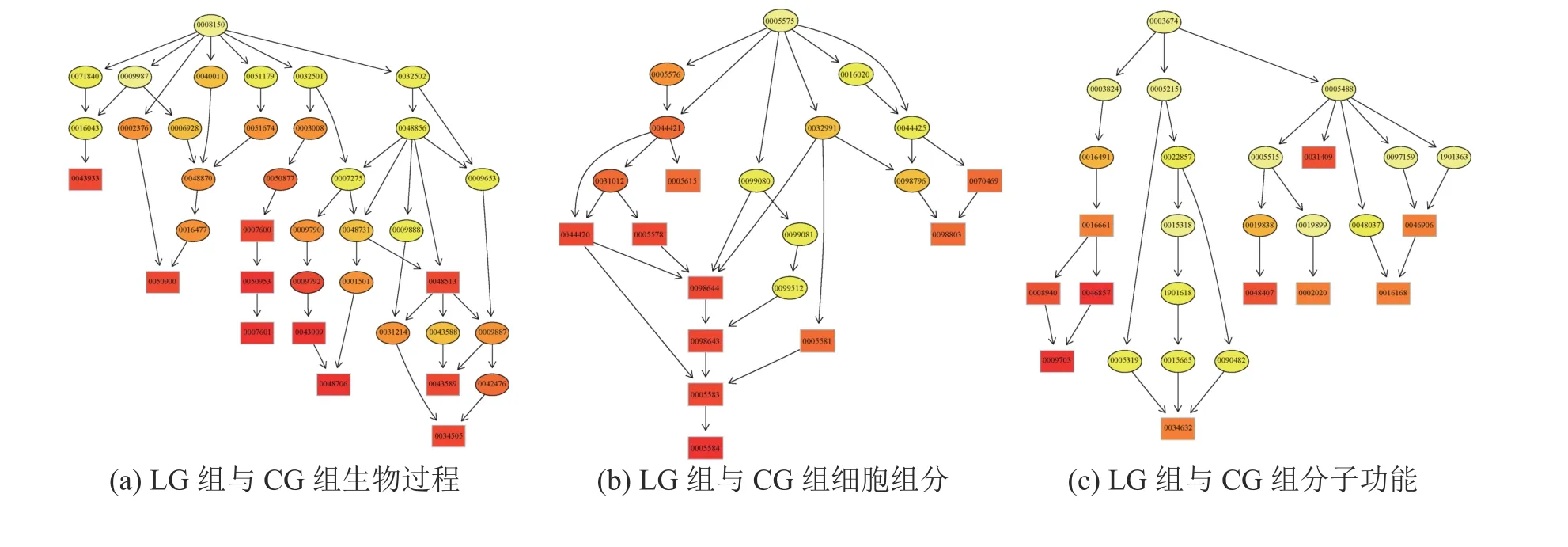
用GO seq软件对三组样本两两比较得到的差异表达Unigene分别进行GO富集分析,结果如表4所示。3组分别富集到2481、1146、2160个GO terms,分为分子功能、生物过程和细胞成分三部分,其中生物过程最多,分别占总数的74.32%、78.36%和70.93%。将GO富集分析的前10个结果作为主要节点,绘制有向无环图(Directed Acyclic Graph,DAG)如图S(附录)所示。其中与互花米草高盐度抗性相关的为GO: 0022857(跨膜转运形成)、GO: 0098660(无机离子跨膜运输)、GO:0015318(无机阳离子跨膜转运蛋白活性)、GO: 0098662(无机阳离子跨膜运输)、GO: 0015081(钠离子跨膜转运器活性)、GO: 0035725(钠离子跨膜运输)、GO: 0015078(质子跨膜转运器活性)、GO:0004129(细胞色素-C氧化酶活性)、GO: 003310(线粒体呼吸链复合体的组装)、GO: 0017004(细胞色素复合体组装)、GO: 0070469(呼吸链)、GO: 0098803(呼吸链复合体)、GO: 0017062(呼吸链复合体III的组装)、GO: 0034551(线粒体呼吸链复合体III)、GO: 0045277(呼吸链复合体IV)、GO: 0016661(氧化还原酶活性,作用于其他含氮化合物作为供体)、GO: 0016705(氧化还原酶活性,作用于成对的供体,结合或还原分子氧)、GO: 0008940(硝酸还原酶活性)、GO: 0046857(氧化还原酶活性,作用于其他含氮化合物作为供体,NAD或NADP作为受体)、GO: 001670(氧化还原酶活性,作用于成对的供体,结合或还原分子氧,NADPH为供体,结合一个氧原子)、GO: 0009703(硝酸还原酶NADH活性)、GO: 0009507(叶绿体)、GO: 0034357(光合作用膜)、GO: 0042651(类囊体膜)、GO:0055035(质体类囊体膜)、GO: 0009535(叶绿体类囊体膜)、GO: 0046906(四吡咯结合蛋白)和GO:0016168(叶绿素结合蛋白)。

表4 差异表达基因GO富集分析Table 4 GO enrichment analysis of differential expressed genes
2.5 差异表达基因的KEGG通路富集分析
使用KEGG数据库对所有差异表达Unigene的代谢通路进行富集分析,对每组前30个富集通路做散点图,富集结果如图5所示。在LGvsCG组中,差异表达Unigene富集到118条代谢通路中,其中显著富集(P<0.05)的KEGG通路有20条,显著富集的通路有血小板激活(platelet activation)、黏着物(focal adhesion)、白细胞内皮迁移(leukocyte transendothelial migration)等信号通路,主要与细胞过程有关;在HG组与CG组中,差异表达Unigene富集到14条代谢通路中,其中显著富集(P<0.05)的KEGG通路有13条,显著富集的通路有光合作用-天线蛋白(photosynthesis-antenna proteins)、ECM-受体相互作用(ECM-receptor interaction)、黏着物(focal adhesion)等信号通路,最显著富集的通路主要与耐盐相关;在HG组与LG组中,差异表达Unigene富集到98条代谢通路中,其中显著富集(P<0.05)的KEGG通路有17条,显著富集的通路有神经营养因子信号通路(neurotrophin signaling pathway)、氰氨酸代谢(cyanoamino acid metabolism)、硫代葡萄糖苷生物合成(glucosinolate biosynthesis)等信号通路,显著富集通路可提高互花米草的耐盐性。
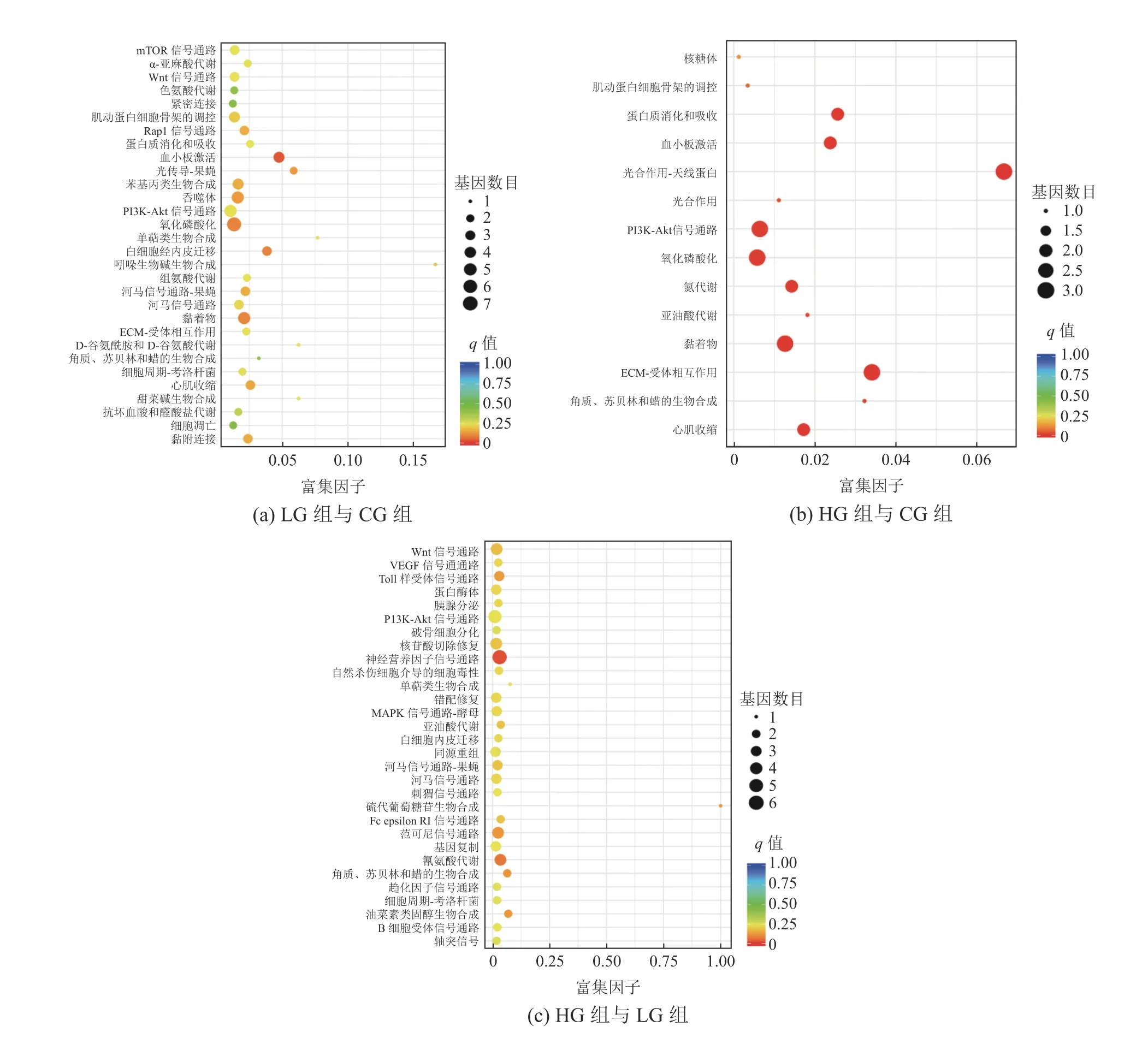
图5 差异表达基因的KEGG功能富集Fig. 5 KEGG functional enrichment of differentially expressed genes
2.6 不同盐度胁迫下功能-基因互作关系
在KEGG数据库中利用获得的DEGs进行注释与分类,挑选富集程度最高的前10个功能和与该功能相关的差异Unigene绘制不同盐度胁迫下显著富集功能-基因互作网络图(Damian et al, 2015; Finn et al, 2016),互作关系如图6所示。其中,显著富集到与互花米草抗逆有关的途径有苯丙素代谢途径(Phenylpropanoid Biosynthesis)、氧化磷酸化途径(Oxidative Phosphorylation)(LG组与CG组)、氮代谢(Nitrogen Metabolism)、光合作用-天线蛋白(Photosynthesis-Antenna proteins)、ECM-受体相互作用(ECM-Receptor Interaction)、P13K-Akt信号通路(PI3K-Akt Signaling Pathway)、氧化磷酸化(Oxidative Phosphorylation)等途径(HG组与CG组),氰基氨酸代谢(Cyanoamino Acid Metabolism)、硫代葡萄糖苷生物合成(Glucosinolate Biosynthesis)、油菜素类固醇生物合成(Brassinosteroid Biosynthesis)、角质、木栓和蜡生物合成(Cutin, Suberine and Wax Biosynthesis)(HG组与LG组)。显著富集到的与互花米草抗逆有关的上调Unigene主要有K04392-ko04014 Ras信号通路(LG组与CG组)、 K02149-ko00190氧化磷酸化(LG组与CG组)、K04392-ko04014 Ras信号通路(HG组与LG组)、K06630-ko04722 神经营养素信号通路(HG组与LG组)、K13027-ko00966 硫代葡萄糖苷生物合成(HG组与LG组)。
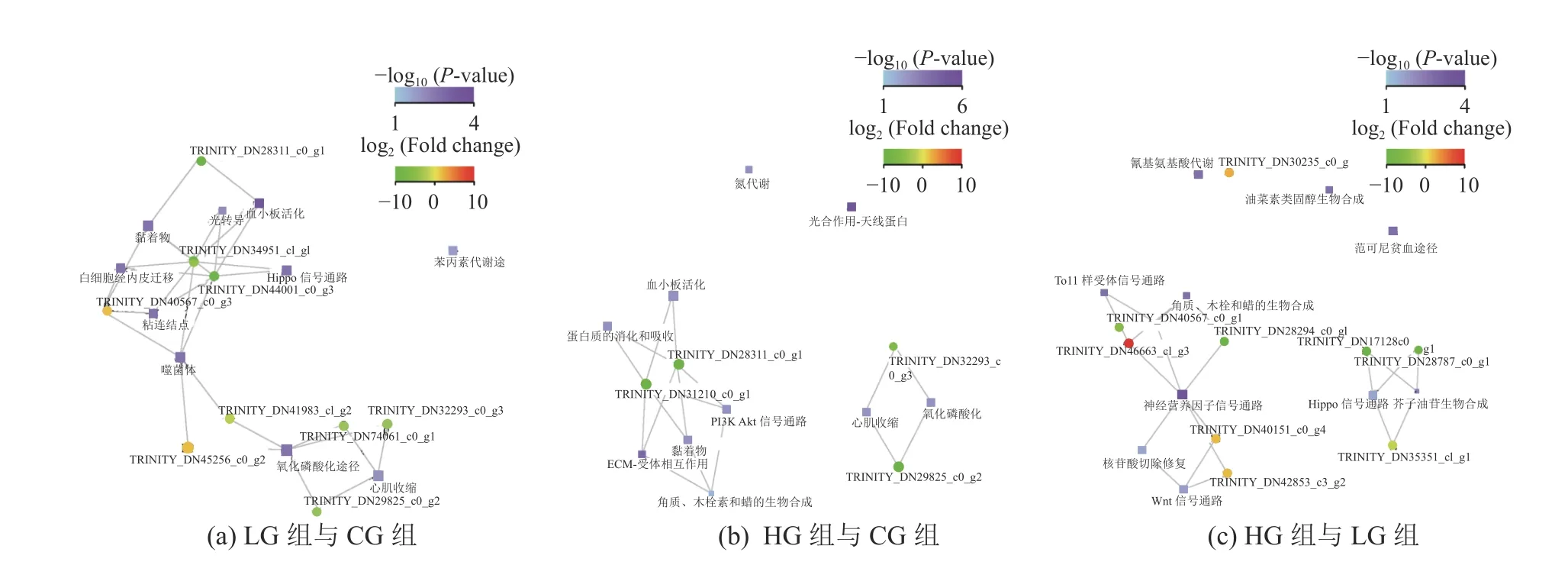
图6 样品间显著富集功能-基因互作网络图Fig. 6 Significant enrichment functional-gene interaction network diagram between the two groups
3 讨论
3.1 转录组测序数据及差异基因分析
将各盐度胁迫处理的互花米草叶片进行转录组测序分析,得到的RNA-seq整体质量评估较好,所测样本无论是在测序数据量、测序错误率或是GC含量等方面都足以支撑后续实验及分析的要求。共获得121760个Unigene,长度范围201~12705 bp,平均长度633 bp,N50为1046 bp。将获得的Unigene与NR、NT、KEGG、PFAM等8个常用数据库进行对比,结果表明57.86%的Unigene被至少1个数据库注释。
本文共得到1190个差异表达Unigene,其中LG组与CG组中有411个(上调Unigene 169个,下调Unigene 242个)、HG组与CG组中有56个(上调Unigene 9个,下调Unigene 47个)、HG组与LG组中有723个(上调Unigene 319个,下调Unigene 404个)。对各组差异Unigene进行深入挖掘分析,发现大量与互花米草抗盐性相关的基因上调,如叶绿体中的脂氧合酶基因、磷脂酶基因、光系统Ⅱ稳定性因子基因等。Mei等(2023)研究发现玉米可通过调控脂质运输相关基因的表达来调节光合膜中的脂质组成,维持其在盐胁迫下的光合活性和正常生长(Mei et al, 2023)。Temme等(2020)通过盐度胁迫向日葵发现,累积的Na+会造成离子毒性风险,耐盐植物可以通过离子转运体将体内多余钠离子(Na+)转运出体外,稳定Na+/K+比例,也是维持植物正常代谢的必要条件(Temme et al, 2020)。在本研究中,LG组与CG组和HG组与LG组中富集到的阳离子转运体基因、钠/氢交换器基因、抗K+外流基因和钾转运蛋白基因等Unigene表达量均显著上调。非生物胁迫作用下,植物体内脯氨酸作为兼容的渗透剂合成代谢会显著提升(Hildebrandt, 2018; Batista-Silva et al, 2019),在LG组与CG组,与脯氨酸、蛋氨酸、丝氨酸和谷氨酸等氨基酸代谢与转运相关Unigene显著上调,包括SaP5CS2、蛋氨酸S-甲基转移酶基因(Methionine S-methyltransferase)、丝氨酸/苏氨酸蛋白激酶EDR1基因(Serine/threonine-protein kinase EDR1)谷氨酸氨基转移酶2基因(Glutamate glyoxylate aminotransferase 2)等。此外,本研究中泛素连接酶(E3)Unigene表达量显著上调,有报道称该基因在植物-非生物胁迫(如高盐度、干旱)相互作用中起调节作用(Shu et al, 2017)。因此,互花米草在受到盐胁迫时,可以高度调动相关基因大量表达,从而使其具有较强的适应性与竞争优势。
3.2 GO注释分析
对差异表达Unigene进行GO功能注释与分类,主要分为3大类:细胞组分、分子功能和生物过程,其中生物过程占比最多,均达到70.93%及以上。生物过程中的细胞过程、代谢过程、刺激应答、生物调节、生物过程调控和定位等表达基因被大量富集,此外,还大量富集到与催化活性有关的分子功能相关基因和与细胞、细胞成分、细胞器、膜等细胞组分等有关的表达基因(图2)。其中,刺激应答、生物调节、生物过程调控和细胞膜相关过程与植物的生长发育和胁迫应答调控密切相关,这些基因在互花米草应对盐胁迫过程中被大量富集,其耐盐响应是多生物过程共同调控(王涛涛, 2020)。
3.3 KEGG注释分析KEGG
代谢通路富集分析表明,差异表达Unigene富集到118条代谢通路中,其中有多条代谢通路可以响应盐度胁迫。细胞过程(如运输和分解代谢(Juan et al, 2023))、遗传信息处理过程(如翻译、折叠分拣和降解(Monika et al, 2022))、环境信息处理过程中的信号传导(如信号传导(Wu et al, 2018)、膜转运(Yuriko et al, 2014))和与应对胁迫有关的代谢过程(如碳水化合物代谢(Gao et al, 1998)、与氨基酸代谢(Batista‐Silva et al, 2019))都有大量基因被富集。因此互花米草可通过调动体内多条代谢途径来共同响应盐度胁迫。
3.4 基因蛋白互作分析
高盐度对比低盐度的功能-基因互作网络图中也可见高表达的抗逆相关途径。本研究中互花米草启动多条代谢通路来响应高盐度胁迫,同时有多个基因参与应答。其中互花米草的角质、木栓和蜡生物合成,苯丙素、氮代谢,P13K-Akt信号通路、ECM-受体相互作用,氧化磷酸化等途径在互花米草高盐度胁迫处理时显著激活。角质和蜡是植物表皮的主要前体,能提供其各种胁迫保护,植物最适环境的改变会调动合成表皮前体基因的表达(Ayaz et al, 2021),因此,互花米草通过增加其茎叶等器官中角质和蜡的表达,来增强其生物入侵能力及高盐度抗性。盐度胁迫会抑制植物吸收、运输和利用含氮离子氮元素,进而影响氮代谢,进而影响植物代谢的中心“枢纽”——苯丙素途径,该途径在调控植物抗盐度胁迫过程中发挥重要作用,可直接影响木质素的积累量(Xu et al, 2022; 尚军等, 2022),氮还可与硫代葡萄糖苷等物质协作干预外源胁迫(Ashraf et al, 2018; Landi et al, 2019; Jia et al, 2022)。而硫代葡萄糖苷合成代谢的某一种调控途径由油菜素内酯参与。油菜素内酯是国际公认的最有效、无毒的植物生长激素,能调节植物的光合作用、呼吸作用、蒸腾作用,还能提高植物的抗逆性(Liu et al, 2022)。另外,在高盐的环境中,植物可通过保持有效的光合作用和防止氧化损伤来抵御盐胁迫(陈健妙等, 2009; Radosław et al, 2021)。在基因-功能互作HG组与CG组中多次被富集到的P13K-Akt信号通路的研究集中在抗炎抗病性,尤其是动物肿瘤方面(Yu et al, 2022; Wang et al,2023),推测在高盐胁迫下互花米草调动了该通路应对胁迫。ECM-受体相互作用在HG组与CG组和LG组与CG组都明显富集到,可能与柳树、白刺等(武香等, 2012)渗透调节的生理相应相似,互花米草为应对NaCl胁迫可能调动了细胞外基质受体的应对机制,调节K+/Na+比例及其他可以调节渗透压的物质以适应盐度胁迫。以上途径的正常运作都需要大量能量供给,而且需要大量的能量来转运离子以维持渗透压(梁书荣等, 2021; Ikram et al, 2022)。本研究发现氧化磷酸化通路在盐度为24(LG)和32(HG)时被大量富集,而且与CG组相比,处于高盐度环境中的LG与HG组中,NADH脱氢酶(ND4)与细胞色素C氧化酶(COX1、COX3)也显著上调,这表明盐胁迫下互花米草通过激活氧化磷酸化通路来响应盐胁迫,驱动ATP合成增加来供给各高抗途径。此外,还有大量与盐胁迫相关的代谢通路,如脯氨酸(汤华等, 2007)、糖代谢(许兴等, 2006) 、氰基氨酸代谢(Xu et al, 2023)等,在本研究的转录组中也被富集到。汤华等(2007)研究玉米苗期耐盐性发现游离脯氨酸随着盐度增高而增高(汤华等, 2007),在本实验中与脯氨酸合成代谢有关的基因SaP5CS2被富集到。氰化物是一种抑制细胞呼吸的有毒化学物质,Xu等在拟南芥耐盐性研究中发现与氰基氨酸代谢有关的氰基丙氨酸合酶和氧化酶相互作用对于提高植物耐盐性是必不可少的,与本实验氰基氨酸代谢途径上调相符。
4 结语
互花米草作为一种盐沼植物,其在我国滨海湿地地区的大量入侵及扩散与其对环境的适应性机制有重要的联系,因此对互花米草的防治要从其关键的入侵机制进行研究。本文主要通过对10(CG)、24(LG)和32(HG)三种不同盐度处理的互花米草进行转录组学测序及分析,挖掘到互花米草响应盐度胁迫的多个关键耐盐基因(如SaP5CS2、HKT7、NHX2等)及代谢通路(如脯氨酸代谢通路、氮代谢通路等),这些基因及代谢通路通过调控互花米草体内脯氨酸等渗透调节物质、角质和蜡等抗胁迫物质、调控Na+/K+平衡、激活P13K-Akt等信号通路等多种途径共同影响互花米草的入侵及扩散能力。本研究在分子水平上揭示了互花米草对高盐度胁迫的响应机制,并初步探讨了与其在生物入侵及扩散过程中的重要作用,为互花米草等盐生入侵物种防控手段提供新的启示。
附 录