长江口及邻近海域有色溶解有机物的来源、组成和影响因素
2023-11-15陈慕雨韩露露
陈慕雨,陈 霖,韩露露,赵 彬,姚 鹏*
(1. 海洋化学理论与工程技术教育部重点实验室,山东 青岛 266100;2. 中国海洋大学 化学化工学院,山东 青岛 266100)
溶解有机物(Dissolved Organic Matter,DOM)是水生生态系统中主要的有机物形式,溶解有机碳(Dissolved Organic Carbon,DOC)是DOM的重要组成部分(Danhiez et al, 2017)。海洋中的DOC是地球上最大的活性碳库,其碳量与大气中储存的碳量及陆地上生物量储存的碳量之和相当(Osburn et al, 2016)。由于DOC与大气CO2、气候变化及全球变暖之间存在着潜在的联系,研究海洋中DOC的来源、迁移转化过程和归宿对深入认识全球碳循环及对全球变化的响应和反馈有重要意义(Bauer et al, 2011)。
DOM中一部分具有光学特性且可以吸收紫外可见光的被称为有色溶解有机物(Colored Dissolved Organic Matter,CDOM),CDOM中一部分受激后会发出荧光的被称为荧光溶解有机物(Fluorescent Dissolved Organic Matter,FDOM)(Yu et al, 2016)。CDOM的光吸收特性主要取决于其来源不同导致的组成差异,陆源CDOM含有更多的腐殖酸和大分子有机物,而海洋自生来源CDOM含有更多的黄腐酸和较小分子的有机物(Helms et al, 2008)。通过对CDOM在特定波长下的吸收性质和荧光特性的研究,可以获得CDOM绝对含量、组成、分子量和芳香性等定性或定量的信息,进而为研究其来源和降解程度,示踪不同水团混合、输运过程中DOC的迁移转化等提供重要依据(Helms et al,2008; Stedmon et al, 2015; Hansen et al, 2016)。
长江口及邻近海域位于长江径流与潮流、淡水与咸水相互作用的区域,属于东海。东海位于太平洋西北部,平均水深为370 m,面积为770×103km2,是一个典型的陆架边缘海(Qiao et al, 2011)。靠近中国大陆的东海内陆架受多个不同水团输入影响,这些水团本身携带大量来源和性质不同的DOM,在混合和输运过程中还会发生物理、化学和生物过程,影响其中DOC浓度和CDOM的含量、组成、分布和迁移转化。研究表明,影响长江口DOM组成的因素主要是陆源输入、保守性混合和浮游植物现场生产或沉积物向水体释放等(Sun et al, 2014; 徐亚宏等, 2017; Zhou et al, 2018; Zhu et al,2018; 叶君等, 2019);而在东海盐度为24~35的区域,微生物活动可能是控制DOM分布的重要因素(Zhao et al, 2013; Bai et al, 2015; Kim et al, 2020)。尽管已开展了较为丰富的研究,但这些研究多集中在长江口盐度梯度断面或外陆架海域,对长江口及邻近海域DOM组成和分布特征及影响因素的认识较少,缺少过程和机制的研究。我们于2018年夏季在长江口及邻近海域多个断面采集了水样,通过测定DOC浓度、CDOM的紫外可见吸收特征和荧光组成,并结合温度、盐度、溶解氧、叶绿素a等环境因素,明确了该区域DOC浓度和CDOM的绝对含量、组成、分子量和芳香性等的分布特征,分析了理化环境、水团混合和生物活动等对CDOM来源和归宿的影响,以期加深对大河口区DOC的循环过程的认识,揭示其过程和机制。
1 材料与方法
1.1 研究区域与样品采集
夏季长江口及邻近海域主要受长江冲淡水、浙闽沿岸流、台湾暖流和黑潮分支输入的影响(图1)(Liu et al, 2007; Zhou et al, 2018)。长江冲淡水的特征为低盐度、高营养盐和高悬浮泥沙含量,夏季流量较其他季节大,主要向NE和SW两个方向进行输运(Sato et al, 2022)。台湾暖流跨过陆坡穿越到东海陆架,并与浙闽沿岸流混合(Zhou et al, 2015)。台湾暖流表层水是由台湾海峡暖水以及台湾东北部向陆架入侵的黑潮表层水混合形成的,呈现高温高盐的特征;台湾暖流深层水主要由黑潮次表层水形成,有低温、高盐的特点(Qi et al, 2017)。

图1 研究区域内的流系分布和采样站位Fig. 1 Distributions of current system and sampling stations in the study area
2018-08-05—18海洋化学理论与工程技术教育部重点实验室成员搭乘“海力号”科学考察船在长江口及浙闽沿岸进行现场观测,共设置9个断面58个站位,其中主要在断面A2、A、D和G共22个站位采集DOC和CDOM样品,根据水深设置3~5层采样层次,采样水深为2 m、10 m、20 m、30 m和50 m,最终获得33个DOC样品和27个CDOM样品(采样站位见图1b)。长江下游大通水文站在8月上旬的径流量为3.55×1010m3,8月中旬的径流量为3.27×1010m3,处于全年径流量的峰值时段(水利部长江水利委员会水文局, 2018)。获得的水样部分用孔径0.7 μm的GF/F玻璃纤维滤膜(预先在马弗炉内于450 ℃灼烧4~5 h)过滤并收集于60 mL洁净的聚丙烯(PP)瓶中,于−20 ℃冷冻保存,带回实验室继续冷冻保存,待测定时将样品解冻至室温后进行DOC和CDOM分析。全部站位的温度、盐度、密度、溶解氧(DO)、pH和叶绿素a等基本理化参数通过多参数剖面仪(RBR maestro,加拿大RBR公司生产)获得,各探头在使用之前均经过校正。表观耗氧量(Apparent Oxygen Utilization,AOU)的质量摩尔浓度由饱和溶解氧与观测溶解氧差值表示(Duteil et al, 2013):
式中:DOs为在压力为101.325 kPa、相对湿度为100%、指定温度和盐度下氧的溶解度(单位:mg/L),DO为实测的水体的溶解氧质量浓度(单位:mg/L)。
1.2 样品分析
1.2.1 DOC浓度
DOC浓度的测定采用高温催化氧化法(Xue et al, 2015),使用的仪器为日本岛津总有机碳分析仪(TOC-L型,日本岛津公司生产)。在测样前一天,将待测样品放置在避光处解冻并恢复至室温,测样当天用邻苯二甲酸氢钾(分析纯,购自上海山浦化工有限公司)配置标准曲线。样品测定时先经高纯度和高浓度的盐酸酸化至pH<2以去除无机碳。样品每次进样量为60 μL,每份样品平行测定3~5次,确保测量结果的标准偏差<2%。采用Milli-Q超纯水(Milli-Q Reference超纯水系统,德国默克密理博公司生产 )对仪器的状态和空白进行检测,并利用美国迈阿密大学Hansell实验室提供的深海水作为DOC标准进行校正,以确保样品测定结果的准确度。
1.2.2 CDOM紫外吸收和三维荧光特征
CDOM的吸收光谱采用岛津UV-2700紫外可见分光光度计进行测定。测样时使用规格为1 cm×1 cm的石英比色皿,并使用当天制备的Milli-Q水进行基线校准。测定每个样品波长范围为200~800 nm的吸光度,每1 nm记录一次。用350 nm处的吸收系数a350表示CDOM的绝对含量;用光谱斜率S275-295指示CDOM分子量大小,以400 nm作为参比波长,采用指数回归的方法对波长275~295 nm进行拟合获得;用SUVA254表征水体中CDOM分子的芳香化程度,计算方法为254 nm波长下的吸光度除以DOC的浓度(单位:L·C·(mg·m)−1)(Helms et al, 2008)。
CDOM的荧光光谱采用三维荧光光谱仪(RF-6000型,日本岛津公司生产)进行扫描测定,以Milli-Q超纯水作为空白消除拉曼散射影响。使用的石英比色皿规格为1 cm×1 cm,氙灯光源的功率为450 W,光电倍增管电压为700 V。测样时,激发波长(λex)为240~450 nm,步长5 nm,发射波长(λem)为250~550 nm,步长5 nm,增量和狭缝宽度都为5 nm,扫描速度为2400 nm·min−1,扫描信号积分时间为0.05 s。用拉曼单位(Raman Unit, R.U.)表示水样CDOM荧光组成的绝对含量。
使用平行因子分析(Parallel FactorAnalysis, PARAFAC)对三维荧光光谱进行解析(Stedmon et al,2003)。PARAFAC是一种利用交互最小二乘法使得数据的残差平方和最小的算法,可以将复杂的荧光激发发射矩阵(Excitation-Emission Matrix spectroscopy,EEMs)分解为独立的荧光组分,组分对比可通过OpenFluor数据库完成。PARAFAC分析用MATLAB 2019b软件(Murphy et al, 2013)进行。此外,通过EEMs光谱计算腐殖化指数(HIX)和生物指数(BIX)(Huguet et al, 2009),HIX指征CDOM的腐殖化程度,计算方法为在λex为225 nm和λem为434~480 nm 的荧光强度区域积分值与λem为300~346 nm 的荧光强度区域积分值之比(Ortega-Retuerta et al, 2010);BIX指示 CDOM 中自生来源的比例,计算方法为在λex为310 nm,λem为380 nm 和430 nm的荧光强度之比(Huguet et al, 2009)。
1.3 统计分析
利用Origin 2021软件进行主成分分析(Principal component Analysis,PCA),以揭示影响DOC和CDOM的主要因素(Bro et al, 2014)。使用Origin 2021软件对DOC浓度和CDOM各特征参数与盐度等进行相关性分析,以探讨水团混合等对长江口及邻近海域DOM的影响。利用Origin 2021软件对CDOM荧光组分C1、C2和C3进行相关性和显著性分析,以明确各荧光组分之间的相似性和差异性。利用Origin2021软件进行配对样品t检验,以判定数据之间的差异是否显著。
2 结 果
2.1 基本理化参数分布特征
2018年8月长江口及邻近海域基本理化参数平面分布见图2。温度的变化范围是18.7~31.2 ℃,从表层的(29.4 ± 1.4) ℃到中层的(25.1 ± 3.3) ℃再到底层的(23.2 ± 3.4) ℃,呈下降趋势(p<0.05)。在长江口附近和杭州湾外水温较低(尤其是中层和底层),与浙闽沿岸南部相差较大(图2a、图2b和图2c)。盐度(S)的变化范围分别是17.0~34.5,在靠近长江口的区域受长江冲淡水的影响盐度较小,尤其是表层(图2d)。将S<15的水体定义为低盐水,15≤S<30的水体定义为中盐水,S≥30的水体定义为高盐水(Wei et al, 2021)。低盐水的分布范围要高于中层和底层,高盐水主要分布在长江口外和浙闽沿岸(图2)。DO的最小值为31.4 μmol·L−1,最大值为464.8 μmol·L−1,从表层的(239.5 ± 50.3)μmol·L−1到中层的(173.7 ± 55.6) μmol·L−1再到底层的(124.0 ± 45.3) μmol·L−1,整体呈下降趋势(p<0.05)。表层DO较高的区域主要在长江口和杭州湾外(图2g);中、底层DO较低的区域也主要集中在这些区域(图2h和图2i),浙闽沿岸南部有些区域DO也较低(最低处主要集中在断面G)。

图2 基本理化参数的平面分布Fig. 2 Horizontal distributions of basic physical and chemical parameters
表层水体中AOU的值最低,为(−41.6 ± 49.1) μmol·kg−1(图2j),且该值较低的区域对应DO较高的区域(p<0.05);中层AOU较低的区域主要集中在长江口和浙闽沿岸(图2k);底层AOU最高,最高值为193.1 μmol·kg−1(图2l)。pH的分布特点和DO相似,从表到底逐渐降低(图2m、图2n和图2o)(p<0.05),高pH主要在长江口外高盐的区域,pH最低处在口门及靠近黄海的区域。叶绿素a的高值主要在表层,集中在长江口外的区域,最高达25.7 μg·L−1(图2p),中层的高值主要在浙闽沿岸断面E附近(图2q),底层叶绿素a质量浓度普遍较低(图2r)。
2.2 DOC浓度与CDOM各特征参数及荧光组分的特征与分布
DOC浓度变化范围是38.1~ 143.2 μmol·L−1,从表层的(91.6 ± 18.4) μmol·L−1到中层的(74.2 ± 14.7)μmol·L−1再到底层的(70.7 ± 14.2) μmol·L−1,总体呈下降趋势(p<0.05)。受长江淡水输入的影响,表层DOC浓度有较高值(图3a),中层(图3b)和底层(图3c)也是高值,相对于长江口门外表层数值有所下降。CDOM绝对含量(以a350指示)的最低值为0.2 m−1,最高值为4.2 m−1,从表层的(1.5 ± 0.8) m−1(图3d)到中层的(1.4 ± 1.1) m−1(图3e)再到底层的(1.6 ± 1.1) m−1(图3f),呈先降低再升高的趋势(p<0.05)。S275-295变化范围是(0.008~0.048) nm−1,从表层的(0.018 ± 0.004) nm−1(图3g)到中层的(0.017 ± 0.006) nm−1(图3h)再到底层的(0.017 ± 0.008) nm−1(图3i),该值无明显变化,高值区主要集中在浙闽沿岸附近。SUVA254变化范围是 0.6~4.8 L·C·(mg·m)−1,表层低值主要集中在杭州湾外和浙闽沿岸附近,中、底层该值在长江口较高,杭州湾外较低。表层和中层HIX较高的区域主要集中在长江口(图3m和图3n),底层HIX最低,在浙闽沿岸附近有高值(图3o)。BIX变化范围是0.1~1.6,从表层的(1.1 ± 0.2)(图3p)到中层的(1.0 ± 0.3)(图3q)再到底层的(1.1 ± 0.3)(图3r),呈现先降低后升高的分布趋势(p<0.05)。
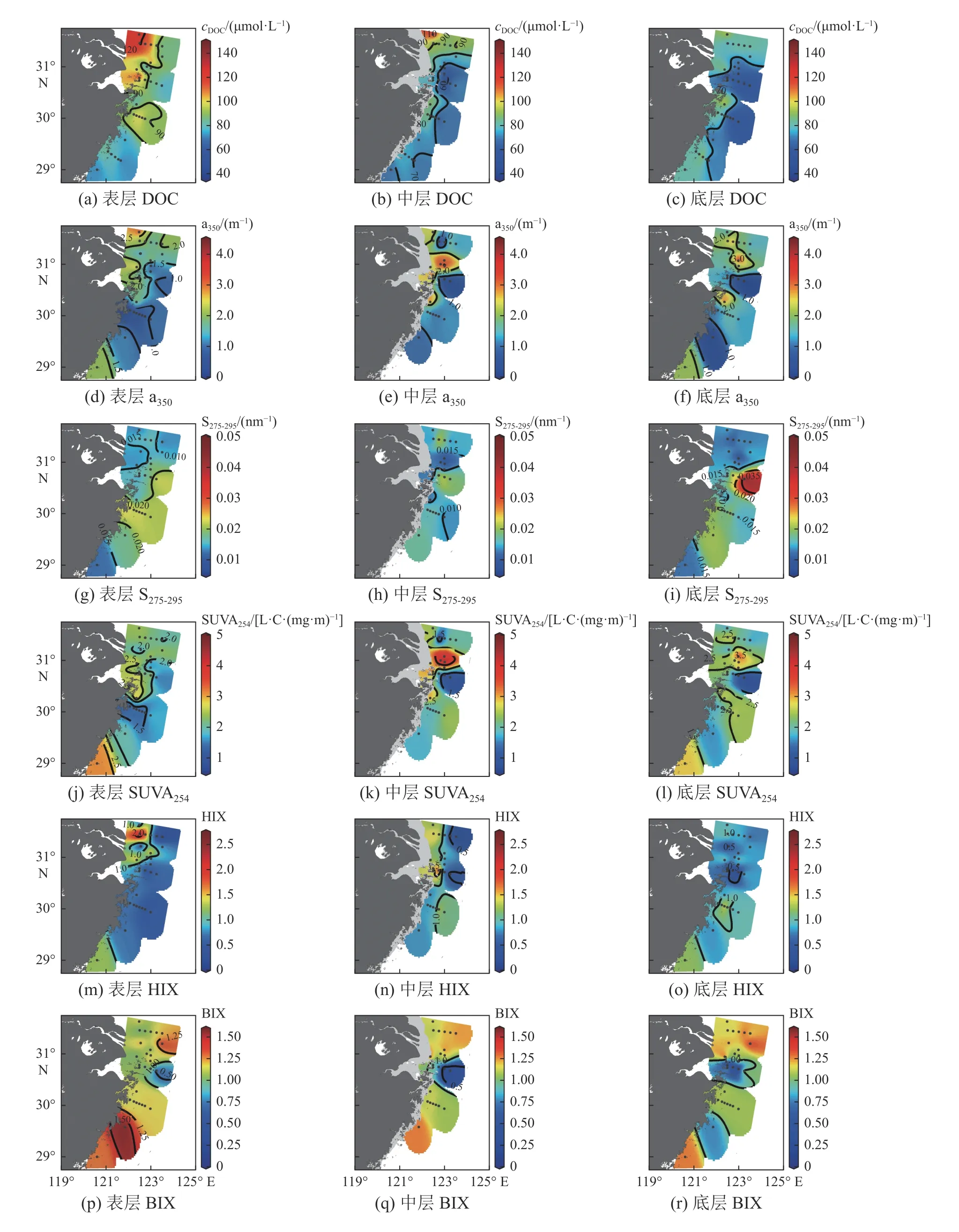
图3 DOC及CDOM特征参数的平面分布Fig. 3 Horizontal distributions of DOC and CDOM characteristic parameters
对研究区域内CDOM样品进行PARAFAC分析,得到3种荧光组分(表1),其EEMs见图4。2个类腐殖质组分中C1的最大λex为240 nm和285 nm,最大λem为352 nm;C3的最大λex为265 nm和335 nm,最大λem为428 nm。1个类蛋白组分C2的最大λex为270 nm,最大λem为306 nm。组分C1具有明显的类腐殖质双峰型(图4),并存在峰偏移情况,其双峰位置与典型的陆源类腐殖质组分不同。将组分C1与OpenFluor数据库中的组分进行比对,发现该组分可能与海洋类腐殖质M峰相似(相似度为94.66%)[31]。M峰易发生蓝移,相对于其他类腐殖质A峰和C峰,其芳香性和分子量均较低,且通常被认为来自海洋浮游生物的生产(Fellman et al, 2010; Yamashit et al, 2011; Murphy et al, 2018)。综合上述分析,判定组分C1为自生源类腐殖质,陆源和海源均有贡献。该组分的变化范围为0~0.22 R.U.,从表层的(0.10 ± 0.05) R.U.(图5a)到中层的(0.06 ± 0.04) R.U.(图5b)再到底层的(0.06 ±0.04) R.U.(图5c),呈下降趋势(p<0.05)。表层高值区主要为口门处和杭州湾外,中层高值区为口门处和浙闽沿岸附近,底层有少量高值分布于杭州湾及浙闽沿岸。组分C2是典型的类蛋白荧光组分(类酪氨酸),在不同的水体环境中均有报道,主要来源是海洋生物活动(Graeber et al, 2012;Kowalczuk et al, 2013)。该组分的变化范围是0~0.70 R.U.,总体从表层的(0.20 ± 0.18) R.U.(图5d)到中层的(0.10 ± 0.07) R.U.(图5e)再到底层的(0.06 ± 0.06) R.U.(图5f),呈下降趋势(p<0.05),表层和中层高值区主要分布在口门外、杭州湾及浙闽沿岸附近,底层的高值区主要在浙闽沿岸附近。组分C3代表了具有最大激发波长和发射波长的荧光组分,反映了长波类腐殖质的荧光特性,主要由陆地中富含有机质的土壤和植物凋零物降解生成的腐殖酸组成,是具有高分子量和高芳香性的陆源类腐殖质(郭卫东等, 2007; Osburn et al, 2011; Goncalves-Araujo et al, 2015)。该组分的变化范围为0~0.16 R.U.,从表层的(0.05 ± 0.04) R.U.(图5g)到中层的(0.03 ± 0.02) R.U.(图5h)再到底层的(0.02 ±0.01) R.U.(图5i),总体呈下降趋势(p<0.05)。表层和中层的高值区主要出现在口门和杭州湾外,底层的高值区分布在浙闽沿岸附近。

表1 平行因子方法(PARAFAC)鉴别出的长江口及邻近海域3个荧光组分Table 1 Three fluorescent components of CDOM in the Changjiang esturay and adjacent waters by PARAFAC model

图4 CDOM荧光组分的EEMs图Fig. 4 EEMs diagram of fluorescence components of CDOM
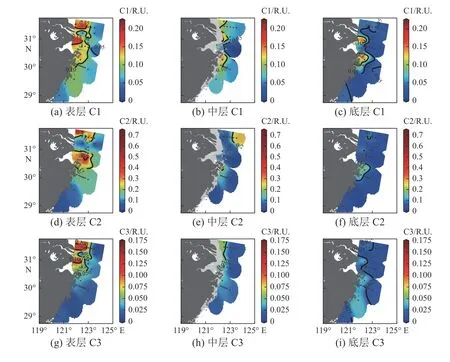
图5 CDOM荧光组分的平面分布Fig. 5 Horizontal distributions of CDOM fluorescent components
2.3 主成分分析结果和相关性分析结果
PCA结果表明,表层、中层和底层两个主成分分别解释了环境因素、DOC浓度和CDOM各特征参数总变化的58.3%、65.0%和64.3%(图6)。图6a、图6b和图6c说明了不同水深的环境因素与DOC浓度和CDOM各特征参数之间的相关性及影响程度。在表、中、底层,盐度(S)与DOC、a350、SUVA254和HIX箭头方向均相反,且之间夹角大于90°,表明盐度与这些参数呈负相关且相关性较强。pH、DO、温度(t)和叶绿素a与DOC、CDOM各特征参数及CDOM荧光组成的夹角均小于90°且夹角在表层大于中层和底层(图6),说明环境因素与DOC和CDOM各特征参数有正相关关系,且表层相关性较小。
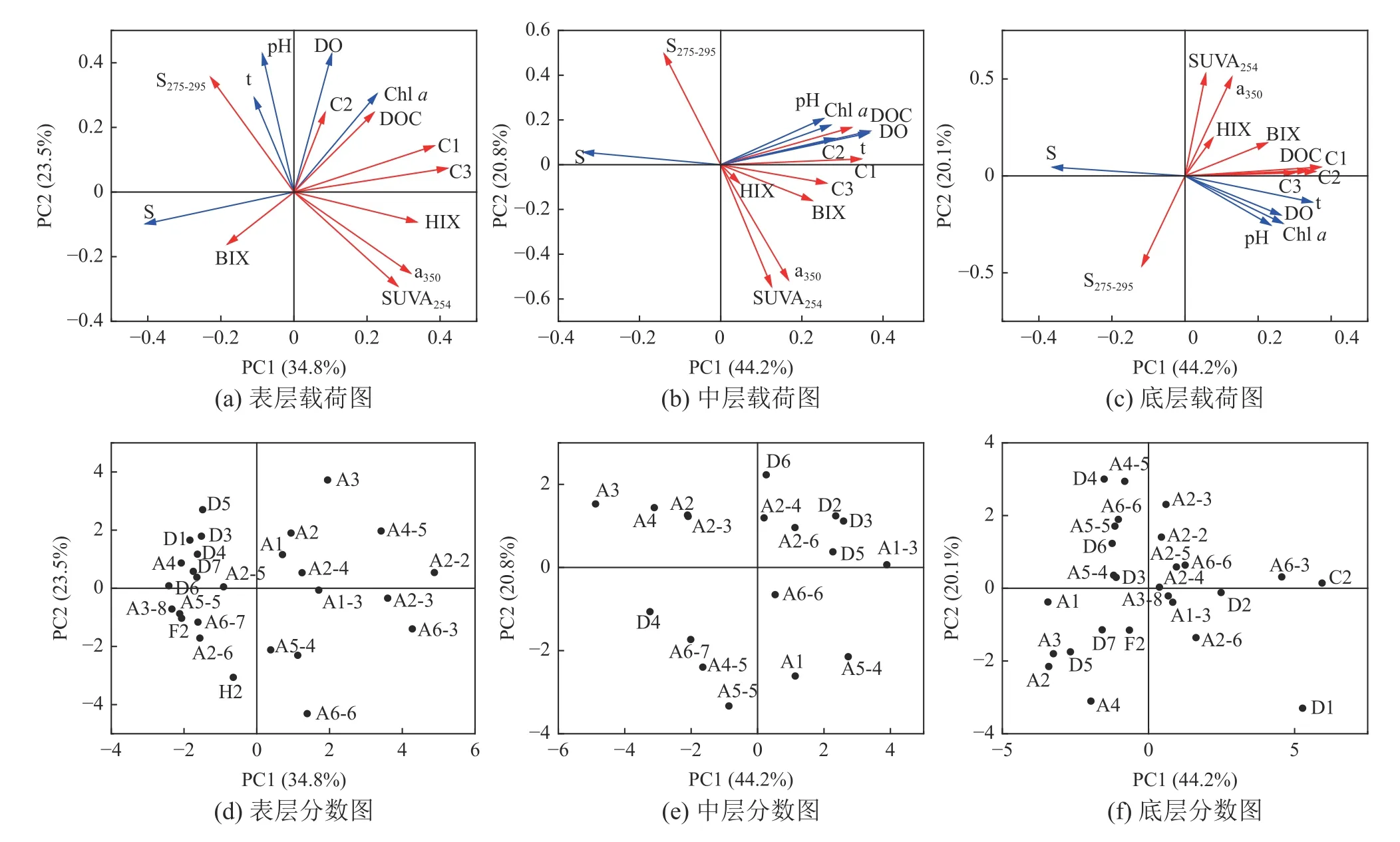
图6 DOC与CDOM特征参数及CDOM荧光组成与环境因子的主成分分析(PCA)Fig. 6 PCA of DOC, CDOM characteristic parameters and CDOM fluorescent components with environmental factors
DOC浓度与这些参数之间的回归分析结果也表明了环境参数与DOC和CDOM各特征参数有正相关关系,且表层相关性较小(图7)。DOC与CDOM荧光组分的箭头方向相同,且夹角均小于90°,表明DOC与CDOM荧光组分有一定的正相关性。
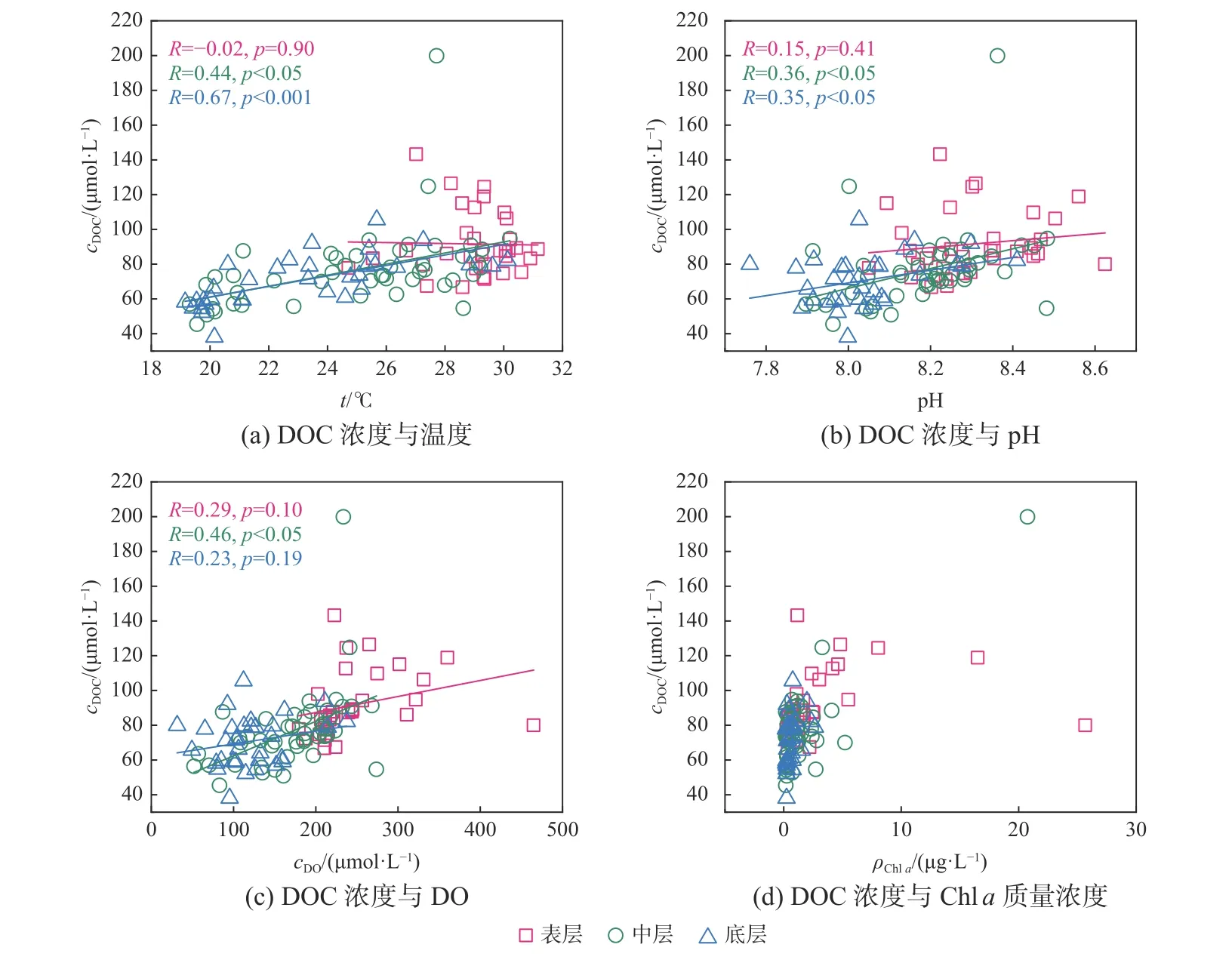
图7 DOC与温度、pH、DO和叶绿素 a 的关系Fig. 7 The relationships of DOC with temperature, pH, DO and chlorophylla
不同采样区域DOC和CDOM受环境因素影响的程度不同(图6d、图6e和图6f)。PCA分数图表明,盐度是影响长江口附近的表层水的主要因素,温度和pH是影响断面D的表层水与长江口和浙闽沿岸附近的中层和底层水的主要因素(图6e)。主要受叶绿素a影响的区域是口门外最大浑浊带附近的表层水和浙闽沿岸的中层和底层水(图6)。主要受DO影响的站位集中在长江口外和断面D的表、中层和长江口外的底层水(图6f)。表层水体中DOC、a350、SUVA254、HIX、C1、C2和C3的箭头指向第二、三象限(长江口部分站位),且该象限的站位与其他站位分离,说明长江口附近的DOM受环境因素影响较大(图6d),BIX箭头指向的站位主要集中在长江口和浙闽沿岸附近,说明该区域受生物活动影响较大,S275-295箭头主要指向多为断面D,说明DOM分子量在该区域受到的影响较大。与表层水体类似,中底层水体中DOC、a350、SUVA254、HIX、BIX和CDOM荧光组分在长江口附近受到环境因素的影响较大(图6e和图6f),但中层水体中S275-295箭头主要指向的是长江口站位,底层水体中S275-295箭头指向的为长江口和断面D的部分站位,说明中底层和表层水体DOM分子量在不同区域受到的影响不同。
3 讨论
3.1 外源输入对长江口及邻近海域CDOM组成与分布的影响
在影响长江口及邻近海域CDOM的主要环境因素中,外源输入是其中最重要的因素之一。长江冲淡水是主要的陆源输入来源,而台湾暖流和黑潮次表层水则是主要的外海输入来源。长江口表层水体中DOC浓度和CDOM特征参数较高(p<0.05)(图3),DOM在表层水体中与盐度的相关性比中底层高(图8),主要是受到了长江冲淡水等河流输入的影响,在其他研究中(Guo et al, 2021; Yang et al, 2021)也被证实。指示陆源输入影响的CDOM特征参数,如SUVA254、HIX和陆源类腐殖质组分C3在长江口和浙闽沿岸附近较高(p<0.05)(图3和图5),与长江冲淡水、浙闽沿岸流和钱塘江、闽江等小支流的输入有很大关系,这与其他研究人员之前的研究结果(徐长栋, 2017; 郭卫东等, 2011)吻合。当夏季河流径流量增大之后,陆源输入强度也变大,与Yang等(2021)和Zheng等(2018)的研究一致。有研究表明,河流的DOC浓度、CDOM特征参数(a350指示)、SUVA254及HIX均高于河口区域,不同河口和近海区域,夏季的值均高于其他季节的,而S275-295则略小于其他季节的(表2)。人类活动较强的河口和近海区域,如珠江口(Liu et al, 2020),DOC浓度和CDOM腐殖化程度也比受影响较小的长江口和外海要高一些(表2)。国外一些河口,如亚马逊河口和墨西哥湾受到人类活动或沼泽侵蚀等影响较严重,DOC浓度、CDOM特征参数中的a350和SUVA254的值均较黄海和东海的高(Shank et al, 2011; Cao et al, 2016)。
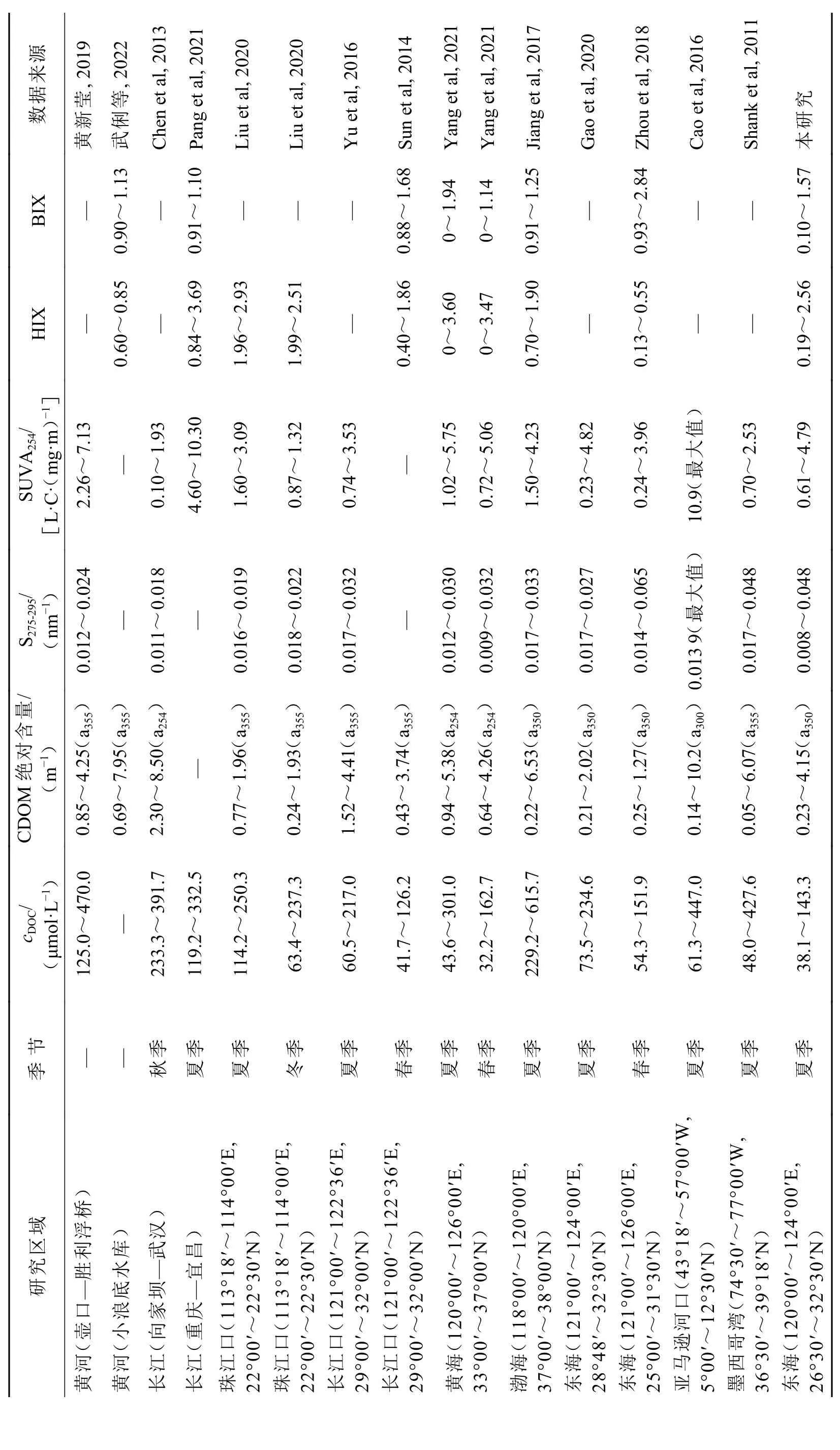
表2 典型河流、河口及近海海域DOC 与CDOM 各特征参数Table 2 The data of DOC and CDOM characteristic parameters in representative rivers, estuaries and offshore systems

图8 DOC浓度、CDOM各特征参数及CDOM荧光组成与盐度的相关性Fig. 8 The correlation of salinity with DOC concentration, CDOM characteristic parameters and CDOM fluorescent components
随着盐度的增大,DOC浓度和CDOM特征参数(如a350和SUVA254)偏离回归线的趋势越明显,说明在高盐度区域,DOM浓度的变化与盐度、淡水输入无关(图8)。这些区域主要受到台湾暖流和黑潮次表层水输入的影响。在台湾暖流和黑潮次表层水的影响下,东海南部DOC浓度和CDOM绝对含量较低(图9b和图9c),SUVA254和HIX等陆源指示代表的值也相对较低(图9e和图9f),S275-295的值相对较高(图9d),说明台湾暖流和黑潮次表层水主要携带小分子量的有机物,这与Zhou等(2018)的研究结果一致。
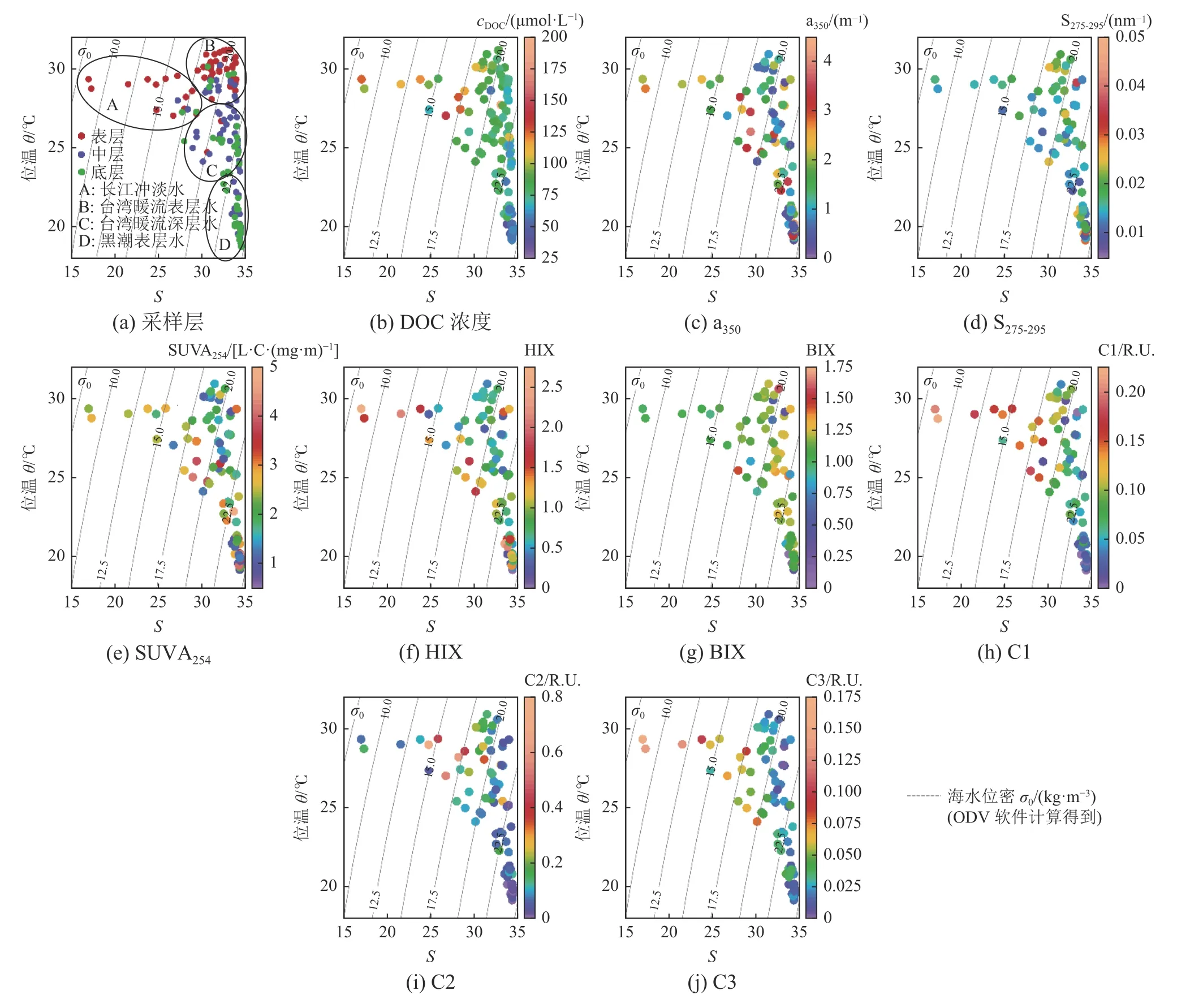
图9 长江口及邻近海域的位温-盐度与DOC、CDOM各参数及CDOM荧光组成的点聚图Fig. 9 Potential temperature-salinity diagram color-coded for DOC, CDOM parameters and CDOM fluorescent components
BIX在台湾暖流和黑潮次表层水的影响下相对较高(图9g),这可能是由于水团输入带来的营养物质导致了较高的生物活动(Gong et al, 2000; Zhang et al, 2007)。由于荧光组分C1和C3为类腐殖质组分,主要或部分来自陆源输入,受台湾暖流和黑潮次表层水影响的水团中其值很低(图9h和图9j)。C2是新鲜或相对活性的类蛋白组分,其部分高值可能与现场初级生产释放新鲜的有机物有关,也可能受到微生物活动的影响(Zheng et al, 2018),台湾暖流和黑潮次表层水的影响也较小(图9i)。
3.2 生物活动对长江口及邻近海域CDOM组成的影响
在表层水体中,类蛋白荧光组分C2呈现与类腐殖质组分C1和C3不同的变化特点,显示其来源和控制因素的不同。在中高盐度的一些站位(如A2、A1-3、A1、A2-4和A3),类蛋白组分C2的值较高,随着盐度的升高,C2强度逐渐降低(图8h),表明类蛋白组分的产生并不在盐度最高的外海。高C2站位的叶绿素a水平也较高,同时具有较低的AOU(图10e),说明这些类蛋白组分主要来自浮游植物初级生产(Pontiller et al, 2022)。在长江口最大浑浊带外,水体透明度的提高,加上陆源输入的高营养盐,初级生产力有明显的提高(Zhang et al, 2007),而这些生物活动会改变水体中DOM的组成。许多针对浮游植物的培养实验中都发现了类蛋白荧光组分的增加(Chen et al, 2020;Pontiller et al, 2022)。有研究表明,在阿拉伯海高生产力的富营养海区检测到明显的类蛋白荧光峰,而在贫营养的海区表层海水中则检测不到(Coble et al, 1998)。在中低盐度的一些站位(如A2-2、A2-3、A4-5和A5-4等),类蛋白组分C2的值较低,且随着盐度的升高没有明显变化(图8h)。这些站位由于靠近河口或近岸,类腐殖质组分C1和C3的值较高(图10a),个别站位(如A2-2和A4-5)的叶绿素a水平显著高于其他站位的(图10b)。高水平初级生产区域往往具有较强的微生物活动,一些类蛋白组分会被微生物分解消耗,进而产生类腐殖质组分(Yamashita et al, 2007; Gan et al, 2016)。例如,一项针对东海DOM生物可利用性的研究表明,藻类水华区的DOM样品在培养过程中类蛋白组分被微生物大量消耗,类腐殖质组分明显增加(Gan et al, 2016)。
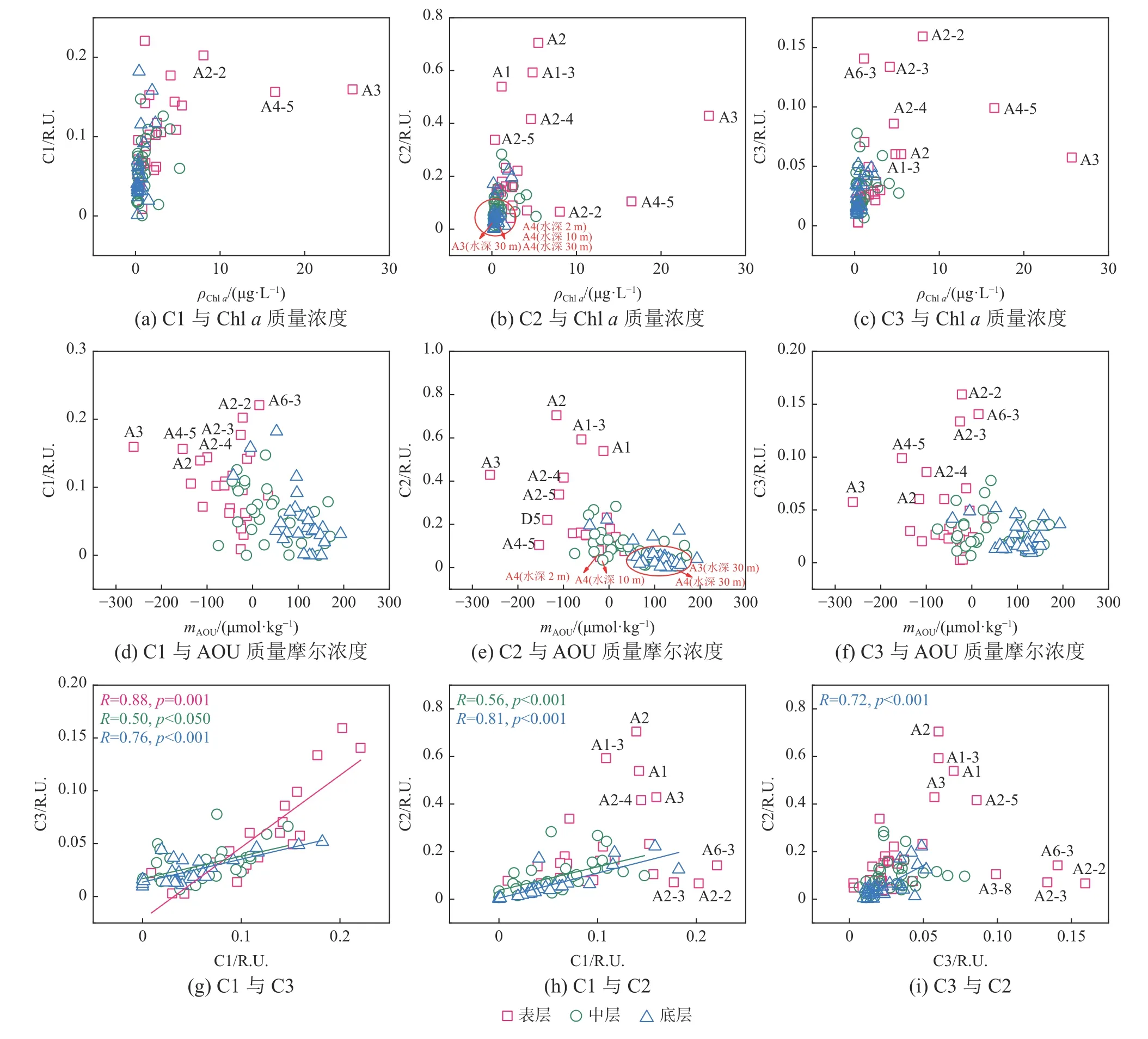
图10 CDOM荧光组分与叶绿素 a 和AOU的关系及荧光组分之间的关系Fig. 10 The relationships of CDOM fluorescent components with chlorophyll a and AOU,and the relationships among fluorescent components
C1和C3同为类腐殖质组分,但两者的来源和生物地球化学行为在长江口及邻近海域不完全相同。C1为自生源类腐殖质,包括海源和陆源,而C3主要是陆源。因此在表层水体中,两者具有显著的相关性(p<0.001);在中、底层,两者也有较强的相关性(p<0.05和p<0.001),但组分C3的含量要明显低于表层,也低于C1(图10g),显示在中、底层有更多的海源类腐殖质的产生。组分C2和组分C1和C3在表层均没有显著的相关性,C2的含量又远高于C1和C3,说明C2在表层有异于C1和C3的来源。在中、底层,C2和C1之间有较好的相关性,而与C3之间没有相关性,进一步说明C2和C1同为海源为主的有机物(图10h和图10i)。
本研究中,长江口及邻近海域CDOM特征参数中的BIX与HIX指数的水平变化趋势与之前在此区域获得的数据整体上是吻合的(图11)。HIX值<4表明CDOM主要来源于自生贡献,HIX>10时表明CDOM来自陆源输入(Huguet et al, 2009);BIX值<1表明CDOM自生贡献相对较低,BIX>1表明CDOM主要来源于自生贡献(Huguet et al, 2010)。与其他长江口内的样品相比,本研究的HIX数值较低且BIX较高,显示CDOM主要是自生源贡献,这与受长江输入和外海的影响强度大小变化有关,许多研究均有此结论(徐亚宏等, 2017; Zheng et al, 2018; 叶君等, 2019; Qiao et al, 2023)。夏季HIX和BIX均高于其他季节的数值,这与夏季径流量大,输入到东海的高腐殖化的CDOM较多以及夏季温度较高导致的生物活动较强有关(Zheng et al, 2018)。在个别站位的部分深度层次(见图11红色字体所标本研究站位),检测到了较低的BIX,同时观察到这些站位叶绿素a质量浓度和类蛋白组分C2均较低(图10b和图10e),S275-295的值相对较高,表明这些站位所在的区域可能存在更多的微生物降解活动,将大分子量的DOM转化为小分子量的。
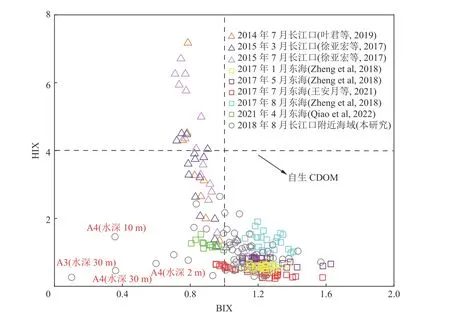
图11 9次东海区域内CDOM调查数据的BIX与HIX关系图及与文献数据的比较Fig. 11 Plots of BIX and HIX in the East China Sea and comparison with other studies in this area
4 结语
本研究对2018年8月长江口及邻近海域水体中有色溶解有机物(CDOM)进行了测定,并运用了紫外可见光吸收和三维荧光光谱法探讨了CDOM的来源、组成和分布及影响因素。研究表明,长江口及邻近海域CDOM的来源、组成和分布受到多种因素的影响,外源输入是其中最重要的因素之一。长江冲淡水是主要的陆源输入来源,台湾暖流和黑潮次表层水是主要的外海输入来源。夏季径流量增大、台湾暖流和黑潮次表层水输送强度增大,均会影响到该区域CDOM的组成和分布。除外源输入外,生物活动也是影响河口及邻近海域CDOM组成和分布的重要因素。除了浮游植物初级生产能够产生类蛋白CDOM之外,微生物活动还能将CDOM转化成类腐殖质成分。
该研究探讨的生物活动与外源输入所带入的高营养物质有关,还在有机物迁移转化、溶解氧亏损等方面发挥着重要作用。除人类活动影响外,CDOM的组成和分布变化受台湾暖流、黑潮次表层水输送和区域气候变动等共同影响,今后应从这一角度出发将人类活动与气候变化和近海碳循环联系起来。在河口低氧,甚至局部缺氧频发的态势下,将营养物质输入−上层水体初级生产−中低层微生物活动−有机物分解−底层低氧/缺氧形成耦合起来,对于深入认识区域生物地球化学过程和生态环境稳定性均具有重要意义。
