钠离子掺杂铋酸铜光阴极的制备及其光电催化性能的研究
2023-11-14王桂林汤桐鑫邹文昊叶凯航
王桂林,陈 芯,汤桐鑫,邹文昊,林 展,叶凯航
(广东工业大学 轻工化工学院 , 广东 广州 510006)
基于近年来日益增长的能源需求和环境保护挑战,利用光电化学(Photoelectrochemical, PEC) 催化技术将太阳能转化为清洁能源的方法受到了科学界极大的关注[1-2]。PEC是通过将光催化技术与电催化技术相结合,将半导体光催化剂制备成电极,并通过光的吸收激发光生电子和空穴进而在电解槽反应池内进行氧化和还原反应[3-4]。常见的PEC反应有分解水产氢、产氧反应和二氧化碳还原反应[5]。通过PEC技术生产清洁绿色燃料是一种很有前途的能源转换和储存策略[6]。
在PEC技术中,光电阴极主要为p型半导体,如CuO、Cu2O、CuBi2O4和WSe2等[7-10],因其成本低、理论光电流密度大等优势在光电阴极材料中得到了广泛的应用,但也存在吸光能力较差、电荷分离效率低与稳定性不足等问题[11]。其中,CuBi2O4是一种可见光响应的窄带隙p型半导体,因其具有合适的禁带宽度(1.5~1.8 eV)、良好的光稳定性、较高的内部光电压和优秀的光电流起始电位(+1 V vs.RHE)、较高的理论最大光电流密度(–19.7 mA·cm-2),在光电化学水分解中具有很大的潜力和应用价值,是未来理想的光电阴极材料之一[12-14]。然而,CuBi2O4的实际光电流密度与其最大理论光电流密度仍存在较大差距,这主要是由于所制备的CuBi2O4光阴极的吸光效率、电荷分离效率和催化效率较差[13,15]。因此,如何解决上述问题是提高CuBi2O4光阴极性能的主要研究方向[16]。
CuBi2O4光电阴极的主要合成方法有包括旋涂法[17]、水热法[18]、电沉积法[19]、滴铸法[20]、喷雾热解法[21]、脉冲激光沉积法[22-23]等。为了解决CuBi2O4光阴极较差的吸光效率、电荷分离效率和催化效率的问题,通常采用表面修饰[24]、空穴传输层[25-26]、掺杂[27]、构建异质结[28-29]、负载表面催化剂[30]、形貌控制[21,31]等方法。例如,Wang等[32]通过在喷涂过程中加入聚乙二醇,合成致密、均匀的薄膜,从而减少了光的散射、提高了光的利用率,增强了材料的吸光能力。Kang等[19]通过Ag+离子取代了Bi3+离子增加了CuBi2O4中的空穴浓度,从而提高电荷分离效率和光电性能。此外,Krol等[33]通过快速热处理 (Rapid Thermal Processing,RTP) 在CuBi2O4的表面引入了缺陷位点,有效地增强光电极的光电化学稳定性。另一方面,Song等[34]添加RuOx作为助催化剂防止光腐蚀,同时提高CuBi2O4催化效率和还原电位。缺陷工程在调节PEC水分解的金属氧化物半导体的电学、光学和催化性能方面受到了极大的关注,其中氧空位的调节可以改变CuBi2O4的载流子浓度,从而有效地促进电子-空穴对的分离[35]。相反,阳离子(金属) 空位充当电子受体,即产生空穴,增加了p型光电阴极的受主密度,导致光电流密度增强[36]。
用喷雾热解法和Na+掺杂合成了纳米多孔CuBi2O4光电阴极,并通过在可控气氛(氧气、空气) 中煅烧,调节了所制备光电阴极的表面缺陷。扫描电子显微镜(Scanning Electron Microscope, SEM)、X射线电子能谱(X-ray Photoelectron Spectroscopy, XPS)、X射线衍射(X-rays Diffraction, XRD) 的表征证实了CuBi2O4光电阴极的成功制备,紫外-可见吸收光(Ultraviolet-Visible Absorbance Spectroscopy, UV-Vis)分析表明,在氧气氛围下煅烧的Na+掺杂铋酸铜(Na-CuBi2O4-O2) 光电阴极具有–13.5 mA·cm–2的理论光电流密度。在含有H2O2的0.3 mol/L K2SO4+0.2 mol/L磷酸盐缓冲液中测试时,Na-CuBi2O4-O2光电阴极在0.6 V vs.RHE的偏压下实现了–2.81 mA·cm–2的光电流密度,远高于未处理的CuBi2O4光电阴极(–0.18 mA·cm-2) 与在空气气氛下煅烧的Na+掺杂铋酸铜(Na-CuBi2O4-Air) 光电阴极(–1.83 mA·cm-2)。时间分辨荧光光谱(Time Resolution Photoluminescence,TRPL) 与开尔文探针显微镜图(Kelvin Probe Force Microscopy, KPFM) 表明,Na-CuBi2O4-O2具有更高的载流子寿命与更高的表面光电压。结果表明,在可控气氛中氧气煅烧表面点缺陷工程和Na+掺杂是促进电荷传输和转移性能、提升光电阴极的PEC性能的快速和简便的方法。
1 实验部分
1.1 材料
掺氟氧化锡玻璃(Fluorine-doped Tin Oxide,FTO,方块电阻7 Ω,透光率≥80%,晶格)、三水合硝酸铜(II) (Cu(NO3)2·3H2O,99.99%,Aladdin)、五水合硝酸铋(III) (Bi(NO3)3·5H2O,98%,Alfa-Aesar)、无水乙酸钠(CH3COONa,≥99%,Sigma-Aldrich)、乙酸(CH3COOH,≥99.5%,大茂)、无水乙醇(CH3CH2OH,≥99.5%,大茂)、聚乙二醇(PEG,数均分子量为4 000,Sigma-Aldrich),所有分析级化学品均按原样使用,无需进一步提纯。
1.2 材料表征
X射线衍射仪(X-ray Diffraction, D8 ADVANCE,Bruker) 分析样品的晶型与结晶度。扫描电子显微镜(Scanning Electron Microscopy, Apreo2 Thermo Fisher Science) 分析样品的形貌和厚度。紫外-可见光-近红外分光光度计(UV-VIS-NIR, UV-2 450, Shimadzu) 记录样品的光学性质。X-射线光电子能谱(X-ray Photoelectron Spectroscopy, ESCALAb 250Xi, Thermo Scientific) 分析样品中现存元素的表面组成、导带和各种氧化态。紫外光电子能谱(Ultraviolet Photo-electron Spectroscopy, UPS) 分析样品的费米能级和价带位置。用电感耦合等离子体原子发射光谱仪(Inductively Coupled Plasma-Atomic Emission Spectrometry,Optima 830, Perkin Elmer) 判断样品中金属元素(Na,Bi,Cu) 的摩尔比。用荧光分光光度计测量了样品的光致发光光谱(Photoluminescence Spectroscopy,Finder Vista, Zolix) 和时间分辨瞬时光致发光光谱(Time-Resolved Transient Photoluminescence, Finder Vista, Zolix),激发波长为374 nm。
1.3 CuBi2O4光电阴极的制备
本文采用喷雾热解法制备CuBi2O4薄膜光电阴极[21]。并对实验方案进行了一定的优化,具体为:将五水合硝酸铋(40 mmol/L) 先溶解在5 mL乙酸,超声20 min得到透明溶液。然后,将三水合硝酸铜(20 mmol/L) 分散在上述溶液中,超声分散后加入45 mL无水乙醇。然后,加入聚乙二醇(500 mg) 作为结构导向剂,通过超声作用30 min使聚乙二醇分散在溶液中。最后,制备了浅蓝色的溶液,用于后续的喷雾热解工艺。FTO玻璃基板在丙酮、乙醇和超纯水中依次进行超声洗涤20 min,然后用高压氮气气流干燥。在开始沉积之前,将衬底放在加热板上并加热到预设温度400 ℃。喷嘴(优速达 UA-S120) 放置在加热板上方20 cm处,由60 kPa的空气超压驱动。一个喷雾循环由5次喷雾时间组成,然后延迟55 s,使溶剂完全挥发和剩余有机物热解。最后,利用马弗炉在空气中以3 ℃·min–1的升温速率在450 ℃下热处理5 min,得到了CuBi2O4-Air光电阴极。利用管式炉在氧气中以5℃·min–1的升温速率在450 ℃下热处理5 min,得到了CuBi2O4-O2光电阴极。
1.4 Na+掺杂CuBi2O4光电阴极的制备
制备CuBi2O4前驱体的方法为:将无水乙酸钠(20 mmol/L) 先溶解在5 mL乙酸中,超声20 min得到透明溶液。接着将上述2 mL透明溶液与3 mL的乙酸混合,将五水合硝酸铋(40 mmol/L) 先溶解在5 ml乙酸中,超声20min得到透明溶液。其余的步骤和实验参数与CuBi2O4光电阴极的制备工艺一致。
1.5 光电化学测量
光电化学测量采用上海辰华仪器CHI660E电化学工作站,工作电极为所制备的光电阴极,参比电极为Ag/AgCl(饱和KCl),对电极为铂丝对电极,在石英玻璃电解槽(透光率约为85%) 中使用氙灯(Microsolar 300,泊菲莱)与AM 1.5 G滤光片(AM1.5 G, 泊菲莱)作为照明源( 100 mW·cm–2),使用泊菲莱PFS40A快门进行斩光,快门每隔1 s启动一次,等待1 s,对每个数据点进行黑暗和光照测量。电解液为0.3 mol/L K2SO4与0.2 mol/L磷酸盐缓冲液(pH=6.65),加入H2O2作为电子清除剂,用雷磁PHS-2F型pH计检测pH值。通过线性扫描伏安法在暗、光和斩波条件下获得了光电流密度-电位(J-V) 曲线,扫描速率为10 mV·s–1。参考Ag/AgCl电极电势被转换为可逆氢电极标度,计算如下:
2 结果与讨论
本文使用的CuBi2O4光电阴极是通过喷雾热解法制备的,首先将Bi(NO3)3·5H2O溶解在乙酸中,然后将其与Cu(NO3)2·3H2O在乙醇中混合,得到了与CuBi2O4化学计量比相匹配、摩尔比为1:2的前驱体溶液进行喷雾热解。Cu2+和Bi3+离子、H2O、醋酸、乙醇的结合保证了喷雾热解过程中溶液的稳定性和解决了液滴的扩散行为。与此同时,在前驱体溶液中加入聚乙二醇(PEG) 可使薄膜的均匀性更高[21]。将前驱体溶液喷涂在氟掺杂氧化锡(FTO)导电玻璃表面,并最终退火后得到CuBi2O4光电阴极样品。由于CuBi2O4的光生载流子分离能力较差,本文主要通过在前驱体内引入醋酸钠对CuBi2O4进行Na+的掺杂,通过Na+提高CuBi2O4载流子的传输能力从而提升PEC性能。具体条件为:(1) 无Na+;(2) Na+有不同摩尔分数(1%,2%,4%,8%),其他条件与不加任何掺杂的CuBi2O4薄膜的制备一致。由于Na+的引入,样品具有更多的氧空位与更少的金属空位,这些缺陷会引起材料的费米钉扎效应[19],从而降低材料的光电压。因此对比在空气与氧气气氛下煅烧的效果,氧气氛围下煅烧可有效地减少氧空位的形成。如图1(a) 所示,X射线衍射图谱表明本文所制备的样品与先前的报道相似[39]。对比无Na+掺杂的CuBi2O4样品,Na-CuBi2O4-Air与Na-CuBi2O4-O2样品的(2 0 0) 晶面、(1 4 1) 晶面与(2 2 0)晶面的特征峰信号更强,这表明样品暴露的晶面与形貌可能随着Na+的掺杂发生了改变。通过对比各样品的扫描电子显微镜图(见图1(b)~(d) ),相较于CuBi2O4样品,Na-CuBi2O4-Air与Na-CuBi2O4-O2样品在不改变样品颜色的情况下呈现出纳米孔形态。粒子在融合和生长后形成多孔的蠕虫状形貌,这将降低光生载流子的传输距离从而提升其电荷分离能力。图1(e) 为Na-CuBi2O4-O2样品的SEM截面图,如图所示Na-CuBi2O4-O2薄膜的厚度约为283 nm,值得注意的是,Na-CuBi2O4表现出均匀的覆盖率,并与FTO衬底紧密接触,并且铜和铋元素在整个薄膜中均匀分布。这些结果证实了CuBi2O4样品的成功制备,并且Na+离子的掺杂可改变CuBi2O4的形貌[21]。
为了验证Na+掺杂对CuBi2O4光电阴极PEC性能的影响,模拟太阳光(AM 1.5 G,100 mW·cm–2) 对各C u B i2O4样品进行线性伏安(L i n e a r S w e e p Voltammetry Curve) 曲线的测试。用所制备的光电阴极(工作电极)、铂网电极(对电极) 和Ag/AgCl电极(参比电极) 建立PEC三电极电解池体系[40]。图2(a) 显示了空气煅烧下在含有H2O2电子清除剂的0.3 mol/L K2SO4+0.2 mol/L磷酸盐缓冲液(pH 6.65) 中不同Na+摩尔分数(1%,2%,4%,8%) 的Na-CuBi2O4-Air光电阴极的J-V曲线。其中Na+的摩尔分数从1%到4%时CuBi2O4的光电流密度是逐步升高的,在0.6 V vs.RHE时分别为–0.50 mA·cm–2、–0.82 mA·cm–2和–1.83 mA·cm–2,而将Na+的摩尔分数进一步提高到8%,光电流密度反而降为–0.22 mA·cm–2。结果表明4% Na-CuBi2O4-Air光电阴极的光电流密度高于其他分数的CuBi2O4光电阴极(见图2(a))。图2(b) 为各Na+掺杂CuBi2O4光电阴极在氧气氛围下退火后的JV曲线。如图所示,在氧气氛围退火后,各光电阴极表现出更高的光电流密度与更正的起始点位。具体地说,在1.0 V vs.RHE时,4% Na-CuBi2O4-O2为–0.48 mA·cm–2,是4% Na-CuBi2O4-Air (–0.31mA·cm–2) 的1.5倍。氧气煅烧后的CuBi2O4也是随着Na+的摩尔分数先逐步升高,0.6 V vs.RHE下分别为–1.13 mA·cm–2、–1.62 mA·cm–2、–2.83 mA·cm–2。随着Na+的摩尔分数提升到8%,氧气煅烧后也下降到–0.33 mA·cm–2,这与在空气氛围下退火的样品趋势保持一致。使用电感耦合等离子体测试(Inductively Coupled Plasma, ICP)确定4% Na-CuBi2O4-O2样品中Na+的实际摩尔分数,结果为7.82%。图2(c) 为性能最佳的CuBi2O4、Na-CuBi2O4-Air与Na-CuBi2O4-O2光电阴极J-V曲线图。如图2(c) 所示,在经过Na+掺杂与氧气氛围退火处理后Na-CuBi2O4-O2光电阴极具有较高的PEC性能(0.6 V vs.RHE, –2.83 mA·cm–2),约为未经处理的CuBi2O4光电阴极的15倍。因此,Na+掺杂和氧气煅烧是实现CuBi2O4光电阴极高效产氢的有效途径。

图2 (a) Na-CuBi2O4-Air的J-V曲线;(b) Na-CuBi2O4-O2的J-V曲线;(c) CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2的J-V曲线;(d)CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2 的LHE谱;(e) CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2 在 AM 1.5 G下的太阳辐照度光谱;(f) CuBi2O4-Air,Na-CuBi2O4-Air,Na-CuBi2O4-O2 的时间分辨的瞬态光致发光(TRPL) 光谱Fig.2 (a) J-V curves of Na-CuBi2O4-Air; (b) J-V curves of Na-CuBi2O4-O2; (c) J-V curves of CuBi2O4-Air, Na-CuBi2O4-Air, Na-CuBi2O4-O2; (d) LHE spectrum of CuBi2O4-Air, Na-CuBi2O4-Air, Na-CuBi2O4-O2; (e) Solar irradiance spectrum of CuBi2O4-Air, Na-CuBi2O4-Air, Na-CuBi2O4-O2 at AM 1.5 G; (f) Time-resolved transient photoluminescence (TRPL) spectra of CuBi2O4-Air, Na-CuBi2O4-Air,Na-CuBi2O4-O2
为了研究Na+掺杂和氧气煅烧提升CuBi2O4光电阴极性能的原因,首先对光电阴极的光学性质进行分析。光电阴极的光吸收性能决定了光生电荷的生产效率,是影响PEC性能的重要因素之一[35]。紫外吸收光谱(见图2(d) ) 显示了CuBi2O4-Air、Na-CuBi2O4-Air样品都在300~700 nm波段具有一定可见光吸收能力,而Na-CuBi2O4-O2光阴极具有更长的可见光吸收能力波段(300~800 nm),表现出了更加优秀的光吸收能力。另一方面,对比CuBi2O4-Air致密的平台状表面,Na-CuBi2O4-Air的多孔蠕虫状形貌更有利于光的吸收,因此Na-CuBi2O4-Air表现出比CuBi2O4-Air更高的光捕获效率。太阳辐照度光谱具体可表达为
式中:Iλ为太阳辐照度(W·m–2· nm–1),e为电荷量,h为普郎克常数,c为光速,A为吸光度(通过紫外可见漫反射光谱对光电极进行测量),且1–10–A为光电极在特定波长下的光捕获效率(Light Harvesting Efficiency, LHE)[41]。
如图2(e) 所示,Na-CuBi2O4-O2拥有最大的理论水分解光流密度,高达–13.5 mA·cm–2。
时间分辨光致发光(Time-Resolved Photoluminescence, TRPL) 光谱是一种研究光电极材料光生载流子机制的有效手段。图2(f) 为CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2光电阴极的TRPL光谱。从图中可以看出CuBi2O4-Air进行Na+掺杂后表面态俘获电子的寿命(t1) 显著降低(从1.07 μs降低到0.71 ns),这种明显的动力学加速表明界面电子转移速度更快。但是氧气煅烧后,由于激子弛豫过程更长,衰减寿命t2变长 (由煅烧前的4.75 ns延长到煅烧后的27.57 μs),意味着光生载流子有更多的机会参与光催化反应。CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2的平均载流子寿命(tave) 分别为11.50 μs、2.73 ns和18.62 μs[42]。 Na-CuBi2O4-O2较高的平均载流子寿命表明O2煅烧处理有利于延长光生电荷载流子的寿命,而Na+掺杂会降低[35]。
另一方面,Na+掺杂与O2煅烧处理也会改变CuBi2O4光电阴极的能带结构,因此对CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2样品进行了紫外光电子能谱(Ultraviolet Photoelectron Spectroscopy,UPS) 的测试,如图3(a) 所示。其中功函数被定义为真空能级和费米能级之间的差值,它可以由二次发射特征中的低动能截断来计算。紫外源(He-I放电) 的光子能量为21.21 eV[43]。假设CuBi2O4薄膜表面的费米能级是独立的,则CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2的二次电子的截止能量边(见图3(b)) 分别为16.43 eV、16.54 eV和16.66 eV。CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2的费米能级分别位于–4.78 eV、–4.67 eV和–4.55 eV,利用UPS谱价带光谱和XPS VB能谱(见图3(b)~(c)) 计算得到价带顶(Valance Band Maximum,VBM)的位置分别为–5.70 eV、–5.57 eV和–5.51 eV。基于图3(b)~(e),利用测量的费米能级、VBM和禁带宽度,构建CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2样品的能带结构图,如图3(f)所示。从图中可以看出CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2分别为–0.91 eV、–0.8 eV和–0.42 eV。虽然Na+掺杂和氧气煅烧使Na-CuBi2O4-O2的导带(Conduction Band, CB)向更正值移动,但它仍然比水还原电位(0 V vs.RHE) 更负。此外,Na-CuBi2O4-O2(1.22 eV) 的价带(Valence Band,VB)比CuBi2O4-Air (1.03 eV)、Na-CuBi2O4-Air (1.13 eV) 的还原电位更正。因此,Na-CuBi2O4-O2更接近水的氧化还原电位(1.23 eV vs.RHE)[44]。Na+掺杂和氧气煅烧对 CuBi2O4的能带结构具有显著影响。在改性后,Na-CuBi2O4-O2的带隙中出现缺陷能级进而减少禁带宽度,Na-CuBi2O4-O2的费米能级比其他样品更正[45],Na-CuBi2O4-O2具有更小的禁带宽度,可以有效分离电子-空穴对,从而展现出最高的PEC性能。图3(b)~(e)中Eg为禁带宽度,Evbm为价带顶所在的位置,Ecut-off为截止能量边;图3(e)中A为吸光度,h为普朗克常数,v为入射光子频率;图3(f)中Ef为费米能级。
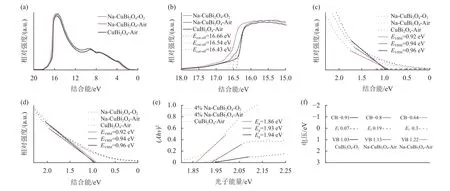
图3 (a)~(c) CuBi2O4-Air、Na-CuBi2O4-Air、 Na-CuBi2O4-O2的 UPS能谱;(d) CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2的XPS VB;(e) CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2的禁带宽度;(f) CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2的能带结构图Fig.3 (a)~(c) UPS spectra of CuBi2O4-Air,Na-CuBi2O4-Air,Na-CuBi2O4-O2; (d) XPS valence band of CuBi2O4-Air,Na-CuBi2O4-Air,Na-CuBi2O4-O2; (e) Band gap of CuBi2O4-Air,Na-CuBi2O4-Air,Na-CuBi2O4-O2; (f) Energy band structure of CuBi2O4-Air,Na-CuBi2O4-Air,Na-CuBi2O4-O2
通过XPS测定材料的化学成分和表面状态。图4(a) 中 Na 1s(1 071.25 eV) 的特征峰表明钠离子确实被引入到CuBi2O4中。图4(b) 显示了CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2光电阴极的Bi 4f的特征峰。Na+掺杂后,Na-CuBi2O4-Air中的Bi 4f峰向较高的结合能略有移动,表明Na+取代掺杂到Bi3+位点导致Bi氧化态增加,以补偿电荷不平衡[19]。而在氧气煅烧后,氧空位减少,Bi氧化态降低,结合能往低处移动。Cu 2p3/2(934.3 eV) 和 Cu 2p1/2(954.0 eV) 光谱显示了 CuBi2O4中 Cu2+的主峰[46]。掺杂Na+后,Cu的结合能都有轻微的负移(见图4 (c))。由于弱电负性元素(钠的电负性为0.93) 的掺杂,相邻晶格的 Cu 可以吸引 Na+的电子,氧空位增多[47]。在氧气煅烧后,Na-CuBi2O4-O2的Cu结合能增大,氧空位的缺陷减少。具体来说,O 1s 光谱分为2个组成部分,即与 Bi3+结合的晶格氧 (530.5 eV) 和与 Cu2+结合的晶格氧 (529.4 eV)。图4(d) 显示了CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2光电阴极的O 1s 特征峰。 具体来说,O 1s光谱分为2个组成部分,与 Bi3+结合的晶格氧 (530.8 eV附近) 和与 Cu2+结合的晶格氧 (529.48 eV)。当引入Na+离子时,Na-CuBi2O4-Air的氧空位峰(531.8 eV附近)) 明显增加,Na-CuBi2O4-Air成功引入了氧空位。在氧气煅烧后,Na-CuBi2O4-O2的氧空位峰面积从16.08%降低到10.47%,氧空位的缺陷减少[36,48]。铜空位增加了载流子(空穴) 的数量,并改变了二元金属氧化物的费米能级[48]。结果表明氧处理同时调节了铜空位缺陷位点、氧空位位点,从而改善了CuBi2O4光电阴极的电荷分离和输运性能。图4(e) 显示了CuBi2O4光电阴极的开路电压(Open Circuit Voltage, OCV) 测试结果,展现了Na+掺杂的CuBi2O4(Na+的摩尔分数分别为1%,2%,4%,8%) 相对于CuBi2O4-Air的OCV变化。OCV是黑暗中的开路电压(OCVdark) 和光照中的开路电压(OCVlight) 之差。功函数的改变方式为:当处于黑暗条件时,费米能级(Ef)远离导带底(Conduction Band Minimum, CBM),从而产生小的OCVdark,但当光照时,准费米能级(Efn) 变得尽可能接近CBM,从而产生大的OCVlight,这种变化可以使电极获得大的OCV[41]。OCV测试在0.3 mol/L K2SO4+ 0.2 mol/L磷酸盐缓冲液(pH=6.65) 下进行,测试时加入H2O2作为电子清除剂。从图4(e) 可以看到,掺杂Na+的CuBi2O4在氧气和空气中煅烧都获得了较高的开关光电压,其中Na-CuBi2O4-O2获得了最高的OCV (约0.11 V)。在其他条件相同的情况下,Na+掺杂的CuBi2O4和通过氧气煅烧后的OCV值明显高于CuBi2O4-Air (约0.04 V)。较高的OCV值意味着具有更有利的水氧化驱动力,因为它决定了半导体异质结的空穴准费米能级与电解液的氧化还原电位之间的差异。图4(f) 显示了Na-CuBi2O4-O2(无保护层和助催化剂层)在0.7 V vs.RHE的外加电位下的光电化学稳定性。Na-CuBi2O4-O2的稳定性测量时间为600 s(在含有H2O2的0.3 mol/L K2SO4+0.2 mol/L磷酸盐缓冲液中进行)。600 s后 Na-CuBi2O4-O2的光电流未发生明显下降,说明Na-CuBi2O4-O2是稳定性很好的光阴极材料[33,49]。

图4 (a)~(d) CuBi2O4-Air、Na-CuBi2O4-Air、Na-CuBi2O4-O2 的XPS;(e) Na-CuBi2O4-O2 的光电压;(f) Na-CuBi2O4-O2在0.7 V vs.RHE下的稳定性测试Fig.4 (a)~(d) XPS of CuBi2O4-Air,Na-CuBi2O4-Air,Na-CuBi2O4-O2; (e) Photovoltage of Na-CuBi2O4-O2; (f) Stability testing of Na-CuBi2O4-O2 at 0.7 V vs.RHE
为了进一步证实CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2光电压增长的现象,使用KPFM测试黑暗和光照下的接触电位差(Contact Potential Difference, CPD) 来评估薄膜的表面光电压(Surface Photovoltage, SPV) 和观察电荷的空间分布[50-51]。KPFM测量采用450 ~ 1 000 nm的激光波长进行,并使用曲率半径为20 nm的掺杂金刚石涂层Si尖端。黑暗和光照下的KPFM图像和相应的表面光电压(SPV)差[52]如图5(a)~(b) 所示。由于电荷载流子的快速复合,在CuBi2O4-Air中没有明显的SPV信号。而在Na-CuBi2O4-Air和Na-CuBi2O4-O2中有明显的负SPV信号(见图5(c)~(f) ),负SPV意味着电子移动到薄膜的表面,空穴向相反的方向移动。Na-CuBi2O4-Air的正负电位差约为–40 mV,Na-CuBi2O4-O2的正负电位差约为–130 mV,明显高于CuBi2O4-Air (10 mV),并且Na-CuBi2O4-O2大约是Na-CuBi2O4-Air的3.25倍。这意味着Na-CuBi2O4-O2中形成了更强的内置电场,光载流子的分离速率得到了提高,更多的电子传输至薄膜表面进行积累。CuBi2O4-Air、Na-CuBi2O4-Air和Na-CuBi2O4-O2样品之间SPV信号的显著差异有力地证实了Na+掺杂和氧气煅烧有助于促进电荷分离,抑制电荷复合。

图5 (a)~(b) 黑暗和光照下CuBi2O4-Air的KPFM;(c)~(d) 黑暗和光照下Na-CuBi2O4-Air的KPFM;(e)~(f) 黑暗和光照下Na-CuBi2O4-O2的KPFMFig.5 (a)~(b) KPFM of CuBi2O4-Air in dark and light; (c)~(d) KPFM of Na-CuBi2O4-Air in dark and light; (e)~(f) KPFM of Na-CuBi2O4-O2 in dark and light
3 结论
本文主要介绍了一种在氧气氛围下退火的Na+掺杂的均匀多孔纳米CuBi2O4光电阴极。通过XPS证明了Na+离子取代了Bi3+离子,增加了空穴浓度,从而有效改善了光生载流子传输。与此同时,在氧气气氛下退火可有效减少Na+掺杂引起的氧空位,这对PEC性能起到进一步促进作用。最终在0.6 V vs.RHE的偏压下获得–2.83 mA·cm-2的光电流密度,是未经处理的CuBi2O4的15倍。对PEC性能增强的分析中,首先通过SEM发现经过Na+掺杂后,样品具有多孔镂空的纳米结构,该结构不仅能进一步增加光吸收,同时能降低光生载流子传输距离,从而提升PEC性能。其次,TRPL分析结果表明Na+离子的掺杂可有效提升电子的转移速度,而在氧气气氛下煅烧则可提升光生载流子的寿命。通过OCV测试与KPFM表征发现Na+离子掺杂与氧气氛围下煅烧所制备的CuBi2O4具有更大的光电压,这同样也是PEC性能提升的主要因素之一。综上所述,Na+掺杂和氧气煅烧是一种获得较少表面缺陷的光电阴极的有效手段,能增强光生电荷分离能力与光电压,这为未来的光电阴极设计提供了新的思路与有效案例。
