甲基转移酶样3抑制剂STM2457通过调节线粒体功能改善代谢相关脂肪性肝病
2023-11-14高毅男王培君逯素梅马万山
高毅男,王培君,逯素梅,马万山
山东第一医科大学第一附属医院(山东省千佛山医院)检验科//山东省医药卫生临床检验诊断学重点实验室,山东 济南250014
代谢相关脂肪性肝病(MAFLD)是肝细胞脂肪变性、脂毒性和慢性炎症的恶性循环,在肝脏脂代谢紊乱中发挥重要作用,也是多种代谢综合征共同的病理基础,导致肝脏的生物功能逐渐下降。线粒体功能障碍和炎症风暴是肝脏脂质超载的主要后果,诱发MAFLD、胰岛素抵抗(IR)以及继发的肝纤维化等[1]。能量摄入和消耗之间的不平衡导致各种组织中的IR和肠道微生态的改变,导致肝脏中的脂肪堆积,细胞内损伤以及肝IR进一步加剧炎症、纤维化和癌变[2]。因此,围绕MAFLD的发病机制开展研究工作意义重大。
作为真核细胞RNA最重要的化学修饰,6-甲基腺嘌呤(m6A)甲基化修饰可以调节肝脏甘油三酯(TG)的代谢[3]。人甲基化转移酶3(METTL3)在m6A修饰中发挥存储器“writer”功能[4],介导mRNA 的甲基化[5]。METTL3调节脂质代谢[6],影响肝脏游离脂肪酸的摄取和炎症的发展[7],介导肝纤维化[8],促进脂肪的生成以及MAFLD的发展[9]。有关METTL3的研究虽然较为广泛,但是距离其临床应用还需要更多工作去探索。STM2457 作为一种高效、特异且生物可利用的METTL3特异性小分子催化抑制剂[10],其在白血病、肿瘤等方面研究已有少量报道[11-14],但是未见STM2457在肝脏脂代谢,尤其是MAFLD发生发展中的作用。作为全球范围内大流行的重要代谢性疾病,迫切需要开展进一步工作探究STM2457对MAFLD发生发展的影响。
本研究采用人肝癌细胞株HepG2、C57BL/6J小鼠的脂肪变性模型,利用油红O染色、Dot-blot、Real Time PCR、腹腔注射葡萄糖耐量试验(IPGTT)、腹腔注射胰岛素耐量试验(IPITT)、肝匀浆TG检测、HE染色、透射电镜分析、JC-1 线粒体膜电位荧光探针等技术,探究STM2457在改善高脂饮食诱导的MAFLD中的作用及机制。
1 材料和方法
1.1 材料
1.1.1 实验动物 健康SPF级别雄性C57BL/6J小鼠15只,6~8周龄,购自北京维通利华实验动物技术有限公司,动物许可证号SCXK(京)2021-0006。动物实验经过山东第一医科大学第一附属医院(山东省千佛山医院)实验动物伦理审查[2021(S410)号],实验过程严格按照动物伦理要求开展。
1.1.2 主要仪器与试剂 人肝癌细胞株HepG2购自美国典型培养物保藏中心(ATCC,马纳萨斯,弗吉尼亚州,美国);10%脂肪基础饲料、60%脂肪高脂饲料(北京科奥协力生物技术有限公司);STM2457 药物(Selleck Chem);组织细胞固定液、苏木素伊红染色试剂盒、线粒体膜电位检测试剂盒(碧云天生物技术研究所);Trizol试剂(ABI Ambion);TBST缓冲液(10×)、超敏化学发光底物检测试剂盒(陕西中晖赫彩生物医药科技有限公司);m6A抗体(Synaptic Systems);Hybond-N薄膜(GE Healthcare Systems);TG试盒(南京建成生物工程研究所);DMEM培养基、磷酸缓冲盐溶液、新生牛血清、胎牛血清、0.25%胰蛋白酶-EDTA、100×青霉素-链霉素双抗悬液、谷氨酰胺(Thermo Fisher Scientific);辣根过氧化物酶标记山羊抗兔二抗、抗体稀释液(北京中杉金桥生物技术有限公司)。
1.2 方法
1.2.1 体外肝细胞脂肪变模型的建立及鉴定 将人肝癌细胞株HepG2培养于含10%胎牛血清的DMEM培养基中,培养条件为37 ℃、5%CO2的培养箱,细胞密度达到90%左右时,加入0.25%胰蛋白酶-EDTA进行消化离心,按照合适的密度接种细胞于培养基质中,当细胞密度至60%~70%融合时,将其分为两组,对照组和实验组,其中实验组为油酸钠/棕榈酸钠(500 μmol/L/250 μmol/L)作用48 h的诱导脂肪变组;对照组为对应的诱导分化对照液。通过形态学观察和油红O染色观察肝细胞中脂滴生成情况。期间24 h更换1次诱导液,诱导脂肪变性48 h时终止。
1.2.2 高脂饮食诱导小鼠MAFLD模型的建立及鉴定将6~8周龄C57BL/6J雄性小鼠饲养于SPF级别动物房中,置于微型隔离笼,自由饮用过滤水和食物,进行12 h/12 h的明暗循环,适应性饲养1周。1周后进行分组,分为基础饲料饲养组(CD 组)和高脂饲料饲养组(HFD组),借助Research Diet 公司的基础饲料(货号D12450B)和高脂饲料(货号D12492),饲养16周,期间每周称量小鼠体质量,待组间小鼠体质量差值大于30%时,视为MAFLD模型制备初步成功。进一步通过肝组织切片HE染色、肝形态学观察、IPGTT和IPITT实验等,鉴定MAFLD模型制备成功。
在MAFLD模型构建成功后,STM2457组小鼠给予腹腔注射METTL3抑制剂STM2457(50 mg/kg,qd),持续注射14 d,期间每天监测小鼠体质量变化,14 d后进行相应的取材,分别进行肝匀浆TG含量、石蜡切片HE染色、小鼠血清ALT含量、小鼠血清AST含量检测。
1.2.3 斑点杂交实验(Dot-blot)将提取的总RNA分别稀释至200、100、50 ng/μL,RNA变性后,将各浓度待测样本滴在Hybond-N薄膜上,紫外线交联2次(1200J,30 s),膜1放入亚甲蓝溶液,拍照即为蓝色内参对照。膜2封闭后,在兔源m6A一抗(1∶1000)中孵育过夜,再经过HRP标记的羊抗兔二抗(1∶1000)孵育后,使用超敏ECL化学发光液孵育,放入FLUOR CHEM凝胶成像分析系统进行曝光。
1.2.4 反转录和实时荧光定量PCR(Real-Time PCR)实验 按照实验室常规操作流程进行反转录和PCR,主要包括去除基因组DNA、反转录反应体系配制、PCR扩增等。
将对应样本代表其荧光信号强度的阈值循环数的CT值减去内部参比基因β-actin的CT值,得到ΔCT,将目标样本的ΔCT值和对照组ΔCT值作差,得到△△Ct,以对照组相对表达量为1,根据公式“2-ΔΔCT”方法计算出目标样本的基因相对表达量。所有的实验均重复3次。
小鼠引物序列:
1.2.5 小鼠代谢笼实验 保证水源充足的情况下,将小鼠置于小动物代谢笼内监测新陈代谢情况,CD组使用基础饲料喂养,HFD组使用高脂饲料喂养,STM2457组给予14 d腹腔注射(50 mg/kg)使用高脂饲料喂养,对小鼠呼吸情况进行48 h动态检测,包括耗氧量、二氧化碳产生量,通过间接测热法计算产热量,通过耗氧量与二氧化碳产生量比值计算呼吸熵(RQ)。
1.2.6 腹腔胰岛素耐量实验(IPITT)提前1周对小鼠进行掐尾适应训练,避免小鼠应激,造成血糖异常升高。一周后禁食6 h,对每组每只小鼠称重,尾尖取血去掉第1滴,测小鼠的基础血糖水平。以0.65 U/kg小鼠体质量计算胰岛素注射量,配制胰岛素稀释后注射液,腹腔注射。使用便携式血糖仪测其0、15、30、60、90、120 min后的血糖水平,绘制折线图观察不同组间曲线变化趋势。
1.2.7 腹腔葡萄糖耐量实验(IPGTT)实验前1周对小鼠进行掐尾适应训练,避免出现应激性高血糖。实验小鼠禁食禁水12 h后,对每组每只小鼠称重,尾尖取血去掉第1滴,测基础血糖水平。按照2.0 g/kg小鼠体质量计算葡萄糖注射量,向其腹腔分别注射葡萄糖稀释液,使用便携式血糖仪测其0、15、30、60、90、120 min后血糖水平,绘制折线图观察不同组间曲线变化趋势。
1.2.8 HE染色 按照实验室常规免疫组织化学染色流程进行HE染色,主要包括组织固定、石蜡包埋、石蜡切片等,然后进行脱蜡、梯度酒精处理、苏木精染色、1%盐酸酒精溶液分化、稀氨水返蓝、伊红复染、梯度酒精脱水、二甲苯透明、中性树胶封固等流程。
1.2.9 血清学肝功能指标检测 将眼球取血采集的小鼠血液标本于冰上静置,3000 r/min离心15min,将上层血清分离到新的容器中,使用德国罗氏Cobas c701机器检测血清中谷丙转氨酶(ALT)和谷草转氨酶(AST)含量。
1.2.10 肝脏组织匀浆检测TG 剪取称量50 mg肝组织于1.5 mL无酶EP管中,再加入450 μL的生理盐水,使用TIANGEN手持电动组织研磨仪,将肝组织充分研磨,制备肝匀浆样本,通过南京建成生物工程研究所TG测定试剂盒(GPO-PAP法),于96孔板中加样,37 ℃孵育10 min,酶标仪测定各孔吸光度值A510nm。
1.2.11 透射电镜(TEM)检测 取材1 mm×1 mm×2 mm大小的小鼠肝组织,保存于5%戊二醛电镜固定液中,送往山东微亚生物科技有限公司进行透射电镜样本处理和检测。先置于15 000×下观察组间线粒体超微结构差异,选取视野置于30 000×下进行进一步观察和拍照记录。
1.2.12 线粒体膜电位荧光探针(JC-1)检测 通过JC-1(200×)染液配制JC-1(1×)工作液,经过37 ℃、5%CO2细胞培养箱孵育,PBS缓冲液洗涤染液后加入少量的培养基,借助荧光显微镜观察组间细胞荧光着色情况,对比观察细胞膜电位变化。同时基于Image J软件进行半定量分析,计算红绿荧光强度比值表示膜电位变化。
1.3 统计学方法
计量资料以均数±标准差表示,采用SPSS 22.0软件进行统计学分析,利用Microsoft Office LTSC Excel 2021建立数据库,两组之间的差异比较借助t检验,3组及以上差异比较借助方差分析,进一步的两两比较采用q检验。P<0.05时认为差异有统计学意义。
2 结果
2.1 肝细胞脂肪变模型和小鼠MAFLD模型构建成功
在人肝癌细胞株HepG2细胞脂肪变模型中,与对照组相比较,油酸钠/棕榈酸钠(500 μmol/L与250 μmol/L)处理48 h后,可见肝细胞中充满“戒环”样脂滴,油红O染色可见脂肪变模型组(FFA)有明显的橘红色脂滴沉积,而对照组无脂滴沉积(图1A)。在小鼠MAFLD模型中,与CD组小鼠比较,HFD组小鼠在60%高脂饲料饲养16周后体质量(图1B)和体型(图1C)明显增加,差异显著。

图1 肝细胞脂肪变模型和MAFLD模型的构建和鉴定Fig.1 Construction and characterization of hepatocyte steatosis model and MAFLD model(n=5,Mean±SD).A:MAFLD modeling of HepG2 cells verified by oil red o staining.B:MAFLD modeling in mice by weight change.C:MAFLD modeling in mice by body size change.D:The level of m6A modification in liver tissue was verified by Dot-blot.E:Liver tissue Mettl3 was verified by real-time PCR.
通过Dot-blot实验证实,与CD组比较,HFD组小鼠肝组织中m6A 修饰水平明显升高(图1D)。Real Time PCR实验证实Mettl3在MAFLD肝组织中的表达水平明显升高(P<0.05,图1E)。
2.2 腹腔注射STM2457显著改善高脂饮食诱导的胰岛素抵抗
与HFD组小鼠对比,STM2457(50 mg/kg,1次/d)注射14 d后小鼠体质量显著降低(P<0.05,图2A);且STM2457(50 mg/kg,1次/d)作用14 d后,高脂饮食诱导下的肝组织m6A修饰水平显著下调(图2B)。

图2 腹腔注射STM2457显著改善高脂饮食诱导的胰岛素抵抗Fig.2 Intraperitoneal injection of STM2457 significantly improves high-fat diet-induced insulin resistance (n=5,Mean±SD).A:Body weight change in mice;*P<0.05 vs HFD group,△P<0.05 vs STM2457 group(day1).B:The level of m6A modification in liver tissue was verified by dot-blot hybridization.C: Blood glucose concentration in the mouse insulin tolerance test.D:Blood glucose concentration in the mouse glucose tolerance test.
IPGTT和IPITT实验结果证实,与HFD组小鼠相比较,STM2457组小鼠IR程度有所改善,表现为胰岛素敏感性(图2C)和糖耐量(图2D)显著增加。
2.3 腹腔注射STM2457显著改善高脂饮食诱导的肝脂肪变
持续14 d的腹腔注射STM2457后,对各组小鼠进行相应的取材。HFD组小鼠的肝脏发生弥漫性肿大,表面呈现颗粒感,边界发黄,STM2457组小鼠的肝脏颜色呈鲜红色,无弥漫性肿大,颗粒感减弱,趋向于CD组小鼠的肝脏形态(图3A)。肝组织匀浆检测组间TG含量,发现HFD 组小鼠的TG 显著升高(P<0.05),而在STM2457作用下,肝组织中的TG含量明显下降(P<0.05,图3B)。肝脏组织石蜡切片HE染色发现STM2457组的肝脂滴大小和数量明显少于HFD组,脂滴堆积减少(图3C);HFD组小鼠血清中ALT、AST含量显著高于CD组小鼠(P<0.05);而在STM2457的作用下,ALT和AST均下调,其中ALT差异显著(P<0.05,图3D、E)。

图3 腹腔注射STM2457显著改善高脂饮食诱导的肝脂肪变Fig.3 Intraperitoneal injection of STM2457 significantly improves high-fat diet-induced hepatic steatosis(n=5,Mean±SD).A:Liver tissue of the mice.B:Hepatic homogenate triglyceride assay in mouse liver tissue (day 14).C: HE staining of paraffin sections of mouse liver tissue.D:Serum ALT levels in mice(day 14).E:SerumAST levels in mice(day 14).
2.4 腹腔注射STM2457增强了高脂饮食诱导的小鼠脂代谢
小鼠代谢笼实验中,单位体质量单位时间耗氧量可见图4A,间接测热法计算产热量可见图4B,单位体质量单位时间二氧化碳产生量可见图4C。通过单位时间内耗氧量与二氧化碳产生量比值计算RQ。结果发现,CD组RQ 为0.865±0.013,HFD 组RQ 为0.767±0.011,而STM2457组RQ为0.738±0.008,方差分析及进一步的q检验发现CD组与HFD组、HFD组与STM2457组之间均具有明显的统计学差异(P<0.05,图4D)。
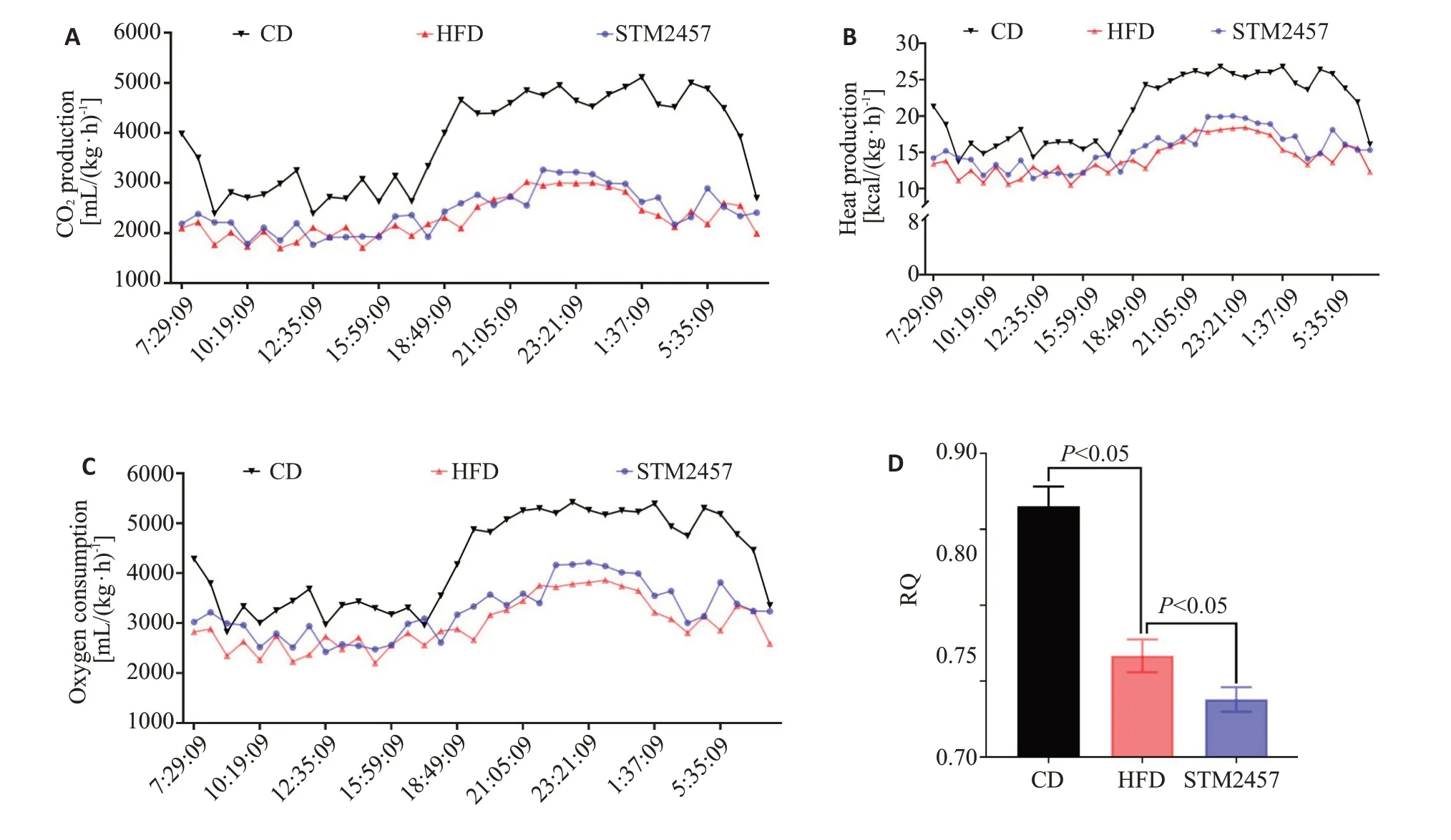
图4 腹腔注射STM2457增强了高脂饮食诱导小鼠的脂代谢Fig.4 Intraperitoneal injection of STM2457 enhances lipid metabolism in high-fat diet-induced mice(n=5,Mean±SD).A:Oxygen consumption per unit body weight per unit time in metabolic cage experiments in mice.B: Heat production per unit body weight per unit time in metabolic cages in mice.C: CO2 production per unit body weight per unit time in metabolic cages in mice.D: Oxygen consumption to CO2 production ratio(RQ).
2.5 腹腔注射STM2457显著改善高脂饮食诱导的线粒体损伤
小鼠肝组织透射电镜分析见CD组中线粒体形态正常,呈短棒状或圆球状,而HFD组中线粒体肿胀,形态呈现出马蹄状,体积增大,偶见巨大线粒体,线粒体膜完整性受损,嵴变小或消失。而在STM2457作用下,线粒体大小、形态恢复正常,不规则形态消失,线粒体的嵴变得清晰可见(图5A)。

图5 腹腔注射STM2457显著改善高脂饮食诱导的线粒体损伤Fig.5 Intraperitoneal injection of STM2457 significantly ameliorates mitochondrial damage induced by high-fat diet(n=5,Mean±SD).A:Transmission electron microscopy of mouse liver tissue.B:Detection of mitochondrial membrane potential in HepG2 cells.C:Mitochondrial membrane potential fluorescence semi-quantitative analysis.
进一步以人肝癌细胞株HepG2为材料进行线粒体膜电位JC-1检测(图5B),发现在对照组(Ctrl)中,存在大量红色荧光,提示细胞膜电位高;经油酸钠/棕榈酸钠(500 μmol/L与250 μmol/L)作用48 h后,红色荧光强度低,绿色荧光增强,提示膜电位显著降低,线粒体功能受损;而在STM2457作用下,红色荧光强度升高,绿色荧光降低,线粒体膜电位恢复。随机在每组取5个视野,对JC-1线粒体膜电位荧光(红色/绿色)进行半定量分析(图5C),结果发现与Ctrl组比较,FFA组的线粒体膜电位出现了显著降低(P<0.05),而STM2457作用下,线粒体膜电位显著升高(P<0.05)。
3 讨论
MAFLD指与全身代谢失调相关的脂肪肝疾病[15,16],已在全球范围内大流行,患病率达33.0%(95%CI:29.7~36.5),尤其以亚洲人群患病率升高显著[17,18]。MAFLD的特点是肝脏脂质积累、脂毒性、胰岛素抵抗、能量代谢功能障碍和炎症[13],IR 和2 型糖尿病等是MAFLD最常见的并发症,严重危害国民健康[19]。
METTL3在MAFLD中的功能已经被广泛报道[20,21]有研究发现,与健康对照相比,MAFLD中METTL3表达增加[22]。METTL3 的缺失可改善饮食诱导的MAFLD和肥胖的发展,及其炎症和代谢[23],喂食HFD的小鼠中METTL3的肝细胞特异性敲除改善了胰岛素敏感性并减少了脂肪酸合成,METTL3沉默降低了脂肪酸合酶的m6A甲基化和总mRNA水平,从而抑制了脂肪酸代谢[24]。本研究借助高脂饲料诱导建立MAFLD小鼠模型,证实MAFLD肝组织中m6A RNA甲基化修饰水平升高,METTL3转录水平上调,与已有的文献报道一致。但是距离METTL3应用于MAFLD的临床治疗仍需要更多探索。
STM2457是一种高效、选择性的METTL3 催化抑制剂,IC50为16.9 nmol/L,对METTL3 具有高度特异性,对其他RNA 甲基转移酶没有抑制作用。早期有研究证实,STM2457在急性髓细胞白血病能够通过特异性靶向急性髓细胞白血病的关键干细胞亚群,抑制急性髓细胞白血病细胞增殖,诱导细胞分化和凋亡[13]。也有学者证实了STM2457在抑制实体肿瘤生长中的作用,主要包括肺癌、肝癌、髓母细胞瘤等[11,12,14]。
随后STM2457在抑制高脂肪饮食的m6A甲基化修饰方面的作用也被证实,Sun等[25]发现在高脂肪饮食诱发男性生殖功能障碍中,STM2457能够显著下调氧化应激介导的m6A甲基化修饰。本研究借助高脂饮食诱导MAFLD模型,采用Dot-blot法检测小鼠肝组织的m6A 修饰水平,结果发现在HFD 组m6A 修饰升高,STM2457处理后m6A修饰水平下降,说明STM2457有效的抑制了高脂饮食诱导的肝组织m6A甲基化,与已有文献一致。
有关METTL3在肝脏脂代谢方面的调控作用近年来持续升温。Shu等的研究发现,METTL3通过METTL3/MALAT1/PTBP1/USP8/TAK1 调节轴,促进细胞焦亡和巨噬细胞M1 型极化,进而促进肝纤维化[26]。METTL3在M1巨噬细胞中的表达水平显著升高,肝癌来源生长因子特异性缺乏减轻了M1巨噬细胞中的炎症、糖酵解和脂质积累,挽救了线粒体功能障碍[27]。研究证实,METTL3通过METTL3-m6A-Rubicon 调节轴抑制非酒精性脂肪性肝病自噬,敲低METTL3可促进肝脏自噬流量和脂滴清除,而过表达METTL3则可抑制这些过程[6]。同时,m6A修饰异常在脂肪形成、非酒精性脂肪性肝病和肝癌的发生发展中的作用也得到了充分的研究。靶向METTL3/14 显著增加甘油三酯、胆固醇、脂滴的积聚,其机制与通过m6A修饰调控ACLY 和SCD1 表达有关[9]。上述研究均有力证明了METTL3作为MAFLD临床靶点的潜在价值,但是鲜见METTL3抑制剂的临床研究。本课题通过高脂饮食诱导建立MAFLD模型,腹腔注射STM2457,发现STM2457能够显著改善高脂饮食诱导的肝细胞脂肪变和胰岛素抵抗,并证实STM2457作用下肝脏脂代谢利用增加,丰富了METTL3在调控肝脏脂代谢方面的作用。
RQ是一种用于测定"燃料结构"的方法。碳水化合物、脂肪和蛋白质作为供能物质时燃烧所消耗的氧气各不相同,呼吸熵可以测定呼出二氧化碳体积与消耗氧气体积的比值,进而提示主要的供能物质,机体以消耗葡萄糖为主要代谢底物时,葡萄糖代谢后消耗的氧气和产生二氧化碳等量,而当机体以消耗脂质为主要代谢底物时,会消耗更多的氧气产生更少的二氧化碳。有研究指出RQ的波动范围在0.7~1.0,在混合饮食情况下为0.85左右[28]。本研究发现,与CD组比较,HFD组的糖代谢占比下降,脂代谢占比升高,RQ降低,推测与高脂饮食诱导出现的IR有关。给予STM2457处理后,RQ更低,提示小鼠的脂代谢相对增强,证明其在IR缓解的情况下对脂肪的利用比例要比HFD组小鼠更高。我们推测,这可能是通过增加肝脏对脂质的氧化利用来实现的。有文献报道,脂质在肝脏内的代谢主要是通过线粒体内β氧化及其他氧化途径,增强肝细胞介导脂肪酸β氧化能力,最大限度地减少脂质积累,从而减少肝细胞损伤和纤维化[29]。上述推测提示在STM2457抑制Mettl3活性时,STM2457可能通过改善线粒体功能,增加肝脏线粒体脂肪酸β氧化能力,消耗蓄积的脂质,脂质供能增加,导致脂代谢进一步增强。
为了验证上述推测,我们借助透射电镜和线粒体膜电位分析检测了高脂饮食诱导下线粒体功能的改变。线粒体膜电位的破坏是线粒体功能障碍的主要体征,膜电位缺失会导致线粒体电子传递链缺陷、代谢耗氧量降低、ATP 耗竭和低能量代谢[30]。线粒体的嵴是渗透到基质中并容纳组装的呼吸复合物的内陷,是能量代谢的明显指征[31]。我们发现高脂饮食诱导明显的线粒体肿胀、线粒体的嵴减少或者消失、出现马蹄状线粒体或者巨大线粒体等,线粒体膜电位下降,提示线粒体功能损伤显著,与已有研究一致[32]。进一步发现STM2457作用下,线粒体肿胀消失、形态恢复正常、线粒体膜电位升高和嵴增多,提示线粒体损伤明显得到改善。本研究分别从形态和功能上证明了STM2457在改善高脂诱导下线粒体功能的作用,有力验证了上述推测。
综上所述,本研究成功将MAFLD与m6A修饰联系起来,创新性的揭示了METTL3 特异性抑制剂STM2457通过改善高脂饮食诱导的线粒体功能,进而减缓MAFLD发病进程的作用及机制,为METTL3应用于MAFLD的临床治疗奠定了基础,提供了新的思路。