阿来替尼联合吉西他滨治疗肺腺癌临床研究*
2023-11-14兰英美郑明琳何璐璐金朝辉
兰英美,樊 萍,郑明琳,郭 毅,何璐璐,黄 海,2,金朝辉△
(1.四川大学华西医院,四川 成都 610041; 2.四川大学生物治疗国家重点实验室,四川 成都 610041)
肺腺癌为临床较常见的肺癌亚型,发病率呈逐年上升趋势[1-2],在恶性肿瘤中发病率、死亡率均居首位。吉西他滨为胞嘧啶核苷类化学治疗(简称化疗)药物,可有效改善多种实体肿瘤患者的病情及生存期[3-4]。由于化疗药物的毒副作用,患者治疗期间常出现系列不良反应,影响治疗依从性及预后[5-6]。因此,寻找一种安全、有效的治疗方案成为肺腺癌临床研究的重点方向。有研究表明,非小细胞肺癌患者中间变性淋巴瘤激酶(ALK)的突变率为3%~7%[7],分子靶向治疗方案已逐渐应用于ALK 突变患者的临床治疗。阿来替尼作为第2代ALK 抑制剂,用于晚期ALK 阳性非小细胞肺癌患者的效果较好[8]。但关于阿来替尼靶向治疗在肺腺癌患者中的应用报道较少。故本研究中探讨了阿来替尼靶向治疗联合吉西他滨化疗对肺腺癌患者近期疗效及不良反应的影响。现报道如下。
1 资料与方法
1.1 一般资料
纳入标准:符合《国际肺癌研究协会/美国胸科学会/欧洲呼吸学会国际多学科肺腺癌分类(2011年版)》中肺腺癌的诊断标准[9];年龄18~75 岁;TNM 分期为Ⅲb-Ⅳ期;卡氏功能状态评分(KPS)大于60分;免疫组织化学染色(IHC)或荧光原位杂交(FISH)证实肺腺癌组织中存在ALK 基因的异常活化。本研究方案已获医院生物医学伦理审查委员会批准[批件号为2019 年审(456)号],患者及其家属均签署知情同意书。
排除标准:妊娠期或哺乳期;对本研究中所用药物过敏;伴肺结核、肺炎等其他肺部疾病;精神疾病,无法正常交流;合并严重肝、肾功能不全;依从性较差,无法完成治疗。
病例选择与分组:选取四川大学华西医院2020 年1 月至2021 年2 月收治的肺腺癌患者110 例,按随机信封法分为研究组和对照组,各55例。两组患者一般资料比较,差异无统计学意义(P>0.05),具有可比性。详见表1。
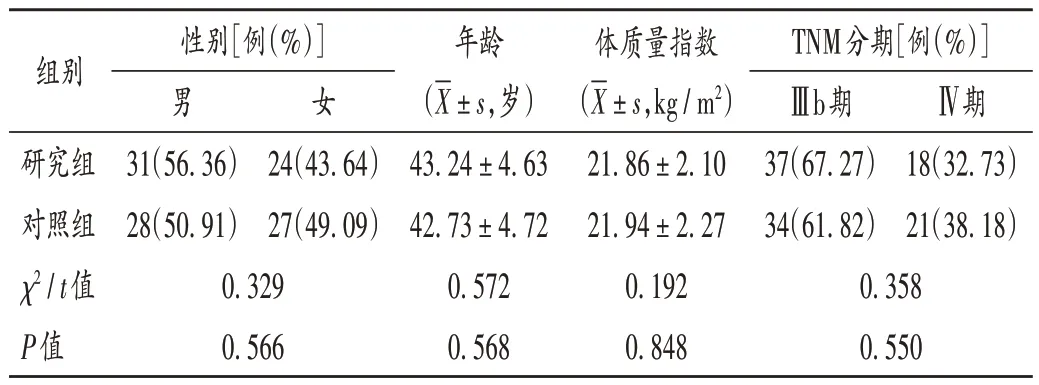
表1 两组患者一般资料比较(n=55)Tab.1 Comparison of the patients' general data between the two groups(n=55)
1.2 方法
对照组患者予注射用吉西他滨(江苏豪森药业集团有限公司,国药准字H20030104,规格为每支0.2 g<以C9H11F2N3O4计>),化疗剂量为1 000 mg/ m2,加入0.9%氯化钠注射液静脉滴注30 min,每周1 次,3 次后休息1 周,每个疗程为4 周。研究组患者在对照组基础上加用盐酸阿来替尼胶囊(Excella GmbH & Co.KG,Chugai Pharma Manufacturing Co.,Ltd.,国 药 准 字HJ20180047,规格为每粒150 mg <按C30H34N4O2计>),靶向治疗剂量为每次600 mg,每日2 次。两组患者均治疗6个月。
1.3 观察指标与疗效判定标准
观察指标:1)血清生化指标。采用酶联免疫吸附试验(ELISA)检测患者血清中血管内皮生长因子(VEGF)、神经元特异性烯醇化酶(NSE)、基质金属蛋白酶-9(MMP-9)水平,检测仪器为Multiskan FC 型酶标仪(美国Thermo Fisher Scientific 公司),试剂盒购自上海齐源生物科技有限公司,所有操作均按说明书进行。2)肿瘤标志物。采用电化学发光法检测患者血清中癌胚抗原(CEA)、细胞角蛋白19 片段抗原21 - 1(CYFRA21-1)、糖类抗原125(CA125)水平,检查仪器为Fluoroskan Ascent FL 型电化学发光仪(美国Thermo Fisher Scientific 公司),试剂盒购自博奥塞斯(天津)生物科技有限公司,按说明书进行操作。3)免疫功能。采用ELISA 检测患者血清中免疫球蛋白A(IgA)、免疫球蛋白E(IgE)水平;使用流式细胞仪检测T 淋巴细胞亚群CD4+和CD8+水平,计算CD4+/ CD8+。检测仪器为Multiskan FC 型酶标仪,试剂盒购自上海齐源生物科技有限公司,按说明书进行操作。4)生存质量。采用肺癌治疗功能评定量表(FACT - L)[10]评估患者的生活质量,包括生理状况、情感状况、社会状况、功能状况及肺癌特异性症状5个维度共36条目,各条目评分分别为28,24,28,28,36 分。得分越高,患者生活质量越好。5)不良反应。记录两组患者治疗期间骨髓抑制、胃肠道反应、肝功能异常等不良反应发生情况。
近期疗效判定[11]:评估患者治疗6 个月后的临床疗效,可分为完全缓解(CR)、部分缓解(PR)、疾病稳定(SD)、疾病进展(PD)。客观缓解率(ORR)=CR+PR。
1.4 统计学处理
采用SPSS 26.0 统计学软件分析。计量资料以±s表示,行t检验;计数资料以率(%)表示,行χ2检验或Z检验。P<0.05为差异有统计学意义。
2 结果
结果见表2至表7。
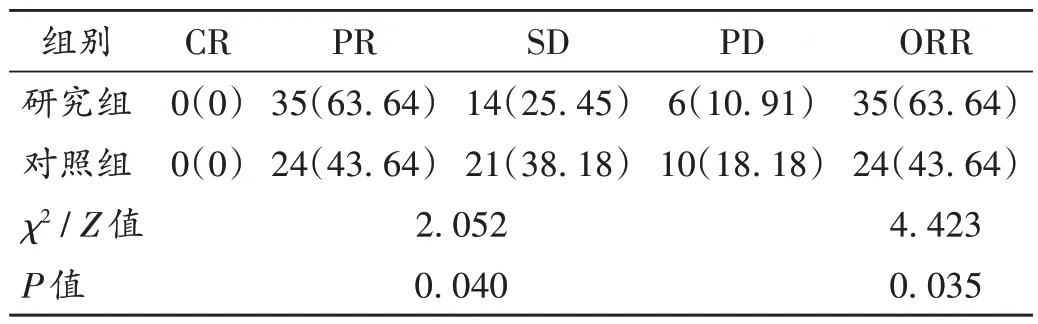
表2 两组患者近期疗效比较[例(%),n=55]Tab.2 Comparison of short-term efficacy between the two groups[case(%),n=55]
表3 两组患者血清生化指标比较(±s,ng/L,n=55)Tab.3 Comparison of serum biochemical indexes between the two groups(±s,ng/L,n=55)
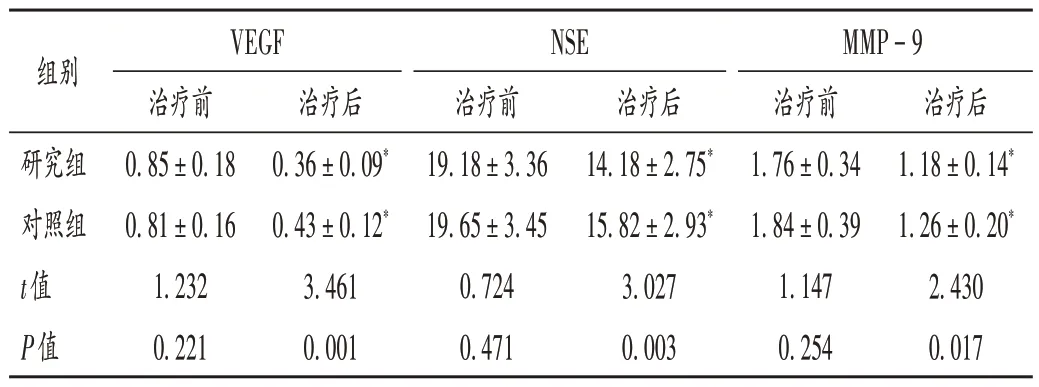
表3 两组患者血清生化指标比较(±s,ng/L,n=55)Tab.3 Comparison of serum biochemical indexes between the two groups(±s,ng/L,n=55)
注:与本组治疗前比较,*P <0.05。表4至表6同。Note:Compared with those before treatment,*P < 0.05 (for Tab.3 - 6).
组别VEGF治疗前0.85±0.18 0.81±0.16 1.232 0.221治疗后0.36±0.09*0.43±0.12*3.461 0.001研究组对照组t值P值NSE治疗前19.18±3.36 19.65±3.45 0.724 0.471治疗后14.18±2.75*15.82±2.93*3.027 0.003 MMP-9治疗前1.76±0.34 1.84±0.39 1.147 0.254治疗后1.18±0.14*1.26±0.20*2.430 0.017
表4 两组患者肿瘤标志物水平比较(X±s,n=55)Tab.4 Comparison of tumor markers levels between the two groups(±s,n=55)

表4 两组患者肿瘤标志物水平比较(X±s,n=55)Tab.4 Comparison of tumor markers levels between the two groups(±s,n=55)
组别CEA(ng/mL)治疗前25.38±3.54 25.74±3.66 0.524 0.601治疗后12.51±2.77*14.28±2.95*3.244 0.002 CYFRA21-1(ng/L)治疗前6.50±1.03 6.29±1.12 1.024 0.308治疗后2.76±0.85*3.26±1.01*2.809 0.006 CA125(U/mL)治疗前51.35±5.61 52.19±5.59 0.787 0.433研究组对照组t值P值治疗后38.46±3.71*40.25±3.86*2.480 0.015
表5 两组患者免疫功能指标比较(X±s,n=55)Tab.5 Comparison of immune function between the two groups(±s,n=55)

表5 两组患者免疫功能指标比较(X±s,n=55)Tab.5 Comparison of immune function between the two groups(±s,n=55)
+组别+ /CD8 IgA(g/L)治疗前0.61±0.08 0.59±0.06 1.483 0.141 IgE(mg/L)治疗前3.52±0.41 3.46±0.35 0.825 0.411治疗后1.75±0.24*1.64±0.21*2.558 0.012 CD4治疗后1.83±0.21*2.07±0.28*5.085<0.001治疗后1.48±0.16*1.32±0.12*5.933<0.001治疗前0.87±0.08 0.85±0.06 1.483 0.141研究组对照组t值P值
表6 两组患者生存质量评分比较(X±s,分,n=55)Tab.6 Comparison of quality of life scores between the two groups(±s,point,n=55)
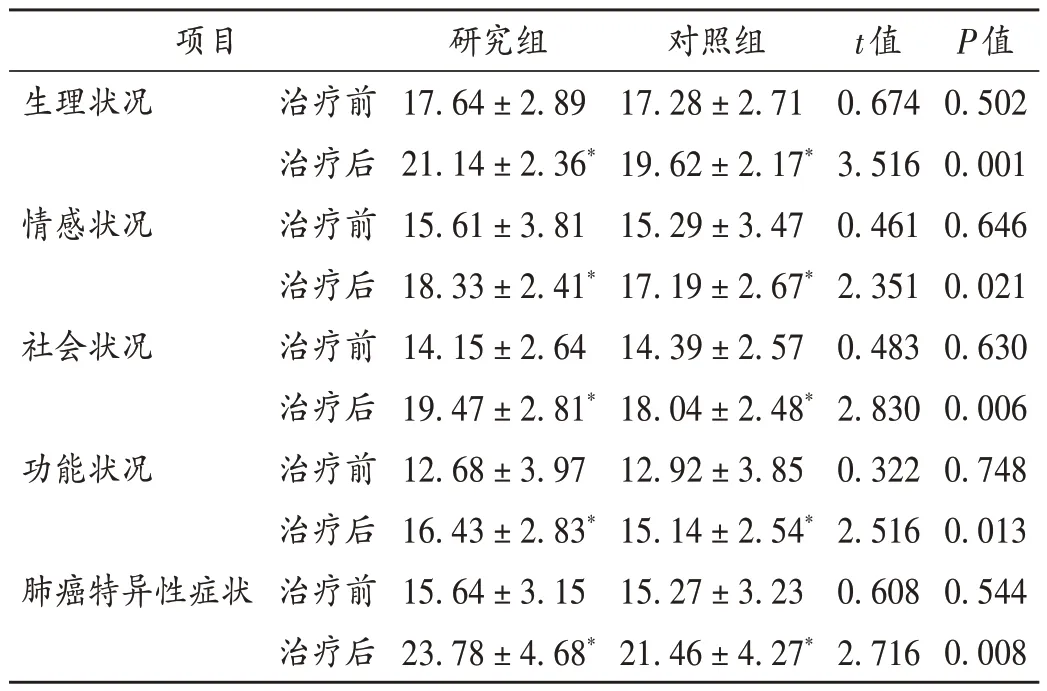
表6 两组患者生存质量评分比较(X±s,分,n=55)Tab.6 Comparison of quality of life scores between the two groups(±s,point,n=55)
项目生理状况情感状况社会状况功能状况肺癌特异性症状治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后治疗前治疗后研究组17.64±2.89 21.14±2.36*15.61±3.81 18.33±2.41*14.15±2.64 19.47±2.81*12.68±3.97 16.43±2.83*15.64±3.15 23.78±4.68*对照组17.28±2.71 19.62±2.17*15.29±3.47 17.19±2.67*14.39±2.57 18.04±2.48*12.92±3.85 15.14±2.54*15.27±3.23 21.46±4.27*t值0.674 3.516 0.461 2.351 0.483 2.830 0.322 2.516 0.608 2.716 P值0.502 0.001 0.646 0.021 0.630 0.006 0.748 0.013 0.544 0.008

表7 两组患者不良反应发生情况比较[例(%),n=55]Tab.7 Comparison of the incidence of adverse reactions between the two groups[case(%),n=55]
3 讨论
肺癌常见致病因素包括吸烟、职业暴露、空气污染等[12-13],临床症状主要为胸痛、咳嗽、痰血、呼吸困难等,严重影响患者的生活质量[14-15]。肺腺癌在肺癌中的发病率为40.9%,是肺癌主要病理亚型[16]。目前,化疗是肺腺癌的常用治疗手段,但患者常出现骨髓抑制、胃肠道反应等不良反应,影响疗效[17]。靶向治疗是近年来新兴肿瘤治疗方案,临床疗效较好[18-19]。
本研究结果显示,研究组患者近期疗效明显高于对照组,表明阿来替尼联合吉西他滨治疗肺腺癌疗效确切。可能是由于吉西他滨作为胞嘧啶核苷类抗肿瘤药物,通过在肿瘤细胞内代谢为吉西他滨二磷酸盐与吉西他滨三磷酸盐,参与肿瘤细胞DNA 转录过程,最终导致肿瘤细胞凋亡[20];而阿来替尼作为靶向治疗药物,可有效阻断ALK信号通路,进而抑制癌细胞增殖[21]。二者联用可有效提高药物对肿瘤细胞的杀伤力,与杜凤华等[22]的研究结果一致。
相关研究表明,CEA 水平与肿瘤远端转移具有一定相关性,常被用于肺腺癌的临床诊断;CA125 与肿瘤患者生存期密切相关,可用于评估临床疗效[23];CYFRA21 - 1 与CEA 可用于监测肿瘤患者病情进展[24]。VEGF,NSE,MMP - 9 水平受肿瘤细胞生理生化反应影响,其水平随肿瘤细胞被抑制而降低[25-26]。本研究结果显示,联合治疗方案可有效降低患者的血清生化指标VEGF,NSE,MMP-9及肿瘤标志物指标CEA,CYFRA21-1,CA125的水平,推测阿来替尼靶向治疗可有效阻断ALK信号通路,对抑制肿瘤增殖及转移具有积极影响。T淋巴细胞及其亚群可有效调节机体免疫应答,IgA,IgE,CD4+/CD8+水平可有效反映患者免疫反应水平[27]。本研究结果显示,联合治疗方案可有效提高免疫反应水平,可能是由于靶向治疗联合化疗对肿瘤细胞增殖产生了抑制,患者的免疫功能得到了较快恢复。
本研究结果显示,研究组患者不良反应发生率明显低于对照组,表明联合治疗方案可有效降低患者不良反应的发生风险,具有较好的安全性。分析原因,作为靶向抑制剂阿来替尼可精准作用于肿瘤位点,对其他器官损伤较低,且联合治疗可减少吉西他滨化疗剂量,降低吉西他滨大量静脉滴注造成的不良反应,与朱梦楚等[28]和王福立等[29]的研究结果一致。但由于本研究中存在随访时间较短、样本量较小等局限,后续研究中将进一步延长随访时间、扩大样本量进一步验证本研究结论。
综上所述,阿来替尼靶向治疗联合吉西他滨化疗可有效提高肺腺癌患者的近期疗效,降低肿瘤增殖及转移风险,促进免疫系统功能恢复,提高患者的生活质量,且治疗安全性较好。
