基于TGR5 介导的NLRP3 炎症小体探讨芪参汤抑制巨噬细胞M1 型极化改善非酒精性脂肪性肝炎的机制
2023-11-14高佳炜杨柳欣朱瑞增张雅丽袁星星
高 山,高佳炜,杨柳欣,朱瑞增,张雅丽,袁星星,3
(1.大庆市中医医院,黑龙江 大庆 163311;2.黑龙江中医药大学,黑龙江 哈尔滨150040;3.黑龙江省中医药科学院,黑龙江 哈尔滨 150006;4.张雅丽名老中医药专家工作室,黑龙江 哈尔滨 150006)
非酒精性脂肪性肝炎(nonalcoholic steatohepatitis,NASH)是一种以肝脏脂肪积聚、炎症反应和程度不一的纤维化为主要特征的代谢相关的肝脏疾病[1]。流行病学研究显示,近年来NASH 的发病率呈现逐年上升的趋势,已成为全球最常见的慢性肝脏疾病之一,预计到2030 年,NASH 将成为肝移植的主要原因之一[2,3]。NASH 临床缺乏准确的非侵入性诊断方法,并且尚无特定的药物可供治疗,因此亟需进一步研究以开发有效的治疗策略和临床工具来管理和治疗NASH[4]。
NLRP3(NOD -like receptor family,pyrin domain-containing protein 3)炎症小体是一种多亚单位的细胞器结构,已被证实在NASH 肝脏炎症中发挥着重要的作用[5,6]。当细胞受到损伤或感染时,NLRP3 炎症小体会被激活,进而促进炎症信号的传导[7]。在巨噬细胞极化中,NLRP3 炎症小体的活化被认为是促进M1 型巨噬细胞极化的关键因素之一[8]。课题组前期研究显示,芪参汤对可以通过抑制炎症反应达到治疗NASH 的作用[9]。同时,芪参汤还可以通过miR-495 上调脂肪和肥胖相关基因(fat mass and obesity-associated,FTO)的表达抑制巨噬细胞的M1 型极化,发挥抑制炎症和改善胰岛素抵抗的作用[10]。因此,本研究通过观察芪参汤对胆汁酸 G 蛋白偶联受体 5(takeda G protein-coupled receptor 5,TGR5)介导的NLRP3 炎症小体激活的影响,从而进一步明确其抑制炎症治疗NASH 的分子机制。
1 材料与方法
1.1 实验动物
清洁级BALB/C 小鼠购于(6~8 w,雄性,18~23 g)购于赛业(固安)生物科技有限公司(生产许可证:SCXK(冀)2021-003)。动物饲养于黑龙江省中医药科学院动物实验中心,湿度45%~58%,温度21~24 ℃,循环光照。
1.2 细胞株
小鼠巨噬细胞系RAW264.7 购于中国科学院细胞库。
1.2 试剂和仪器
DMEM 培养基购于美国Gibco 公司(货号:12430054);10% 胎牛血清(Fetal bovine serum,FBS)和青霉素&链霉素双抗均购于美国Thermo Fisher 公司(货号分别为S8318 和15140122)。棕榈酸购于美国Sigma 公司(货号:7619,纯度99.0%,CAS No.57-10-3);SB756050 购于美国MedChem-Express 公司(货号:HY-102016 ,纯度98.49%,CAS No.447410-57-3);小鼠白细胞介素-6 (Interleukin-6,IL-6)、小鼠肿瘤坏死因子-α(Tumor necrosis factor-alpha,TNF-α)、小鼠白细胞介素-1β(Interleukin-1β,IL-1β)ELISA 检测试剂盒和超敏ECL 化学发光试剂盒购于上海碧云天生物科技有限公司(货号分别为 PT513、PI326、PI301 和P0018S);趋化因子配体2(Chemokine ligand 2,CXCL2)ELISA 检测试剂盒购于江苏酶免实业有限公司(货号为MM-1012M1)。异硫氰基荧光素(FITC)标记的CD86、iNOS 抗体和HRP 标记的二抗购于美国CST 公司(货号分别为#99879、13120 和7074)。NLRP3、ASC、Caspase-1、IL-1β、TGR5、STAT1、p-STAT1、STAT6、p-STAT6 和β-actin 均购于英国Abcam 公司(货号分别为ab263899、ab309497、ab138483、ab216995、ab72608、ab109320、ab109461、ab263947、ab32520 和ab8226)。细胞培养孵箱购于德国宾德公司(型号:CB260);流式细胞仪购于美国贝克曼库尔特公司(型号:CytoFlex);酶标仪购于美国安捷伦公司(型号:Synergy H1);凝胶成像仪购于上海天能公司(型号:Tanon 1600);电泳仪购于美国Bio-Rad公司(型号:Mini-Protean Tetra)。
1.3 方法
1.3.1 细胞培养 小鼠巨噬细胞系RAW264.7 置于37 ℃及5%CO2培养箱中培养,培养条件:含1%双抗与10%胎牛血清的DMEM 培养基。
1.3.2 药物及含药血清制备 芪参汤(由生黄芪15 g、西洋参10 g、丹参10 g、净山楂10 g、盐泽泻10 g、荷叶10 g、三七5 g、墨旱莲8 g、女贞子8 g、绞股蓝5 g 和生甘草3 g 组成)购于黑龙江省中医药科学院南岗院区中草药局,药物经浸泡、煎煮两次、过滤后合并药液,浓缩制备成浸膏。
30 只BALB/C 小鼠适应性饲养一周后随机分为空白组和芪参汤组,参照前期研究[11]得出的最佳干预剂量(18.8 g/kg),以4 倍浓度(75.2 g/kg)灌胃制备芪参汤含药血清,空白组小鼠给予等体积的生理盐水灌胃,每次1 mL,每日1 次,连续7 日。于末次灌胃后4 h,1%戊巴比妥钠(40 mg/kg)腹腔注射麻醉后腹主动脉取血,3 000 r/min 离心10 min 后,收集血清,水浴灭活后0.22 μm 滤膜过滤,分装冻存。
1.3.3 细胞分组和药物干预 当RAW264.7 处于对数生长期时,细胞以1×106个/mL 的密度接种于6 孔板,每孔900 μL。细胞并分为空白组、模型组、芪参汤组、TGR5 激动剂组和芪参汤+TGR5 激动剂组,每组设置4 个复孔。参照文献[12]中方法以棕榈酸诱导构建巨噬细胞NLRP3 活化模型。具体实施方案及药物干预方法如下:⑴ 空白组:900 μL 正常培养基+100 μL 空白血清;⑵ 模型组:900 μL 正常培养基+100 μL 空白血清+200 mM 棕榈酸;⑶芪参汤组:900 μL 正常培养基+200 mM 棕榈酸+100 μL 芪参汤含药血清;⑷ TGR5 激动剂组:900 μL 正常培养基+100 μL 空白血清+200 mM 棕榈酸+200 mM SB756050;⑸ 芪参汤+TGR5 激动剂组:900 μL 正常培养基+200 mM 棕榈酸+100 μL芪参汤含药血清+200 mM SB756050。48 h 后收集各组细胞,用于后续实验。
1.3.4 ELISA 检测 于48 h 后收集各组细胞上清,参照试剂盒说明书检测各组细胞上清中TNF-α、IL-6、IL-1β 和CXCL2 的含量。实验步骤严格参照试剂盒说明书进行。
1.3.5 流式细胞术 于48 h 后收集各组细胞,1 000 r/min 离心5 min 后弃上清,加入PBS 重悬,1 000 r/min 离心5 min 后弃上清,重复洗涤2 次。加入PBS重悬巨噬细胞,加入FITC 标记的CD86 和iNOS 抗体进行孵育30 min。收集各组细胞,PBS 洗涤后加入PBS 重悬,上流式细胞仪检测各组巨噬细胞CD86 和iNOS 阳性表达细胞的百分比。
1.3.6 Western blot 检测 于48 h 后收集各组细胞,1 000 r/min 离心5 min 后,收集细胞上清液和细胞沉淀。细胞加入RIPI 裂解后1 000 r/min 离心5 min,收集上清,即为细胞裂解液。分别提取细胞上清液和裂解液中的总蛋白,BCA 法测定蛋白浓度。上样、电泳、转膜、脱脂牛奶封闭,加入稀释后的NLRP3、ASC、Caspase-1、IL-1β、TGR5、STAT1、p-STAT1、STAT6、p-STAT6 和β-actin 一抗,4 ℃孵育过夜,加入适当比例稀释后的二抗继续孵育2 h。TBTS 洗涤后,滴加ECL 显影,于凝胶成像系统显影后拍照,采用Image J 软件对条带灰度值进行分析,以β-actin 作为内参抗体,以目的蛋白和内参的比较表示目的蛋白的相对表达水平。
1.4 统计学处理
本研究数据以SPSS 26.0 软件进行统计分析,多组间数据的比较采用单因素方差分析,组间两两的比较采用最小显著差异法进行检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 芪参汤对巨噬细胞炎症和趋化因子含量的影响
与空白组相比,模型组巨噬细胞TNF-α、IL-6、IL-1β 和CXCL2 的含量均显著增加,差异均具有统计学意义(P<0.01)。与模型组比较,芪参汤组、TGR5 激动剂组和芪参汤+ TGR5 激动剂组TNFα、IL-6、IL-1β 和CXCL2 的含量均显著降低,差异均具有统计学意义(P<0.01)。与芪参汤组和TGR5激动剂组比较,芪参汤+TGR5 激动剂组TNF-α、IL-6、IL-1β 和CXCL2 的含量均显著降低,差异均具有统计学意义(P<0.01)。见表1。
表1 各组巨噬细胞炎症和趋化因子含量的比较(n=4,±s,pg/mL)Tab 1 Comparison of macrophage inflammation and chemokine content in each group(n=4,±s,pg/mL)

表1 各组巨噬细胞炎症和趋化因子含量的比较(n=4,±s,pg/mL)Tab 1 Comparison of macrophage inflammation and chemokine content in each group(n=4,±s,pg/mL)
注:与空白组比较,**P<0.01;与模型组比较,○○P<0.01;与芪参汤比较,△△P<0.01;与TGR5 激动剂组比较,●●P<0.01。
组别空白组模型组芪参汤组TGR5 激动剂组芪参汤+ TGR5 激动剂组CXCL2 47.33±3.75 129.83±11.03**78.98±4.31○○76.04±3.71○○51.02±2.56○○△△●●124.477 0.000 FP TNF-α 22.64±3.60 72.56±9.30**43.20±6.96○○45.66±6.44○○29.03±5.00○○△△●●34.740 0.000 IL-6 8.62±2.20 27.02±3.99**18.24±1.12○○18.30±2.71○○11.55±1.00○○△△●●33.449 0.000 IL-1β 14.04±0.76 72.11±6.30**42.71±2.29○○42.69±3.52○○27.50±1.31○○△△●●157.481 0.000
2.2 芪参汤对巨噬细胞CD86 和iNOS 表达的影响
与空白组相比,模型组CD86 和iNOS 阳性表达的巨噬细胞比例均显著增加,差异均具有统计学意义(P<0.01)。与模型组比较,芪参汤组、TGR5 激动剂组和芪参汤+TGR5 激动剂组CD86 和iNOS阳性表达的巨噬细胞比例均显著降低,差异均具有统计学意义(P<0.01)。与芪参汤组和TGR5 激动剂组比较,芪参汤+TGR5 激动剂组CD86 和iNOS阳性表达的巨噬细胞比例均显著降低,差异均具有统计学意义(P<0.01)。见表2 和图1。

图1 各组巨噬细胞CD86 和iNOS 表达的比较Fig 1 Comparison of the expression of CD86 and iNOS in macrophages of each group
表2 各组巨噬细胞CD86 和iNOS 表达的比较(n=4,±s,%)Tab 2 Comparison of the expression of CD86 and iNOS inmacrophages of each group(n=4,±s,%)

表2 各组巨噬细胞CD86 和iNOS 表达的比较(n=4,±s,%)Tab 2 Comparison of the expression of CD86 and iNOS inmacrophages of each group(n=4,±s,%)
注:与空白组比较,**P<0.01;与模型组比较,○○P<0.01;与芪参汤比较,△△P<0.01;与TGR5 激动剂组比较,●●P<0.01。
iNOS 8.50±0.57 31.99±3.61**25.22±1.81○○24.15±1.44○○19.41±1.57○○△△●●71.746 0.000组别空白组模型组芪参汤组TGR5 激动剂组芪参汤+ TGR5 激动剂组FP CD86 19.72±2.47 54.35±3.49**33.42±2.60○○34.40±2.76○○25.75±2.03○○△△●●93.251 0.000
2.3 芪参汤对巨噬细胞NLRP3 炎症小体活化的影响
与空白组相比,模型组巨噬细胞裂解液中NLRP3、Pro-IL-1β 蛋白的表达和细胞上清液中Caspase-1 p10、Caspase-1 p20 及IL-1β p17 蛋白的表达均显著增加,差异均具有统计学意义(P<0.01),而巨噬细胞裂解液中ASC 和Caspase-1 p45 蛋白的表达均无明显变化,差异均无统计学意义(P>0.05)。与模型组比较,芪参汤组、TGR5 激动剂组和芪参汤+TGR5 激动剂组巨噬细胞裂解液中NLRP3、Pro-IL-1β 蛋白的表达和细胞上清液中Caspase-1 p10、Caspase-1 p20 及IL-1β p17 蛋白的表达均显著降低,差异均具有统计学意义(P<0.01),而巨噬细胞裂解液中ASC 和Caspase-1 p45 蛋白的表达均无明显变化,差异均无统计学意义(P>0.05)。与芪参汤组和TGR5 激动剂组比较,芪参汤+TGR5 激动剂组巨噬细胞裂解液中NLRP3、Pro-IL-1β 蛋白的表达和细胞上清液中Caspase-1 p10、Caspase-1 p20 及IL-1β p17 蛋白的表达均显著降低,差异均具有统计学意义(P<0.01),而巨噬细胞裂解液中ASC 和Caspase-1 p45 蛋白的表达均无明显变化,差异均无统计学意义(P>0.05)。见表3、4 和图2。

图2 各组巨噬细胞NLRP3 炎症小体活化蛋白表达的比较Fig 2 Comparison of NLRP3 inflammatory body activating protein expression in macrophages of all groups
表3 各组巨噬细胞裂解液NLRP3、ASC、Caspase-1 p45 和Pro-IL-1β 蛋白表达的比较(n=4,±s)Tab 3 Comparison of protein expression in NLRP3, ASC, Caspase-1 p45 and Pro-IL-1β in macrophage lysates of each group(n=4,±s)
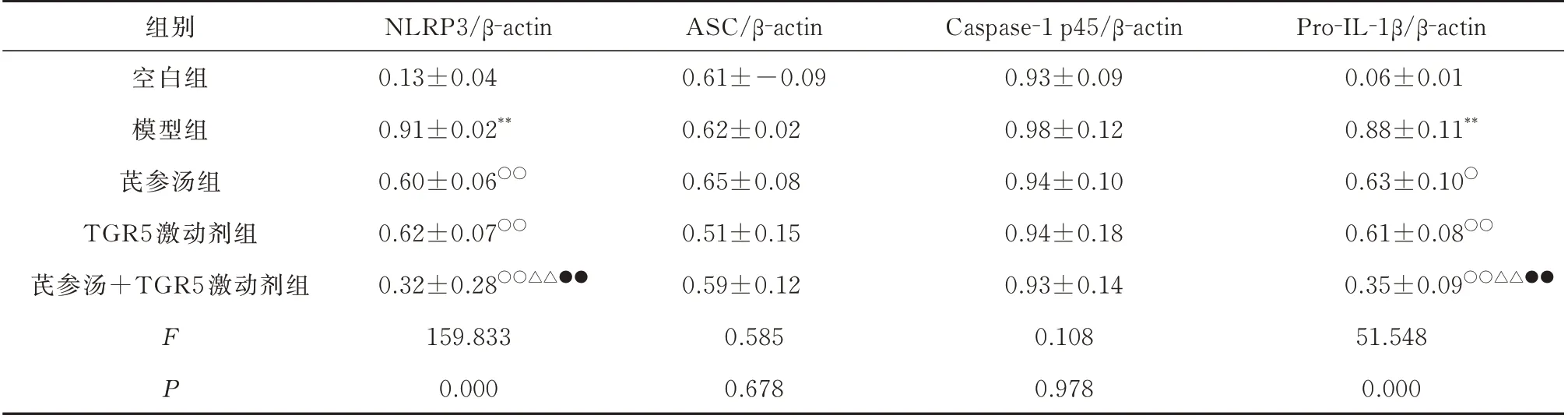
表3 各组巨噬细胞裂解液NLRP3、ASC、Caspase-1 p45 和Pro-IL-1β 蛋白表达的比较(n=4,±s)Tab 3 Comparison of protein expression in NLRP3, ASC, Caspase-1 p45 and Pro-IL-1β in macrophage lysates of each group(n=4,±s)
注:与空白组比较,**P<0.01;与模型组比较,○P<0.05,○○P<0.01;与芪参汤比较,△△P<0.01;与TGR5 激动剂组比较,●●P<0.01。
组别空白组模型组芪参汤组TGR5 激动剂组芪参汤+TGR5 激动剂组Pro-IL-1β/β-actin 0.06±0.01 0.88±0.11**0.63±0.10○0.61±0.08○○0.35±0.09○○△△●●51.548 0.000 FP NLRP3/β-actin 0.13±0.04 0.91±0.02**0.60±0.06○○0.62±0.07○○0.32±0.28○○△△●●159.833 0.000 ASC/β-actin 0.61±-0.09 0.62±0.02 0.65±0.08 0.51±0.15 0.59±0.12 0.585 0.678 Caspase-1 p45/β-actin 0.93±0.09 0.98±0.12 0.94±0.10 0.94±0.18 0.93±0.14 0.108 0.978
表4 各组巨噬细胞上清Caspase-1 p10、Caspase-1 p20 和IL-1β p17 蛋白表达的比较(n=4,±s)Tab 4 Comparison of protein expression of Caspase-1 p10, Caspase-1 p20 and IL-1β p17 in macrophages of each group(n=4,±s)
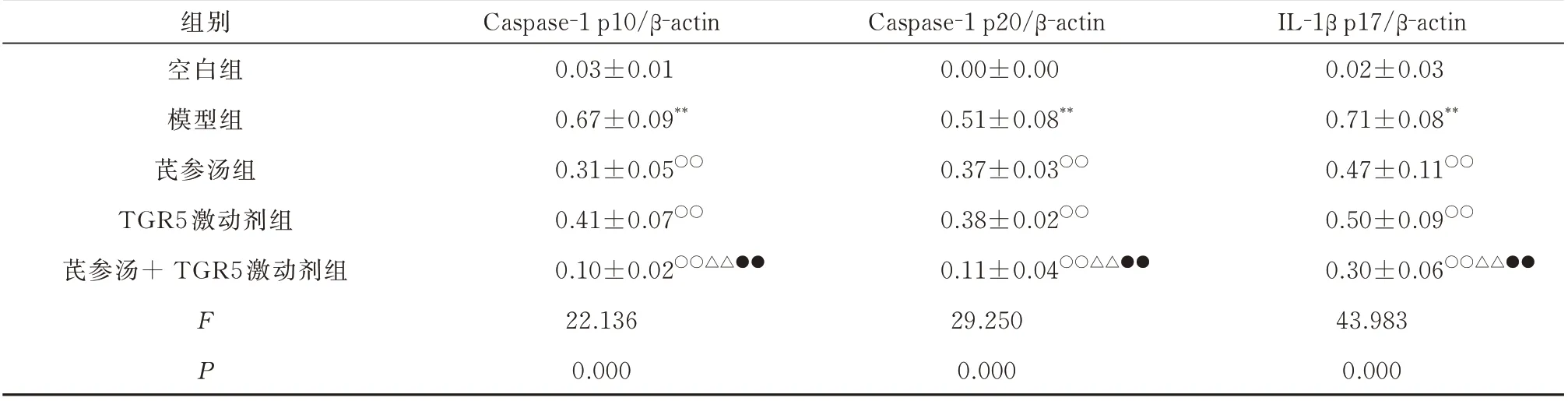
表4 各组巨噬细胞上清Caspase-1 p10、Caspase-1 p20 和IL-1β p17 蛋白表达的比较(n=4,±s)Tab 4 Comparison of protein expression of Caspase-1 p10, Caspase-1 p20 and IL-1β p17 in macrophages of each group(n=4,±s)
注:与空白组比较,**P<0.01;与模型组比较,○○P<0.01;与芪参汤比较,△△P<0.01;与TGR5 激动剂组比较,●●P<0.01。
IL-1β p17/β-actin 0.02±0.03 0.71±0.08**0.47±0.11○○0.50±0.09○○0.30±0.06○○△△●●43.983 0.000组别空白组模型组芪参汤组TGR5 激动剂组芪参汤+ TGR5 激动剂组FP Caspase-1 p10/β-actin 0.03±0.01 0.67±0.09**0.31±0.05○○0.41±0.07○○0.10±0.02○○△△●●22.136 0.000 Caspase-1 p20/β-actin 0.00±0.00 0.51±0.08**0.37±0.03○○0.38±0.02○○0.11±0.04○○△△●●29.250 0.000
2.4 芪参汤对巨噬细胞TGR5/STAT1/STAT6 信号通路的影响
与空白组相比,模型组巨噬细胞TGR5 和p-STAT6 蛋白的表达显著降低,p-STAT1 蛋白的表达显著增加,差异均具有统计学意义(P<0.01)。与模型组比较,芪参汤组、TGR5 激动剂组和芪参汤+TGR5 激动剂组巨噬细胞TGR5 和p-STAT6 蛋白的表达显著增加,p-STAT1 蛋白的表达显著降低,差异均具有统计学意义(P<0.01)。与芪参汤组和TGR5 激动剂组比较,芪参汤+TGR5 激动剂组巨噬细胞TGR5 和p-STAT6 蛋白的表达显著增加,p-STAT1 蛋白的表达显著降低,差异均具有统计学意义(P<0.01)。见表5 和图3。

图3 各组巨噬细胞TGR5/STAT1/STAT6 信号通路中蛋白表达的比较Fig 3 Comparison of protein expression in TGR5/STAT1/STAT6 signaling pathway of macrophages of all groups
表5 各组巨噬细胞TGR5/STAT1/STAT6 信号通路中蛋白表达的比较(n=4,±s)Tab 5 Comparison of protein expression in TGR5/STAT1/STAT6 signaling pathway of macrophages of all groups(n=4,±s)

表5 各组巨噬细胞TGR5/STAT1/STAT6 信号通路中蛋白表达的比较(n=4,±s)Tab 5 Comparison of protein expression in TGR5/STAT1/STAT6 signaling pathway of macrophages of all groups(n=4,±s)
注:与空白组比较,**P<0.01;与模型组比较,○○P<0.01;与芪参汤比较,△△P<0.01;与TGR5 激动剂组比较,●●P<0.01。
p-p65/ p65 1.04±0.11 0.12±0.06**0.44±0.05○○0.42±0.08○○0.82±0.18○○△△●●0.108 0.978组别空白组模型组芪参汤组TGR5 激动剂组芪参汤+TGR5 激动剂组FP TGR5/β-actin 1.06±0.13 0.39±0.05**0.61±0.10○○0.62±0.04○○0.91±0.18○○△△●●159.833 0.000 p-STAT1/ STAT1 0.32±0.03 0.85±0.07**0.45±0.16○○0.41±0.06○○0.21±0.07○○△△●●0.585 0.678
3 讨论
巨噬细胞存在显著的异质性,根据其表面标志物、所产生的细胞因子和基因表达谱的不同,可分为不同的亚群。作为肝脏内重要的免疫细胞,巨噬细胞在组织稳态和疾病进展中发挥着不同的免疫功能。它们通过识别、摄取和降解外来病原体或细胞碎片,调节局部炎症反应,从而促进或抑制肝纤维化的进程。TNF-α 是一种由多细胞产生的炎症因子,其通过不同方式参与氧化应激及脂质过氧化反应,促进肝脏炎症反应[13]。不仅如此,TNF-α 还可通过胰岛素信号通路促进肝脏脂肪变,在NASH进展中发挥着重要作用[14]。IL-6 又名干细胞刺激因子,由活化的单核细胞所产生,通过调控适应性免疫,在肝脏炎症反应、代谢及肝脏组织再生中发挥着重要的作用[15]。IL-1β 由单核-巨噬细胞产生,不仅能够促进炎症细胞的肝脏募集,能够诱导上皮细胞的黏附分子的表达,从而加重肝脏炎症损伤。研究结果显示,NASH 患者血清IL-1β 的表达显著增加[16]。CXCL2 是CXC 类趋化因子的成员,其可通过招募和激活中性粒细胞,释放多种炎症因子从而加速肝脏炎症反应。此外,巨噬细胞通过分泌CXCL2 并作用于肝星状细胞上的CXCR2,从而促进细胞内NLRP3 炎症小体的活化[17]。本研究结果显示,棕榈酸诱导能够显著增加巨噬细胞TNF-α、IL-6、IL-1β 和CXCL2 的含量,而芪参汤含药血清能够显著降低巨噬细胞TNF-α、IL-6、IL-1β 和CXCL2的分泌,发挥抑制炎症的作用。
根据活化状态,巨噬细胞可分为经典激活(M1型)和替代激活(M2 型)巨噬细胞,其中M1 型巨噬细胞以INF-γ 和LPS 信号传导为主,通过分泌趋化因子和促炎因子,发挥促炎作用。NLRP3 炎症小体是天然免疫系统的重要组成部分,广泛存在于肝实质细胞及非实质细胞中[18]。该炎症小体是由NLRP3、含有半胱天冬酶募集结构域的适配器凋亡相关斑点样蛋白ASC 及效应蛋白酶pro- Caspase -1 组成。NLRP3 炎症小体的激活分为启动和激活两个阶段。首先,病原体相关分子模式与模式识别受体结合,以上调NLRP3 和pro-IL-1β 的表达。随后,NLRP3 分子通过NACHT 域的同型相互作用发生寡聚化,其寡聚体通过PYD-PYD 相互作用招募ASC,促进ASC 斑点的形成[19]。最后,ASC 的C 端Caspase 招募域与前体pro-Caspase-1 相互作用,通过Caspase-1 的p20 和p10 亚基之间的邻近诱导作用发生自切割,从而激活Caspase-1[20]。活化后的Caspase-1 进一步切割前体IL-18 和IL-1β,生成成熟的IL-18 和IL-1β[21]。此外,活化的Caspase-1 还能够切割并激活GSDMD,使其易位至细胞质膜并形成孔道,促进成熟的IL-18 和IL-1β 释放到胞外[22]。本研究中,棕榈酸诱导能够显著增加CD86 和iNOS 阳性表达的巨噬细胞比例,芪参汤含药血清能够显著抑制CD86 和iNOS 阳性表达的巨噬细胞比例,达到抑制巨噬细胞的M1 型极化。此外,棕榈酸还能显著上调巨噬细胞中NLRP3、Pro-IL-1β 蛋白的表达和细胞上清液中Caspase-1 p10、Caspase-1 p20 及IL-1β p17 蛋白的表达,而对Caspase-1 p45 蛋白的表达无明显作用。芪参汤干预能够显著下调巨噬细胞中NLRP3、Pro-IL-1β 蛋白的表达和细胞上清液中Caspase-1 p10、Caspase-1 p20 及IL-1β p17 蛋白的表达,从而抑制NLRP3 炎症小体的激活。
TGR5 是一种胆汁酸受体,广泛表达于人体多个器官,其通过多个效应途径将胞外信号传递至胞内的下游级联反应。已有研究证实,TGR5 能够抑制LPS 诱导的巨噬细胞细胞因子的释放,从而改善肝脏损伤[23]。而在酒精诱导的小鼠肝损伤模型中,TGR5 敲除小鼠肝脏组织中巨噬细胞的浸润和炎症显著高于野生型小鼠[24]。STAT1 和STAT6 作为STAT 家族成员之一,是细胞膜受体蛋白和效应细胞器信号传递的重要桥梁,在巨噬细胞极化中发挥着重要的作用。研究显示,STAT1 在NASH 小鼠中的表达显著上调,而抑制STAT1 的表达能够显著改善肝细胞脂肪变性、气球样变性、炎症以及内质网应激损伤[25]。与STAT1 的作用相反,STAT6能够通过抑制炎症从而保护肝细胞和内皮细胞的损伤[26]。本研究结果显示,棕榈酸还能显著上调巨噬细胞中TGR5 和p-STAT1 蛋白的表达,下调巨噬细胞中p-STAT6 蛋白的表达,而对和STAT1 和STAT6 蛋白的表达无明显影响。芪参汤和TGR5激动剂能够显著下调巨噬细胞中TGR5 和p-STAT1 蛋白的表达,上调巨噬细胞中p-STAT6 蛋白的表达,且两者作用相当。而芪参汤+TGR5 激动剂作用明显优于芪参汤和TGR5 激动剂组。
综上所述,芪参汤能够通过抑制巨噬细胞NLRP3 炎症小体的活化,从而抑制巨噬细胞M1 型极化,改善炎症反应。而芪参汤抑制巨噬细胞NLRP3炎症小体的活化的主要机制是通过抑制TGR5/STAT1/STAT6 信号通路实现的。
作者贡献度说明:
袁星星:设计实验;高佳炜和杨柳欣:执行细胞实验和指标检测;朱瑞增:负责统计分析;高山:负责文稿撰写;张雅丽:进行最后校审。
所有作者声明不存在利益冲突关系。
