川中丘陵区人工柏木林不同器官C、N、P、K 计量特征
2023-11-13刘威君陈俊华蒋川东刘一丁谢川唐艺家罗明华慕长龙
刘威君 ,陈俊华 ,蒋川东,刘一丁,谢川,唐艺家,罗明华,慕长龙*
1.绵阳师范学院资源环境工程学院,四川 绵阳 621006;2.四川省林业科学研究院/森林和湿地生态恢复与保育四川省重点实验室,四川 成都 610081
生态化学计量学是研究多重元素化学平衡的一门科学,内稳性理论和生长速率理论是生态化学计量学存在的重要基础[1-2]。C(碳)、N(氮)、P(磷)、K(钾)是地球生物圈的生命基本组成元素,尤其是C、N、P 作为生态系统最基本的组成元素和植物必需的营养元素,在生物地球化学循环和维持生态系统结构及功能稳定性方面发挥着极其重要的作用[3-4]。研究植物的C、N、P、K 化学计量特征,特别是C、N、P 含量及C/N、C/P 的关系,不但可以了解它们的生长发育过程、群落结构、多样性以及功能等,还能反映它们对环境变化的适应能力[5],有利于研究全球气候变化和国家“双碳”目标下植物的固碳增汇机制[6]。人工柏木林(Cupressus funebris)是川中丘陵区的主要森林类型,在维护该区域生态安全,发挥保持水土、涵养水源以及森林的固碳增汇等生态服务功能方面起着十分重要的作用。对于该区域人工柏木林的生态化学计量,国内专家主要从植物叶片、土壤和枯落物中的C、N、P 含量进行了研究[7-10],系统研究柏木各器官的C、N、P、K 含量及其比率关系尚未见报道。本文以川中丘陵区人工中龄柏木林作为研究对象,测定不同器官的生态化学计量指标,分析C、N、P、K 含量和比率分布格局,以期揭示该地区植物的生理特征,为人工柏木林质量和固碳增汇能力提升提供理论依据。
1 研究区概况
研究区位于四川盆地中部的金堂县、简阳市,地处亚热带湿润季风气候区,四季分明,降雨主要集中在每年的5~10 月。年均雨量1 000 mm 以上,年均气温17℃,日照数1 300 h~1 400 h,无霜期300 d 以上。土壤类型以紫色土和老冲积黄壤为主,少部分为姜石黄壤和灰白砂土。现存植被主要是20 世纪 70~80 年代长江防护林建设工程营建的人工柏木纯林和由人工桤柏混交林演变而来的柏木纯林。另有少量松柏混交(Pine-Cypress)、栎柏混交(Oak-Cypress)次生林[11-12]。
2 研究方法
2.1 样地设置与调查
2.1.1 样地设置
2021 年9—10 月,在四川盆地中部的金堂县、简阳市设置 20 m×20 m 的标准样地6 个。记录标准地的经纬度、郁闭度、海拔、土壤类型、坡度、坡向、坡位、土层厚、枯落物厚等因子。样地基本情况详见表1。
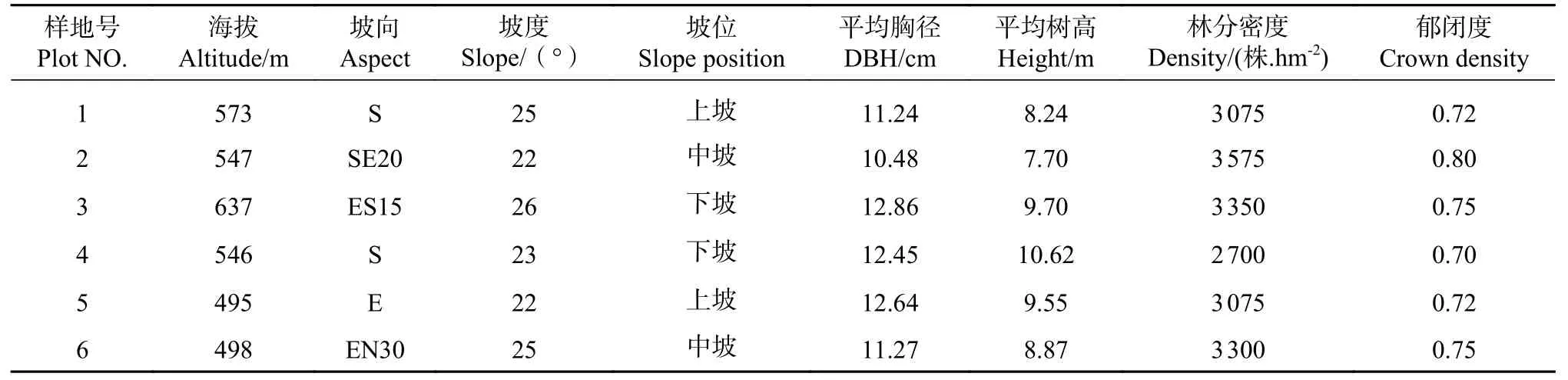
表1 样地基本情况Tab.1 Basic status of sampling sites
2.1.2 样地调查及样品采集
(1)样地调查
乔木调查:每木检尺,测定并记录树种名称、树高、胸径、冠幅等因子;
灌木调查:种名、高度、盖度、株(丛)数等因子;
草本调查:种名、高度、盖度等因子。
(2)样品采集
主要采集乔木的干、枝、叶、皮和根,其中干和皮分别从树干基部、胸径和梢头 3 个部位进行取样,枝带皮从粗枝到小枝按比例取样,叶亦分别从不同部位取样,根带皮从粗根到小根按比例分别取样。采集的样品野外称鲜质量,并取样,标记好带回实验室进行实验测定及实验分析。
2.1.3 样品处理及测定
将带回实验室的植物各器官样品置于85℃烘箱烘干至恒重,用粉碎机粉碎后过100 目筛,密封以测N、P、K、C 等元素。N 含量采用凯氏定氮法测定,P 含量采用硫酸-高氯酸消煮作目锑抗分光光度法测定,K 含量采用硫酸-双氧水消煮-火焰光度法测定,C 含量采用重铬酸钾习壳酸氧化法测定[2,13]。
2.2 数据统计与分析
运用WPS 进行数据录入、基本计算;在 SPSS 20.0 里面进行单因素方差分析(Oneway ANOVA)和多重比较(LSD,显著水平P<0.05),作图使用OriginPro 2018[11]。
3 结果与分析
3.1 不同器官化学计量特征的变异系数
不同器官化学计量特征的变异系数相差较大(见表2)。柏木叶片中N、C、P、K 含量均高于其他器官,其含量分别在9.34~18.05 g.kg-1、464.96~573.35 g.kg-1、0.46~1.04 g.kg-1、1.12~3.98 g.kg-1。干的N 含量较小,在6.33~8.17 g.kg-1,干和根的C 含量较小,分别在490.21~500.89 g.kg-1和457.20~500.09 g.kg-1。枝的P 和K 含量均最小,分别在0.17~0.37 g.kg-1和1.12~3.98 g.kg-1。从变异系数来看[2],C含量在各器官中的变异系数均在7%以下,属弱变异;N 含量除干属弱变异外,其余均属于中等变异;P 含量除在叶和枝中属于中等变异外,在干、根、皮中属强变异;K 含量表现的规律与P 含量类似。
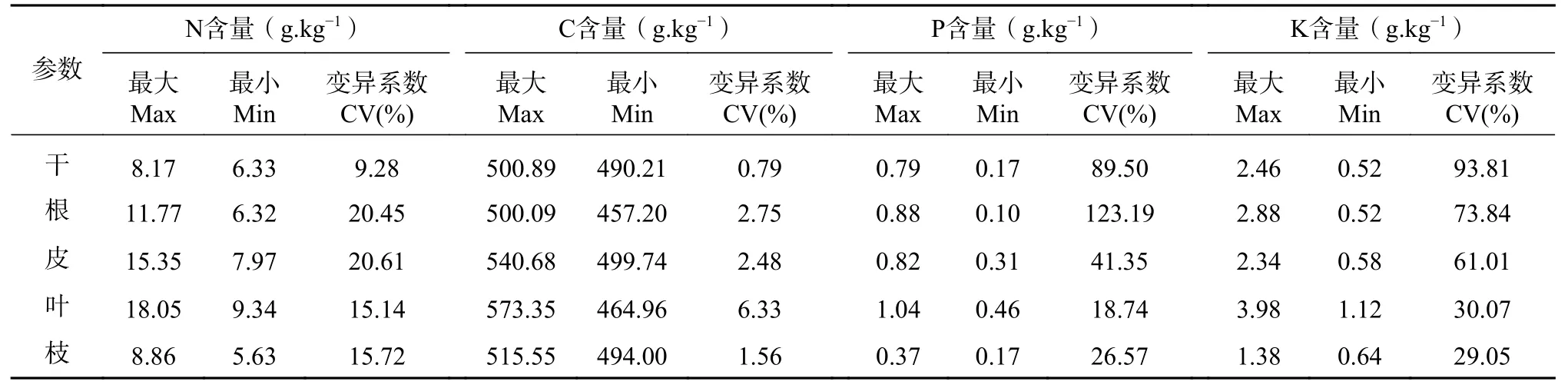
表2 不同器官化学计量特征与变异系数Tab.2 Stoichiometric characteristics and coefficient of variation of different organs
3.2 不同器官生态化学计量特征
柏木干、根、皮、叶、枝4 种元素C、N、P、K 的含量及C/N、C/P 见图1。不同器官的C 含量在491.264~518.996 g.kg-1之间。最高的是叶(518.996±32.791 g.kg-1),最低的是根(491.264±13.527 g.kg-1)各器官C 含量按大小排列为叶>皮>枝>干>根。方差分析和多重比较(LSD)表明,叶的C 含量与皮、枝差异不显著(P>0.05),与干、根的C 含量之间差异显著(P<0.05),干的C 含量与根、皮、枝的C含量之间差异不显著(P>0.05),与皮和叶之间差异显著(P<0.05)。各器官的N 含量以叶中最高(15.761±2.508 g.kg-1),最低的是干(7.421±0.702 g.kg-1)。按大小排列为叶>皮>根>枝>干。方差分析和多重比较(LSD)表明,叶和皮的N 含量与其他器官的N 含量之间差异均显著(P<0.05),干、根、枝的N 含量之间差异不显著(P>0.05)。各器官的P 元素含量以叶占绝对优势,分别为干、根、皮、枝的3.20 倍、2.87 倍、2.18 倍、3.35 倍,且除叶的P 含量与其他器官之间差异显著外(P<0.05),其余器官之间均差异不显著(P>0.05),各器官的K 元素含量表现出类似规律。C/N 最高的是枝(69.25±13.09),最小的是叶(34.05±8.41)。方差分析和多重比较表明,皮和叶的C/N 与其他器官之间差异均显著(P<0.05),干、根、枝的C/N 之间差异均不显著(P>0.05)。各器官的C/P 差异较大。其中叶的C/P 最小(602.66±208.75),分别为干、根、皮、枝的27.63%、21.97%、46.24%、30.74%。方差分析和多重比较表明,根的C/P 与干、枝之间差异不显著(P>0.05),与皮、叶的C/P 差异显著(P<0.05)。皮的C/P 与叶、枝之间差异不显著(P>0.05),叶的C/P 除与皮之间差异不显著外(P>0.05),与其他器官之间均差异显著(P<0.05)。
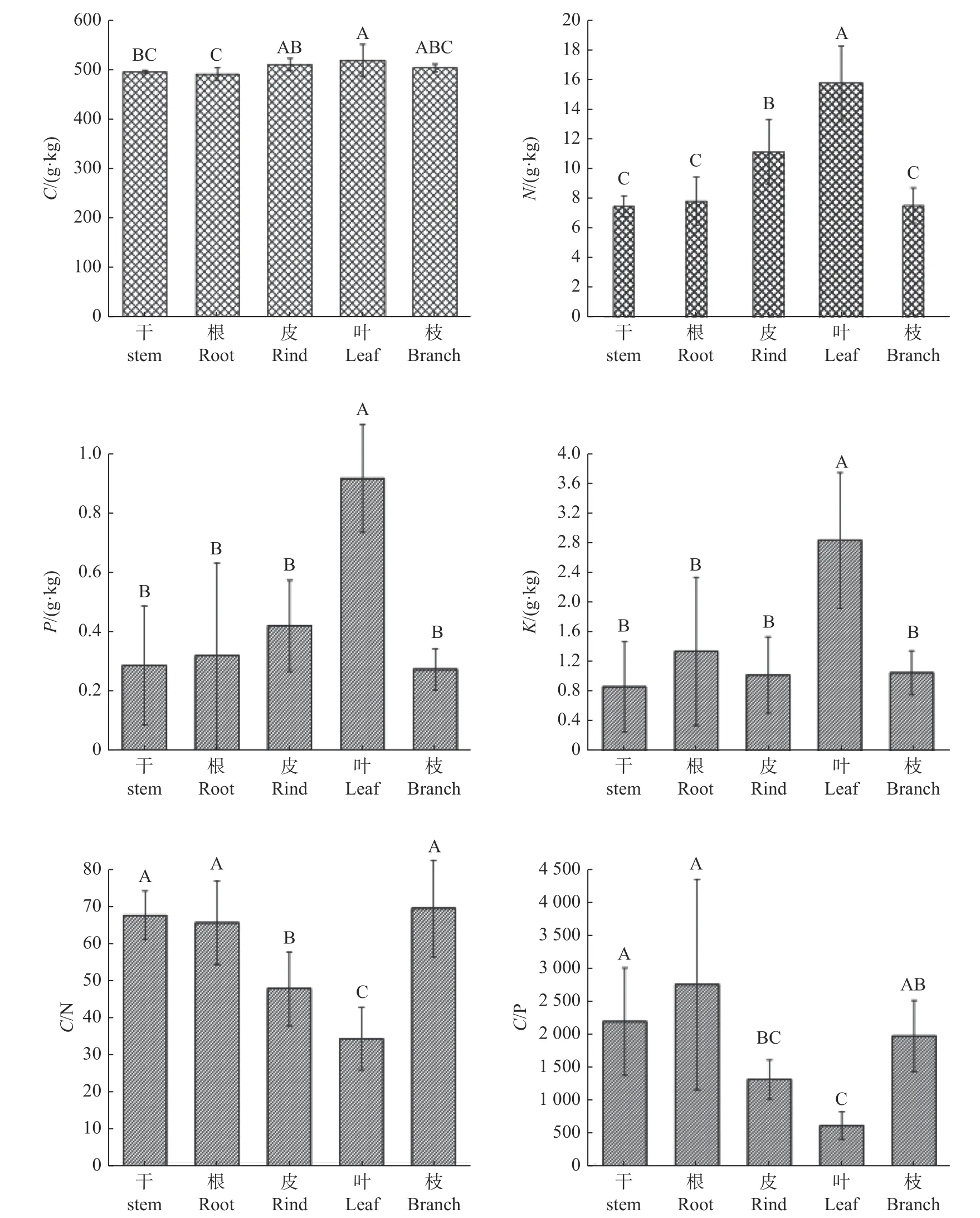
图1 不同器官生态化学计量比Fig.1 Eco-stoichiometric ratio of different organs
3.3 各器官化学计量特征与计量比的相关性
通过各器官的N 含量、C 含量、P 含量、K 含量、C/N、C/P 的相关性分析表明(表3):N 与C呈显著正相关(P<0.05),与P、K 呈极显著正相关(P<0.01),与C/N、C/P 均呈极显著负相关(P<0.01);C 含量与K 呈显著正相关(P<0.05),与C/N 呈显著负相关(P<0.05),与P 含量和C/P 均没有相关性(P>0.05);P 含量与K 呈极显著正相关(P<0.01),与C/N、C/P 均呈极显著负相关(P<0.01);K 含量与C/N、C/P 均呈极显著负相关(P<0.01);C/N 与C/P 呈极显著正相关(P<0.01)。
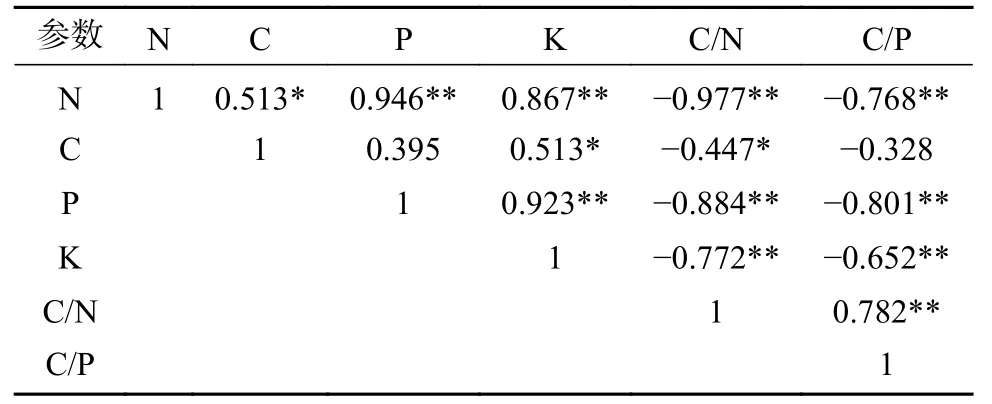
表3 含水率与化学计量比的相关性Tab.3 Correlation between water content and stoichiometric ratio
4 讨论
作为植物体内重要的生命元素,N、C、P、K 4 种元素的含量反映了植物在一定生存环境下,吸收和储存养分的能力[14-15]。尤其是C 元素,它反映的是植物积累有机物质的能力[16]。本研究中,柏木叶片C含量变化在464.96 g.kg-1—573.35 g.kg-1之间,平均值为518.996 g.kg-1,与相关研究—我国植物叶片C 含量范围在423.8—530.0 g.kg-1基本符合或略高于此标准,明显高于全球陆生植物叶片平均C 含量的标准(464 g.kg-1)[17]。与同区域相比,明显低于何瑞[7]在德阳市旌阳区柏木叶片的C 含量(599.81±4.88 g.kg-1)。这可能是因为后者是改造后补植了香椿、银木等阔叶林的缘故。柏木各器官C 含量由大到小排列为叶>皮>枝>干>根。这与李丽等[18]、霍怀成等[2]的研究结果一致。根C 含量最低,这是因为根主要进行水分和无机盐的交换,养分储存较少[2]。
N、P 元素是陆地生态系统植物生长的最重要和主要的限制元素。本研究中,柏木叶的N 含量平均值为15.76 g.kg-1,低于中国陆地植物叶片平均值(20.50 g.kg-1)[17],但明显高于宋思梦的研究结论(9.39 g.kg-1)[10];柏木叶的P 含量平均值为0.92 g.kg-1,远低于我国的平均值[17],与宋思梦的研究结论接近[10]。N 和P 元素在紫色土区相对紧缺,应合理增施N 肥、P 肥,或采取间伐补植桤木等豆科植物形成混交林,提高土壤能力,促进林地养分循环[7,10,12]。
在植物的耐旱、耐寒能力中,K 元素起着十分重要的作用,K 元素还是许多酶的活化剂,在植物竞争中起着重要的作用[19]。本研究中,K 含量在根中最高,按由高到低排列为根>叶>干>皮>枝,与霍怀成等[2]的研究结果基本一致。C/N、C/P 反映单位养分吸收所合成有机物的量[2]。本研究中C/N 最高的是枝,其次是干,最低的是叶;C/P 最高的是根,其次是干,最低的是叶。C/N、C/P 在各器官中排列规律与霍怀成等[2]的研究结果基本一致。其中C/N 平均略小于霍怀成的研究结果,但C/P 除叶片外,远高于霍怀成[2]的研究结果,说明川中丘陵区人工柏木林对C 的利用效率较强[20]。各器官C/N、C/P 均以叶片中含量最低,与国内有关专家的研究结果一致[2,21]。
C、N、P、K 及其比之间的相关性分析可以揭示森林生态系统中不同组分各生态化学计量指标变量之间的协调关系,便于对C、N、P、K 在植物各器官之间的转换及耦合过程做出合理解释[22]。本研究中,P 与C/P、N 与C/N 均呈显著负相关,且最小值均出现在叶片中,这与霍怀成[2]的研究结论是一致的。这与叶片是同化器官,N、P 含量相对比其他器官高,C 含量在各器官之间的差异相对较小的原因有关[2]。
