盐酸小檗碱通过调节自噬抑制口腔鳞状细胞癌增殖的研究
2023-11-13肖金枝
肖金枝,余 伟,张 昊
口腔癌是头颈部最常见的一种恶性肿瘤,其中90%的患者病理诊断为口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)[1-2]。目前,多数患者接受以手术为主,联合放化疗的治疗方案[3]。但因口腔癌高恶性、易复发、易引起其他脏器受损等问题[4],患者的5年生存率仅为50%~70%[2-3]。化疗是辅助肿瘤治疗的重要手段,但其在治疗过程中会产生许多不良后果,其中化疗药物的耐药性是困扰临床工作者的一大难题,克服耐药性是一项艰巨的挑战[5]。有文献指出一些化疗药物治疗多种肿瘤时可发生细胞的自噬。自噬是细胞死亡的一种方式,其能帮助细胞自我降解,参与调节物质代谢平衡,在肿瘤中发挥着双重作用,且有报道指出其与口腔鳞状细胞癌密切相关[6-8]。
随着现代医学的发展,人们对中医药的研究逐渐深入,因其具有易提取、毒性低、抑制肿瘤生长等优势,目前已有多种中药应用于抗肿瘤治疗[9]。盐酸小檗碱(berberine hydrochloride,BH)是源于中草药黄连的一种生物碱[10],目前多用于消炎杀菌,但有文献报道其能抑制多种肿瘤[11-12]。本实验通过探究盐酸小檗碱对口腔鳞癌Cal-27细胞增殖及自噬的影响,为将来盐酸小檗碱用于口腔癌治疗提供一定的依据。
1 材料与方法
1.1 材料
人口腔鳞癌Cal-27细胞(丰晖生物,中国);盐酸小檗碱(源叶生物,中国);高糖DMEM培养基、胎牛血清FBS以及胰蛋白酶(Hyclone,美国);CCK-8检测试剂盒、RIPA蛋白裂解液(碧云天,中国);瑞氏-吉姆萨染液、一抗(PCNA、Beclin-1、LC3B、β-actin)、二抗(博士德生物,中国)。
1.2 方法
1.2.1 细胞培养 将人口腔鳞状细胞癌Cal-27细胞在适宜条件下置于高糖DMEM培养基中培养。待细胞长至一定程度时,对其进行传代,取活性、形状良好的细胞用于后续实验。
1.2.2 药物配制 溶剂:DMSO及PBS溶液,利用溶剂与盐酸小檗碱融合形成母液,且保证DMSO溶剂浓度低于0.1%,将药物分装后置于-20 ℃避光储存。
1.2.3 CCK-8实验 药物浓度分组:对照组(0),盐酸小檗碱组(60、90、120、240 μmol/L)。选状态良好的Cal-27细胞,在96孔板中设计平行复孔,每孔的细胞数目为8×103个,过夜培养后,加入药物。药物作用24、48、72 h后,避光吸弃上清,加入CCK-8试剂后,培养箱中1 h进行孵育。用酶标仪检测450 nm波长处的OD值,收集3次有效数据。计算细胞存活率及IC50。根据IC50选择适宜浓度进行后续实验。为了进一步阐明盐酸小檗碱是否通过调节自噬从而抑制Cal-27细胞的增殖,使用CCK-8实验筛选适宜浓度的自噬激活剂雷帕霉素(rapamycin,RAPA)进行后续实验。设置分组:对照组(0),单独药物组(90 μmol/L BH),雷帕霉素组(50 nmol/L RAPA)以及盐酸小檗碱+雷帕霉素共同处理组(90 μmol/L BH+50 nmol/L RAPA)。
1.2.4 单克隆形成实验 在6孔板中的每孔中铺数目为4×105个细胞,放于培养箱。细胞长至75%~80%时,分别加入0、60、90、120、240 μmol/L浓度的盐酸小檗碱培养液。6 h后,消化,再以1×103个/孔种在6孔培养板中,4 d一换液。2个星期后,室温下轻柔地加入PBS溶液,晃动6孔板(1 min),弃掉清洗液,反复3次后,固定液固定(15~30 min),弃去溶液,每孔加入瑞氏-吉姆萨A、B溶液,两者混匀,染色3~5 min。冲洗干净,晾干,拍照,计数分析。
1.2.5 Western Blot检测相关蛋白表达 将4×105个Cal-27细胞接种于6孔细胞培养板,给予不同浓度盐酸小檗碱处理24 h,提取总蛋白,测浓度,变性,分装,贮藏于-20 ℃。室温下制备SDS-PAGE凝胶电泳转膜,封闭2 h,一抗4 ℃(Anti-PCNA 1∶2 000,Anti-Beclin-1 1∶1 000,anti-LC3B 1∶500)过夜孵育。次日洗膜3次。室温下二抗(1∶5 000)孵育2 h,再次清洗。显影,分析蛋白结果。
1.3 统计学分析

2 结 果
2.1 盐酸小檗碱对Cal-27细胞活性的影响
如图1所示,随着盐酸小檗碱浓度的提高,Cal-27细胞存活率逐渐降低。表明盐酸小檗碱对Cal-27细胞的抑制呈浓度依赖性(图1A)。根据实验结果算出24 h的IC50为(92±10)μmol/L。

同一时间下,不同浓度盐酸小檗碱对Cal-27细胞活性影响的量化图。与同时段对照组(0 μmol/L)相比,Tukey检验,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.0001
2.2 盐酸小檗碱对克隆形成能力的影响
如图2所示,随着药物浓度的提高,Cal-27细胞集落形成的数目逐渐降低(图2A、B)。当药物浓度逐渐上升至240 μmol/L时,Cal-27细胞培养14 d后几乎无集落形成,说明盐酸小檗碱抑制了Cal-27细胞的增殖能力。
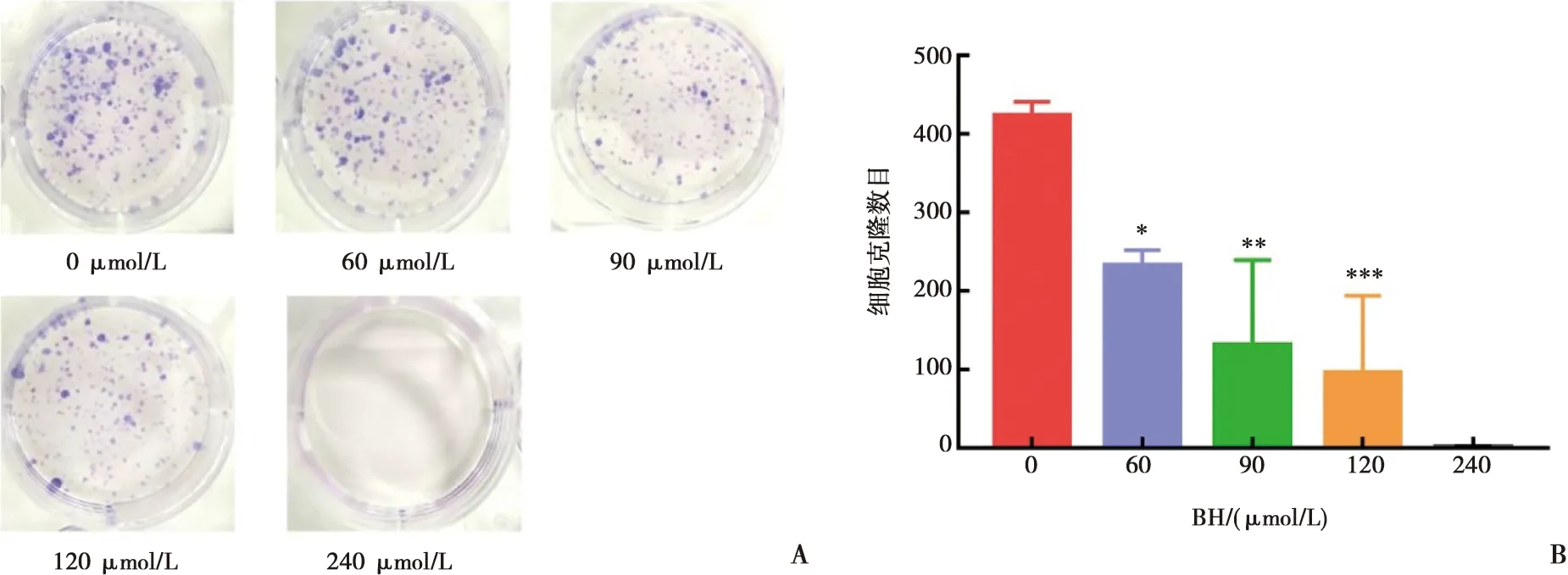
A:Cal-27细胞培养14 d平板克隆形成结晶紫染色图(相机拍照,96 dpi);B:克隆数目量化图;与对照组(0 μmol/L)相比,Tukey检验,*:P<0.05,**:P<0.01,***:P<0.001
2.3 盐酸小檗碱对Cal-27细胞增殖及自噬相关蛋白的影响
其影响如图3所示(图3A),与对照组相比,随着盐酸小檗碱浓度的提高,PCNA的蛋白量化值逐渐降低(图3B);Beclin-1蛋白量化值及LC3Ⅱ/Ⅰ的比值也逐渐降低(图3C、D),说明盐酸小檗碱抑制Cal-27细胞的增殖及自噬。

A:Western Blot实验检测细胞PCNA、Beclin-1、LC3Ⅰ、LC3Ⅱ蛋白表达情况;B:PCNA蛋白相对表达量量化图;C:Beclin-1蛋白相对表达量量化图;D:LC3Ⅱ/Ⅰ蛋白相对表达量量化图。与对照组(0 μmol/L)相比,Tukey检验,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1
2.4 盐酸小檗碱抑制细胞自噬与抑制Cal-27细胞增殖的关系
如图4所示,CCK-8结果示浓度为50 nmol/L的RAPA对Cal-27细胞的毒性较小(图4A)。与对照组相比,单独药物组(90 μmol/L BH)对Cal-27细胞的活性具有抑制作用,而当盐酸小檗碱与雷帕霉素(90 μmol/L BH+50 nmol/L RAPA)共同处理后,Cal-27细胞的活性稍有提升(图4B)。

A:雷帕霉素对Cal-27细胞活性影响的量化图;B:盐酸小檗碱与雷帕霉素分别及共同作用后对Cal-27细胞活力影响的量化图;与对照组相比,Tukey检验,**:P<0.01,****:P<0.000 1;与RAPA相比,Tukey检验,####:P<0.0001;ns:无统计学差异
克隆形成实验可以明显看出,单独药物组(90 μmol/L BH)对Cal-27细胞的克隆形成能力具有明显的抑制作用,而盐酸小檗碱与雷帕霉素(90 μmol/L BH+50 nmol/L RAPA)共同处理后,Cal-27细胞集落形成的数目多于单独药物组,说明RAPA逆转了盐酸小檗碱对Cal-27细胞增殖的抑制作用(图5A、B)。

A:加入雷帕霉素后,Cal-27细胞培养14 d平板克隆形成结晶紫染色图(相机拍照,96 dpi);B:其克隆数目量化图;与对照组相比,Tukey检验,***:P<0.001,****:P<0.000 1。与RAPA相比,Tukey检验,##:P<0.01,####:P<0.000 1;与BH相比,Tukey检验,△:P<0.05
为进一步探究盐酸小檗碱抑制Cal-27细胞的增殖与其自噬是否有关联,我们又进行了蛋白印迹实验。其结果显示(图6A),与单独药物组相比,加入雷帕霉素的共同处理组,PCNA的表达增多(图6B),并且Beclin-1及LC3Ⅱ/Ⅰ的表达也增多(图6C、D)。说明盐酸小檗碱是通过抑制自噬从而抑制Cal-27细胞的增殖。

A:Western Blot实验检测细胞PCNA、Beclin-1、LC3Ⅰ、LC3Ⅱ蛋白表达情况;B:PCNA蛋白相对表达量量化图;C:Beclin-1蛋白相对表达量量化图;D:LC3Ⅱ/Ⅰ蛋白相对表达量量化图;与对照组(control)相比,Tukey检验,*:P<0.05,**:P<0.01,***:P<0.001,****:P<0.000 1;与BH相比,Tukey检验,△:P<0.05,△△:P<0.01,△△△:P<0.001
3 讨 论
口腔鳞癌是头颈部癌的一种主要亚型,与烟草、酒精和HPV等风险因素有关,是全球最常见的12种癌症之一,并且危及生命[3]。其中化疗药物的耐药性是患者生存率低的主要因素之一。
近年来,中医药在抗肿瘤领域逐渐成为焦点,因其介入可以降低肿瘤治疗的不良反应,提高患者生活水平,并且还具有多种靶点、多条途径、多类效应等优势,逐渐成为临床抗肿瘤的一线药物[13]。先前有研究表明,盐酸小檗碱这类药物可作为抗肿瘤药[14-15],对胃癌[16]、乳腺癌[17]、鼻咽癌等具有抑制作用[12,18-19]。
本研究通过体外CCK-8实验、克隆形成实验证实一定浓度的盐酸小檗碱对口腔鳞癌Cal-27细胞活力有明显抑制作用。并通过Western Blot实验检测出盐酸小檗碱刺激Cal-27细胞后,增殖相关蛋白PCNA的表达量逐渐降低,进一步说明其对细胞增殖具有明显的抑制作用。此外,有研究学者已证实当盐酸小檗碱作用于人口腔鳞状细胞癌时能够抑制细胞的增殖,这与本研究的结果一致,但作者尚未对其作用机制深入研究[20]。
自噬是一种细胞代谢的途径,是维持细胞稳态的关键调控者。同时在过去的10年中,自噬已成为肿瘤研究中重要角色,参与肿瘤抑制和肿瘤发展[21]。其中Beclin-1是自噬的关键调控基因,在自噬体成熟过程中起作用。而LC3B是自噬的关键蛋白家族之一,其独特性在于能够定位于自噬泡膜内[22]。且LC3B的表达水平反映着细胞自噬的发生是受到抑制或诱导[23]。近年有学者指出自噬标志物LC3B可与OSCC患者预后有着密切的联系[23-25]。目前,关于盐酸小檗碱对自噬作用的研究较少,我们通过Western Blot实验检测自噬标志物Beclin-1、LC3Ⅰ、LC3Ⅱ的表达,发现单独药物组LC3Ⅱ/Ⅰ比值以及Beclin-1的表达量与对照组比较显著下调,表明自噬体的形成逐渐降低,说明盐酸小檗碱能够抑制Cal-27细胞的自噬效应。为了进一步探究盐酸小檗碱能否通过抑制自噬从而抑制Cal-27细胞增殖,我们加入自噬激活剂RAPA后,发现与单独药物组相比,共同处理组抑制Cal-27细胞增殖及自噬的效果减弱,即RAPA逆转了盐酸小檗碱对Cal-27细胞自噬及增殖的抑制作用,表明盐酸小檗碱可通过抑制细胞自噬从而抑制增殖。
基于自噬调节癌细胞增殖的具体分子机制,既往已有多项研究对其进行探索。有研究表明甘草素在体外作用于口腔癌细胞后,通过抑制AKT、mTOR的磷酸化使得PI3K/AKT/mTOR通路失活从而诱导自噬反应,进一步抑制细胞生长[26]。小檗碱作用于胃癌细胞后,阻断MAPK/mTOR/p70S6K和AKT信号通路的表达,从而诱导细胞自噬抑制其生长[27]。目前有较多研究结果发现,PI3K/AKT/mTOR是调节细胞自噬与增殖的主要信号通路之一,其中磷酸化的mTOR可影响自噬相关蛋白的表达,但盐酸小檗碱是否通过介导这条信号通路发挥抑制Cal-27细胞自噬的作用,需要我们进一步深入研究。
综上所述,本次实验证实盐酸小檗碱抑制口腔鳞癌Cal-27细胞的增殖和克隆形成,并且诱导抑制性自噬从而抑制增殖,但其具体机制尚未探究。本实验为盐酸小檗碱作为抗口腔癌药物提供一定的依据,为今后的研究提供新的思路。
