基于液相色谱-串联质谱法的胰腺导管腺癌淋巴结转移差异的血清代谢组学研究
2023-11-13黄湘平吴玲谭超超
黄湘平,吴玲,谭超超
0 引言
胰腺癌是一种消化系统常见的恶性肿瘤,因其具有早期症状隐匿、恶性程度高、预后差等特点,患者的五年生存率不到8%[1]。胰腺导管腺癌(pancreatic ductal carcinoma, PDAC)是最常见的胰腺肿瘤类型,占所有恶性胰腺肿瘤的80%~85%[2],该类患者生存率较低,确诊晚,手术切除后预后效果不甚理想,肿瘤易复发,而淋巴结转移是患者术后肿瘤复发的主要原因之一[3],因此,早期发现淋巴结转移对于改善患者预后、提高患者生存率具有重大的意义。
目前临床诊断PDAC主要通过影像学和传统的蛋白质生物标志物检查,影像学检查在PDAC的早期阶段敏感度和特异性较低[4]。代谢组学(metabolomics)是通过对参与疾病代谢的小分子物质进行研究,其价值从传统的寻找疾病诊断和预测的生物标志物到进一步进展为寻找异常的代谢通路,它能够对相对分子质量<1 000的内源性代谢物进行全面测量,是了解生理和病理反应中已知的代谢途径和生物功能改变的一种有效方法[5]。本研究拟采用代谢组学筛选出胰腺导管腺癌患者淋巴转移差异代谢物,寻找异常代谢通路,探索胰腺导管腺癌淋巴转移的潜在生物标志物,为胰腺导管腺癌淋巴结转移的早期诊断、治疗提供参考依据。
1 资料与方法
1.1 主要实验材料与仪器
甲醇(赛默飞世尔科技中国有限公司);乙腈(赛默飞世尔科技中国有限公司);蒸馏水(屈臣氏集团);EP管(湖州中锐精密科技有限公司);液相色谱质谱联用仪(美国Thermo scientific公司);液相质谱分析仪(美国Bruker公司);G-560E型漩涡振动器(美国ThermoScientific公司);低温高速台式离心机(广州吉迪仪器有限公司);-80℃超低温冰箱(山东博科科学仪器有限公司)。
1.2 研究对象
本试验采用前瞻性队列研究,收集湖南省人民医院2020年8月—2021年3月住院期间确诊为胰腺导管腺癌的血清标本40例,以及健康对照组血清标本31例。本研究经湖南省人民医院医学伦理委员会批准(批准号:{2022-}-21)。
胰腺导管腺癌患者纳入标准:(1)术后组织经病理确诊为PDAC;(2)无代谢性和免疫性疾病(如糖尿病、高血压、类风湿性关节炎、甲状腺功能亢进等疾病);(3)既往无其他恶性肿瘤病史。排除标准:(1)有过术前放化疗史;(2)病例资料缺失严重者;健康对照组:肝、肾、电解质、血糖、血脂等体检检测结果正常,无明显疾病、无胰腺相关疾病病史、无胰腺相关疾病家族史的健康成年人。胰腺导管腺癌患者是否出现淋巴结转移均经术后淋巴结组织病理结果证实。
1.3 标本采集与处理
1.3.1 标本采集 收集患者术后24 h之内采集的静脉血3~4 ml,离心取血清,术后经病理检测证实为胰腺导管腺癌(均为4℃冰箱保存不超过7天的血清样本)。
1.3.2 标本处理 吸取100 μl血清样本,加入10 μl内标(0.3 mg/ml的L-2-氯苯丙氨酸,甲醇配置),涡旋振荡10 s;加入300 μl蛋白沉淀剂即甲醇-乙腈(2:1,v/v),涡旋振荡1 min;在冰水浴中超声提取10~15 min;-20℃冰箱中静置30 min;4℃ 13 000 r/min离心15 min,取200 μl的上清液,作LC-MS分析。
1.3.3 质控的制备 QC用于评价进样前的仪器、色谱质谱系统和实验过程中系统的稳定性,确保得到的实验数据真实可靠;所有样品各吸取10 μl于EP管中,涡旋混匀10 s,分装成每管100 μl,共6管,其余步骤按照1.3.2标本处理的方法进行处理。
1.4 液相色谱-串联质谱法分析
以液相色谱-串联质谱(liquid chromatographytandem mass spectrometry, LC-MS)作为代谢物分离检测平台,研究胰腺导管腺癌患者与健康对照组血清的代谢差异,在质谱正、负离子模式下收集数据;液相色谱条件:AcclainmTMRSLC120-C18色谱柱(100 mm×2.1 mm), 柱温保持在40℃,进样量3 μl。流动相A0.1%(体积分数)甲酸/水(含2 mmol/L甲酸铵),流动相B为0.1%(体积分数)乙腈/水,梯度设置:2%B持续0~2 min,50%B持续2~12 min,90%B持续10~30 min,98%B继续持续作用30~60 min;流速维持在400 μl/min;质谱条件为:电喷雾离子源(electrospray ion source, ESI±),采用正负离子模式检测,使用高纯N2辅助喷雾电离与脱溶剂,流速为1.2 L/min,质量扫描范围20~1 000 m/z,干燥气温度200℃。
1.5 质控验证
为了检验仪器的稳定性和实验的重复性,对本次实验的6份QC样本进行了验证,验证结果提示6份QC样本的偏差均在2SD范围内,说明仪器的稳定性和实验的重复性均较好,实验数据稳定可靠且能反映不同组别之间代谢组学上的差异。
1.6 数据预处理及统计学方法
通过Metaboscape 3.0软件对原始数据进行峰提取、除噪、标准化、导出等预处理,再将数据上传至HMDB数据库进行匹配,最后得到代谢物的保留时间、质荷比、峰值等信息。
将预处理得到的数据导入MetaboAnalyst 5.0进行分析,首先对数据进行归一化处理,使分析的数据呈现正态分布,以排除个体间差异和外界多重因素的影响,使各代谢物之间在数值上具有一定可比性;通过单变量分析,采用火山图(Volcano Plot)显示两组样本的差异性代谢物,通过t检验即P<0.05和差异性倍数(FC)>1.5为标准筛选差异性代谢物;通过主成分分析(principal component analysis, PCA)来对数据进行概述和离群值检测;然后构建偏最小二乘判别分析(partial least squares-discriminant analysis, PLS-DA)模型来进行分类,并通过K折交互验证和100次置换检验对模型进行评价,了解模型的可靠性;通过PLS-DA得到的变量权重值(variable important in projection,VIP),以VIP>1.0筛选潜在的差异性代谢物;通过聚类分析评价不同代谢物的相关性及聚类程度;最终将得到的差异代谢物进行代谢通路分析。
2 结果
2.1 临床资料
胰腺导管腺癌患者的临床资料见表1,其中40例胰腺导管腺癌患者中,有淋巴结转移18例,无淋巴结转移22例。

表1 胰腺导管腺癌淋巴结转移组与无转移组临床资料比较(n(%))Table 1 Comparison of clinical information between lymph node metastasis and non- metastasis groups of patients with pancreatic ductal adenocarcinoma (n(%))
2.2 单变量分析
采用单变量统计学分析方法筛选健康对照组和PDAC患者中血清潜在差异性代谢物,在正、负离子模式下,分别筛选出123和37种差异代谢物;PDAC患者中有无淋巴结转移的潜在差异性代谢物,各自筛选出4种差异代谢物,见图1。

图1 PDAC组与健康对照组(A, B)及PDAC组中淋巴结转移与无转移组(C, D)在正负离子模式下的差异代谢物火山图Figure 1 Volcano plots of differential metabolites in PDAC and healthy control groups(A, B), lymph node metastasis and non-metastasis groups(C, D) under positive and negative ions
2.3 多变量统计分析
利用主成分分析方法对健康体检组和PDAC患者血清样本的代谢物轮廓进行分析。在正、负离子模式下,健康体检组和PDAC患者血清样本的组内代谢物差异比较小,且组间差异较显著,两组间的代谢轮廓存在明显差异;利用PLS-DA方法对两组之间的血清标本代谢物轮廓进行分析,结果显示,正、负离子模式下,二者之间的代谢组学的组间存在显著差异,见图2。
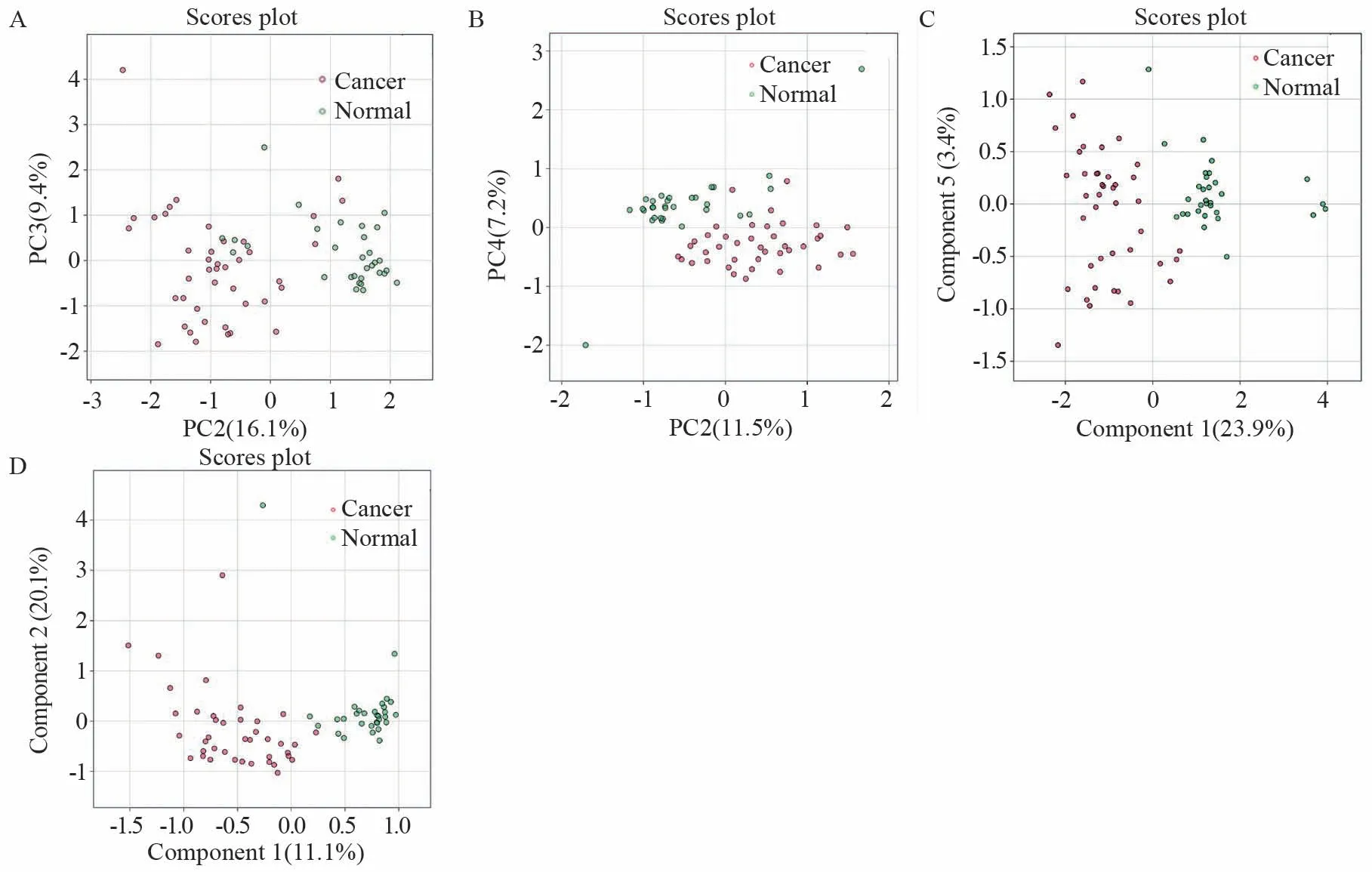
图2 胰腺导管腺癌与健康体检组多变量统计分析散点图Figure 2 Scatterplot of multivariate statistical analysis of pancreatic ductal adenocarcinoma and healthy control groups
对构建好的模型进行验证以评价模型的可靠性,以R2评价模型的解释度,Q2评价模型的预测值,在正负离子下,R2、Q2均>0.5,说明模型拟合效果好,再对模型进行100次置换检验,得到P值,P值均<0.1,提示不存在过拟合的情况。
在成功构建了正、负离子下健康体检组与PDAC患者的血清标本模型下,进一步根据VIP值来筛选潜在的差异性代谢物,在正、负离子模式下,分别筛选出差异代谢物92和46种。同样条件下,在正、负离子模式下,分别筛选出PDAC有无淋巴结转移组之间的差异代谢物12和8种。
对健康对照组和PDAC组、PDAC患者有无淋巴结转移组的血清代谢组学数据进行聚类分析,从而更加直观体现出血清差异代谢物的聚类程度。在正、负离子模式下,健康对照组和PDAC患者血清代谢物均呈现出较为明显的聚类,而淋巴结转移组与未转移组聚类效果较好。
2.4 差异代谢物以及代谢通路分析结果
最终,在成功构建了正、负离子模型下,以FC>1.5、P<0.05且VIP>1.0进行筛选。
2.4.1 健康对照组与PDAC患者血清代谢物分析结果 在正离子模式下筛选出47种差异代谢物,其中升高的有30种:3-氨基-2-恶唑烷酮、L-苯丙氨酸、乙丙嗪、3-磷酸甘油、对称二甲基精氨酸、单硝酸异山梨酯、3-羟基马尿酸、2-吡咯烷酮、4-羟脯氨酸、苯基丙酮酸、L-辛酰基肉碱、L-酪氨酸、苹果酸、硫酸吲哚酚、氢化可的酯、尿囊素、槲皮素3_-硫酸盐、D-α-氨基丁酸、L-精氨酸、4-羟基甲苯磺丁脲、磷酰胆碱、4-三甲基氨基丁酸、苯乙酸、乙基葡糖苷酸、2-丙基-2,4-戊二烯酸、半乳糖醇、3-_3-羟基苯基_-2-甲基乳酸、根皮素、鞘氨醇、2,3-丁二醇;降低的有17种:戊糖苷、前列腺素B2、加拉敏三硫醚、脯氨酸甜菜碱、丙烯酰肉碱、γ-亚麻酸、四氢脱氧皮质酮、3-羟基丁酸、α-酮异戊酸、蛋氨酸亚砜、L-脯氨酸、十一烷二酸、氧烯洛尔、维生素A、丙酮、黄嘌呤酸、3-甲基组氨酸。
在负离子模式下最终得出29种差异代谢物:升高的有10种:8-羟基韦拉平葡萄糖醛酸、丙酮酸、11-氧代雄酮葡萄糖醛酸苷、苯丙氨酸、4-乙基苯基硫酸盐、11-脱氢皮质酮、前列腺素B2、降草酸、苯甲酸苄酯、雌酮;降低的有19种:2-羟基地昔帕明葡糖苷酸、硫酸雄酮、4-乙烯基苯酚硫酸盐、丙氨酸、瓦拉尼酸、根皮素2_-O-葡糖苷酸、十五烷酸、3-硝基酪氨酸、L-组氨酸、rac-5,6-环氧-视黄酰-β-D-葡糖苷酸、2-苯基-1,3-丙二醇单氨基甲酸酯、羟基去甲基多塞平葡萄糖醛酸、5-十四碳烯酸、呋喃西林、索莱罗、6-硫尿酸、二氢黄豆苷元7-O-葡糖苷酸、二氢速甾醇、25-羟基维生素D2。
利用MetaboAnalyst 5.0对在正、负离子模式下筛选出的显著差异性代谢物进行代谢通路分析。依据KEGG数据库,匹配到了26条代谢通路,再以-log(p)>0.5且Pathway impact值>0.05筛选出11条代谢通路,见表2;从图3可以观察到两组之间差异代谢物浓度相差较大,重复性较好。

图3 PDAC患者与健康对照组之间排前五的差异代谢物Figure 3 The top five differential metabolites between PDAC and healthy control groups
2.4.2 PDAC患者有无淋巴转移两组之间血清代谢物分析结果 在正离子模式下筛选出3种差异代谢物,其中升高的有乙丙嗪(Ethopropazine),降低的有四氢脱氧皮质酮(Tetrahydrodeoxycorticoste rone)、氧烯洛尔(Oxprenolol);在负离子模式下筛选出1种差异代谢物,其中升高的是苯丙氨酸(Phenylalanine)。几种差异代谢物的ROC曲线见图4、表3,显示两组之间差异代谢物浓度相差较大,重复性较好。
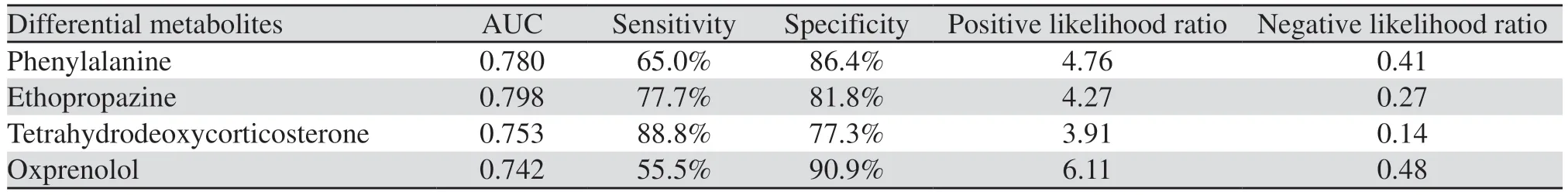
表3 胰腺癌淋巴结转移的差异代谢物的ROC诊断效能比较Table 3 Comparison of ROC diagnostic efficacy of differential metabolites for lymph node metastasis in pancreatic cancer
3 讨论
本研究基于LC-MS平台对40例胰腺导管腺癌患者以及31例健康体检组的血清学代谢组学分析,发现了76种差异代谢物和11条相关的差异代谢通路。其中戊糖苷、丙烯酰肉碱、前列腺素B2、苯乙酸、L-苯丙氨酸为排前五的血清差异代谢物,影响较大的两条代谢通路为苯丙氨酸、酪氨酸和色氨酸的生物合成和苯丙氨酸代谢,两条差异代谢通路均匹配到了苯丙氨酸、L-苯丙氨酸、L-酪氨酸三种差异代谢物。
van Dijk等[6]研究表明胰腺癌患者基础蛋白周转率明显高于健康体检组,从而在胰腺癌患者中会出现高水平的L-苯丙氨酸和L-酪氨酸,这与本实验得出的结果L-苯丙氨酸在PDAC患者中水平升高相符合,癌细胞可能通过体内高水平的蛋白合成与分解,促进癌细胞的大量增殖从而加强其对淋巴和器官的侵润能力。黏蛋白1(MUC1)是一种异常糖基化的膜结合糖蛋白,在大于80%的PDAC病例中过度表达,与不良预后相关,MUC1通过其胞质尾(MUC1-CT)信号转导并与其他致癌信号分子相互作用,促进肿瘤进展和转移;Grover等[7]研究表明MUC1-CT中的酪氨酸突变为丙氨酸能够抑制转化生长因子-β(TGF-β)诱导的肿瘤转化,本研究中出现血清酪氨酸水平的升高和丙氨酸的降低,胰腺细胞是否也可通过此种突变从而诱导肿瘤的转化尚需进一步的研究。
本研究中,丙酮酸在胰腺癌患者中处于高表达,并参与了4条差异代谢通路,糖酵解/糖代谢在胰腺癌细胞的生长中发挥重要的作用。肿瘤细胞能够在氧气充足的情况下,在相关催化酶的催化作用下消耗大量葡萄糖产生乳酸,这种现象被称为Warburg效应或有氧糖酵解[8]。研究表明[9],丙酮酸激酶M2(PKM2)在胰腺癌组织中过表达,这可能是Warburg效应发生的机制之一,同时糖酵解中高表达的关键酶如PKM2和乳酸脱氢酶A(LDHA)与胰腺癌的不良预后相关[10],这两种酶活性在胰腺癌患者的表达增加,导致患者血清代谢物丙酮酸水平升高。Jiang等[11]研究发现,胰腺癌患者LDHA的过度表达导致其丙酮酸和乳酸的水平异常,其中4种相关代谢物(葡萄糖、乳酸、丙酮酸和柠檬酸)能够作为胰腺癌的早期诊断和疗效监测的生物标志物。
在此基础上,本研究通过进一步对40例胰腺癌患者淋巴结出现转移的血清代谢组学分析,得出了四种在淋巴结转移中存在差异的代谢物,其中在淋巴结转移患者中升高的有:乙丙嗪、苯丙氨酸;降低的有:四氢脱氧皮质酮、氧烯洛尔。四种差异代谢物的AUC值分别为:0.798、0.780、0.753、0.742,可见四种差异代谢物对于区分患者淋巴结是否转移有较好的区分。苯丙氨酸的代谢能够抑制T细胞参与的免疫反应,苯丙氨酸被IL-4诱导基因1(IL4I1)编码的苯丙氨酸氧化酶氧化脱氨基,导致其减少和过氧化氢(H2O2)增加,进一步导致T细胞增殖抑制,而T细胞是机体清除癌细胞和其他异常细胞的关键,因此,癌细胞可通过大量合成苯丙氨酸,从而逃脱T细胞的清除[12]。同时,苯丙氨酸作为一种在原发性肿瘤中高度存在的保护性氨基酸,能够加强肿瘤的浸润和转移的能力[13],而在本研究中,苯丙氨酸在淋巴结转移患者中水平明显升高,因此,苯丙氨酸可以作为二者之间一种较好的潜在标志物。有研究表明[14]乙丙嗪能够促进小细胞肺癌中癌细胞的增殖,其可能的机制为乙丙嗪通过促进胆碱转运体CTL1对乙酰胆碱的合成作用,从而为癌细胞的大量增殖提供物质基础,而在本研究中,乙丙嗪在淋巴结转移患者中的水平高于未转移组,其具体的作用机制尚未明确,是否有可能通过这一机制导致癌细胞出现淋巴结的转移需待进一步的研究;在本研究中,四氢脱氧皮质酮在淋巴结转移组处于低水平,代谢重编程为癌细胞的特性之一,各种因子,如信号蛋白(S)、miRNA和转录因子(TFs),通过加强蛋白质-蛋白质相互作用以及代谢酶相互作用,在改变癌细胞的代谢状态中发挥重要作用;有研究发现[15]子宫颈癌代谢物(L-赖氨酸和四氢脱氧皮质酮)可在多种信号蛋白调节代谢酶的作用下改变代谢物的状态,这些信号蛋白是否可在PDAC患者中通过改变癌细胞的代谢状态,从而加强癌细胞的增殖以及转移尚需证实。
关于PDAC的发生、发展以及预后相关的机制,尚需进一步的研究,后续有望通过补充患者的胰腺癌组织标本,对PDAC患者的代谢组学进行更深一步的研究,寻找到更加有意义的生物标志物,为PDAC的治疗提供新靶点。
利益冲突声明:
所有作者均声明不存在利益冲突。
