乙肝肝硬化患者腰大肌指数与肝功能的相关性分析*
2023-11-13王晓娟王继涛贾林燚高凤霄
王晓娟 王继涛 贾林燚 高凤霄,*
1.河北省邢台市人民医院CT/MRI科 (河北 邢台 054000)
2.河北省邢台市人民医院肝胆外科 (河北 邢台 054000)
肝硬化是世界范围内死亡的主要原因,该病严重影响患者的生活质量[1]。目前,Child-Turcotte-Pugh (CTP)评分被认为是预测肝硬化患者死亡率的最佳工具,CTP评分可以简单地从临床和当前的实验室数据中获得[2]。骨骼肌减少症是一种老年综合症,以骨骼肌质量和力量的进行性和全身性损失为特征,欧洲关于骨骼肌减少症共识建议当同时存在低肌肉质量(low muscle mass,LMM)和低肌肉力量时诊断为骨骼肌减少[3-4],同时,LMM的识别也使临床医生能够通过营养不良全球领导倡议(global leadership initiative on malnutrition,GLIM)评定营养不良的标准即GLIM标准来诊断营养不良[5],因此,LMM的识别在骨骼肌减少症和营养不良领域至关重要。
在临床工作中,计算机断层成像(computed tomography,CT)是临床检测肝硬化常用手段,有研究利用CT评估肝脏体积分析肝脏体积与肝功能之间的关系[6-7],CT图像评估肌肉质量则会更充分地利用CT图像,其中CT测量第三腰椎的骨骼肌面积并用身高进行标准化即腰3骨骼肌指数(skeletal muscle index,SMI)是一种精确、有效的全身肌肉量的指标[8],北美肝移植中心列出的肝脏移植患者中,建议的男性SMI <50cm2/m2和女性SMI <39cm2/m2的截断值[9]。但是,该方法需要利用软件测量,方法比较繁琐,较难推广于临床,而有研究证明腰大肌指数(psoas muscle index,PMI)可以预测肝硬化患者预后[10],因此本研究的目的是分析腰大肌指数和肝功能评分的关系,以讨论身体营养情况与肝功能之间关系。
1 材料与方法
1.1 研究对象收集2019年1月1日至2021年3月30日期间在邢台市人民医院就诊的乙肝肝硬化患者,包括肝硬化代偿期及肝硬化失代偿期的患者。诊断依据依靠肝硬化诊治指南。
纳入标准:所有乙肝肝硬化患者符合《慢性乙型肝炎防治指南(2019年版)》中相关诊断标准[11],代偿期及失代偿期诊断依据符合《肝硬化诊治指南》相关诊断标准[12];CT检查与血化验检查时间差小于两周,并且CT检查包括第3腰椎层面,所有患者临床资料及化验资料齐全。排除标准:CT扫描未至第3腰椎水平或者该层面有伪影,难以测量腰大肌面积;合并恶性肿瘤或可疑恶性肿瘤;肝移植、经颈静脉肝内门腔静脉分流术或肝次全切除手术史。
1.2 仪器与方法采用西门子公司的双源CT(西门子 SOMATOM Definition Flash)行腹部CT扫描,管电压80~120kv,管电流自动调制,层厚5mm,层间距5mm,扫描结束重建1.00mm轴位图像并导入西门子后处理工作站,由两名经验丰富的影像科主治及以上医师测量第3腰椎水平近椎板层面双侧腰大肌面积,如图1所示,测量三次,求其平均值,按身高标准化,单位为cm2/m2;两名影像科大夫均对患者的分组情况不知情。

图1 腰大肌面积的测量方法
记录研究对象的性别、年龄、身高、体重、体质量指数(body mass index,BMI)、实验室检查结果,计算CTP评分及肝功能分级。CTP评分如表1。

表1 CTP评分标准
1.3 统计学分析采用SPSS 23.0统计学分析软件,符合正态分布的计量资料以()表示,行两独立样本t检验,不符合正态分布的计量资料以中位数和四分位数间距[M(P25~P75)]表示,行Mann-Whitney U 检验;采用χ2检验比较计数资料,以Spearman相关分析PMI与临床特征的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象一般资料本研究一共纳入129人,其中男79人,女50人,年龄53(45~60)岁,身高1.68(1.6~1.73)m,BMI为24.69±3.43kg/m2,高血压患者27人,糖尿病患者23人,同时患有高血压和糖尿病10人,Child-Pugh评分为8(6~10),Child-Pugh A、B、C分别为47人、49人、33人,PMI指数为5.73±2.83cm2/m2,如表2所示。

表2 临床特征
2.2 腰大肌指数与肝功能的相关性本研究指出PMI与年龄、BMI、白蛋白、Child-Pugh评分和分级相关,相关系数分别为-0.327、0.263、0.250、-0.21和-0.179;PMI与肝功能评分和分级呈弱负相关,如表3所示。

表3 PMI与临床特征的相关性
2.3 肌少症患者的临床特征分析本研究采用同为亚洲人口的日本和韩国的PMI截断值,日本PMI截断值男性6.4cm2/m2,女性3.9 cm2/m2为截断值[13],韩国PMI截断值男性5.9cm2/m2,女性4 cm2/m2截断值[14],分别利用日本和韩国的PMI截断值将患者分为肌少症组和非肌少症组,比较两组临床特征的差异,在利用日本截断值时,肌少症共58人,患病率为44.96%,肌少症组年龄显著高于非肌少症组,肌少症组男性、糖尿病及高血压比例高于非肌少症组;在利用韩国截断值时,肌少症共为45人,患病率约为34.89%,肌少症组年龄也显著高于非肌少症组,肌少症组糖尿病比例高于非肌少症组;无论利用日本PMI截断值还是韩国PMI截断值,肌少症组和非肌少症之间Child-Pugh评分和分级差异均无统计学意义,如表4和表5所示。
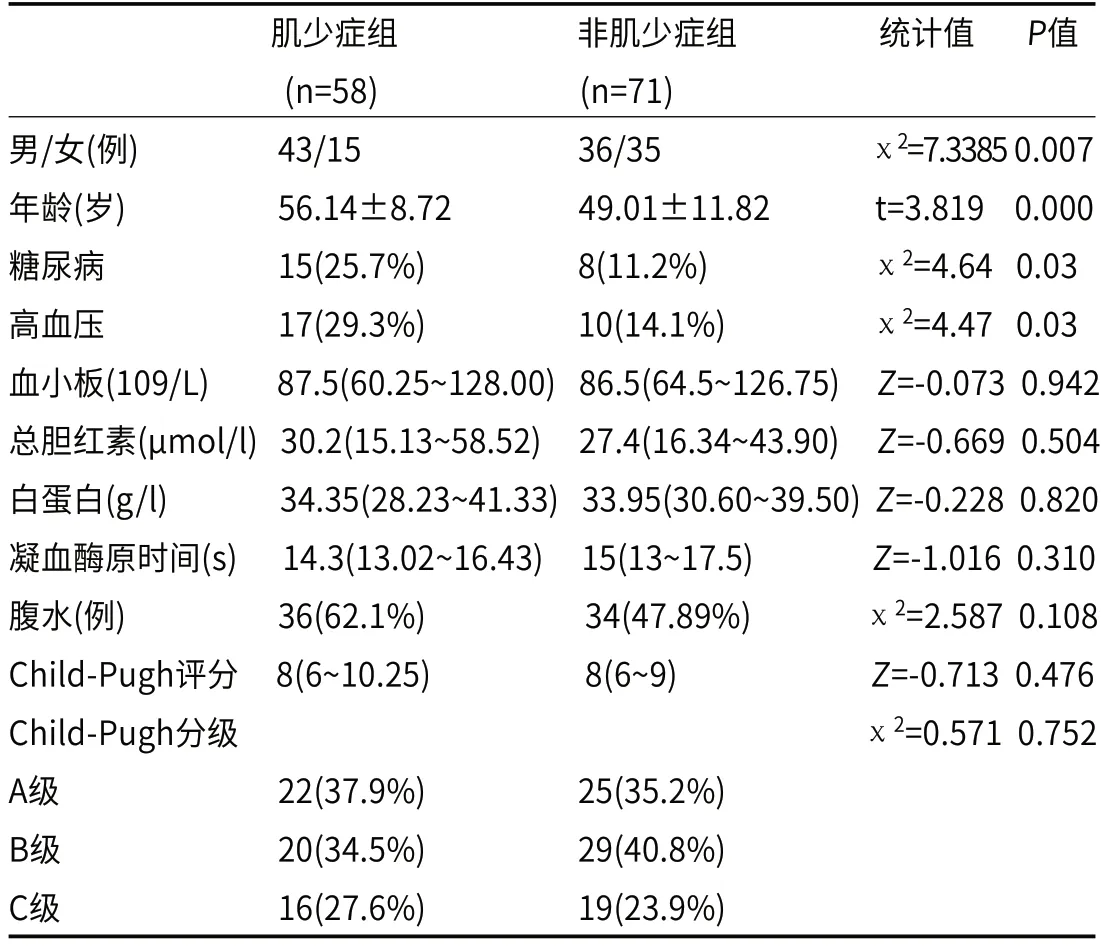
表4 日本PMI截断值时肌少症组与非肌少症组基线特征比较

表5 使用韩国PMI截断值时肌少症与非肌少症临床特征比较
3 讨论
本研究指出肝硬化预后因素的CTP评分与PMI之间呈弱负相关,PMI与年龄、BMI、白蛋白、Child-Pugh评分和分级相关,其中以年龄的相关性最强,当本研究以不同的PMI截断值进行分组时,Child-Pugh评分和分级在肌少症组和非肌少症组差异无统计学意义。
在20世纪80年代,肌少症首次被描述为与年龄相关的肌肉质量减少和功能损失[15],有研究指出大于60岁以上的人群中L3-SMI急剧下降[16],而且一项基于社区的研究指出60岁以上人群中肌少症的发病率为9.5%[17],但是基于不同的截断值对患病率有一定的影响,除此之外,肌少症的患病率也取决于环境,与社区相比,在住院、急性期后护理环境或疗养院的患者肌少症的发病率更高,是老年人摔倒的危险因素,本研究中指出PMI与年龄的相关性最强,衰老导致肌肉质量减少的机制尚未完全被理解,但是衰老似乎会导致肌肉蛋白质合成和分解代谢途径之间的失衡,导致骨骼肌的整体损失。
骨骼肌减少症的截断值是具有性别差异的,之前有研究利用腰大肌厚度评价肝硬化预后,但该研究共用一个截断值[18],但是随着研究的进展,越来越多的证据表明认识骨骼肌减少症的性别差异的重要性[19-20]。有研究指出肌少症在男性肝硬化中患病率更高[19],与使用日本截断值时研究结果一致,但当使用韩国PMI截断值时肌少症组和非肌少症组男性构成比差异无统计学意义。
骨骼肌减少症是肝硬化的常见并发症,总患病率为37.5%[21],与本研究骨骼肌减少症的患病率相近。许多因素诱发肝硬化相关的骨骼肌减少,包括营养摄入和合成减少、蛋白质代谢异常、体力活动不足等。CTP评分是预测肝硬化患者死亡率的最佳工具,它可以从临床数据中获得,但是CTP评分缺少对营养评价和身体状态的评估,虽然骨骼肌减少症的定义是同时满足肌肉质量减少和肌肉力量减少,但是在肝硬化中,大多数研究将骨骼肌减少症简化为肌肉质量的损失,CT的横断面影像评估是最有效、准确和客观的肌肉减少症评估工具[22],其中PMI是评估肌肉质量减少的一种方法,本研究中Child-Pugh评分与PMI呈弱负相关,r=-0.21,P=0,017,这与Kang等的研究结果一致r=0.04,P=0.398[23],这证实肌少症与肝脏的严重程度无关,它只是反映了肝硬化患者的营养和身体状况。
本研究发现Child-Pugh分级在肌少症患者和非肌少症患者中差异没有统计学意义,这与Hiroki Nishikawa等人的研究结果一致,该研究证实无论在男性还是女性患者中SMI与肝功能分级之间无相关性[24],还有一些研究也没有发现肌少症与肝功能分级之间存在关系[25-27],但是一项Meta分析指出在Child-pugh C级中骨骼肌减少症发病率高于Child-pugh A和B级[21],国内学者研究发现SMI与肝病严重程度相关,低SMI 组患者 90 天生存率低于高SMI 组患者,但差异未见统计学意义[28],研究结果的不一致性可能与不同的截断值有关。
本文具有一定的局限性,第一,本研究是横断面研究,没有提供PMI对肝硬化患者预后价值;第二,本研究利用的是日本和韩国的截断值,虽然都是亚洲人种,但不同的饮食习惯和生活习惯对骨骼肌质量有一定的影响;第三,本研究没有分析研究对象的运动情况、饮食状态对骨骼肌质量的影响。
总结,PMI可以反应身体的营养状况,作为肝硬化的预后因素,它与肝功能评分和分级之间具有弱负相关性,但是在肌少症和非肌少症患者中肝功能评分和分级无差异。
