橡胶树胶乳HbHSP90.6基因克隆、表达与亚细胞定位分析
2023-11-11刘明洋代龙军王立丰郭冰冰
刘明洋,杨 洪,代龙军,王立丰,郭冰冰
农业农村部橡胶树生物学与遗传资源利用重点实验室/省部共建国家重点实验室培育基地-海南省热带作物栽培生理学重点实验室/农业农村部儋州热带作物科学观测实验站/中国热带农业科学院橡胶研究所,海南海口 571101
热休克蛋白90(heat shock protein 90, HSP90)是一类重要的分子伴侣,其影响多种客户蛋白的构象来调节动物细胞的生长发育和先天免疫反应[1]。此外,HSP90还通过调节细胞蛋白质稳态参与植物在正常和胁迫条件下的生长发育[2]。过表达GmHSP90降低拟南芥在热、渗透和盐胁迫诱导下的损伤[3]。遗传分析表明,HSP90是植物抗性R基因介导的免疫反应所必需的[4]。植物缺失HSP90蛋白会降低拟南芥RAR1对R基因介导的免疫功能[5]。同时,AtHSP90也被报道在高温下调节植物的生长发育。在短暂的热休克处理中HSP90的mRNA水平增加,使拟南芥花朵停止发育的趋势减弱,表明HSP90在植物生殖过渡和花的发育过程中发挥重要的作用[6]。HSP90还通过抑制某些目标蛋白的突变来缓冲植物的表型变异。在拟南芥中抑制HSP90基因的表达后,拟南芥的tir1-1突变体会导致拟南芥根部生长缺陷[7]。此外,格尔德霉素(GDA)作为HSP90的体内外抑制剂被广泛应用。外源施用格尔德霉素可导致多种发育表型,如生长迟缓和叶片卷曲[8-9]。为了使植物能够适应不断变化的环境,植物激素及其相互间的信号传递在整合内外信号中起着关键作用[10]。格尔德霉素抑制HSP90中ATP酶活性后会引起BES1的过度磷酸化,并破坏油菜素内酯(BR)响应基因的表达,表明HSP90在BR信号通路中被证明是维持BES1去磷酸化状态所必需的[11]。生长素和茉莉酸的激素受体成分也被确定为HSP90伴侣系统的客户,这表明HSP90直接依赖于激素信号转导[12]。HSP90基因在模式植物中的功能已得到广泛研究,而其在橡胶树中的功能鲜有报道。
大戟科橡胶树(Hevea brasiliensisMüll. Arg.)是生产天然橡胶(顺-1,4-聚异戊二烯,NR)最可靠的来源,天然橡胶的合成和储存在橡胶树乳管细胞[13]。橡胶树的树皮每2~3 d切除1次,切断乳汁管环以使乳胶流出,每棵树从乳汁管中排出几十到几百毫升的胶乳,用于可持续的橡胶生产[14]。然而,我国橡胶树植胶区位于热带北缘和南亚热带地区,经常遭受台风、寒潮和干旱的影响[15]。橡胶树无性系维管形成层乳汁管环的分化不仅受环境条件的影响,还受基因控制。因此,选育抗逆高产的橡胶树无性系是橡胶树育种的重要目标。为解析HSP90基因在橡胶树中的抗逆功能,本研究分析乙烯、茉莉酸、生长素和油菜素内酯激素以及机械伤害处理对HbHSP90.6基因表达的影响,并构建植物顺时表达载体转化烟草分析其亚细胞定位,为深入揭示橡胶树胶乳HbHSP90.6基因在激素信号通路和胁迫反应机制中的功能奠定基础。
1 材料与方法
1.1 材料
1.1.1 植物材料 本研究所用的橡胶树种植于中国热带农业科学院试验场三队的10 a树龄正常割胶巴西橡胶树无性系热研73397。用于瞬时基因表达试验的本氏烟草种子来源于本实验室。
1.1.2 菌株与试剂 所用绿色荧光融合表达载体pGREEN由本实验室保存;Trans1-T1 Phage Resistant化学感受态细胞购自TRANS生物公司;农杆菌GV3101菌株购自唯地生物公司;连接试剂盒(零背景pTOPO-Blun Simple闪电克隆试剂盒)购自金百特生物公司;多糖多酚植物总RNA提取试剂盒购自TIANGEN公司;反转录试剂盒RevertAid First Strand cDNA Synthesis Kit购自Thermo;荧光定量试剂盒ChamQ Universal SYBR qPCR Master Mix和产物回收试剂盒FastPure Gel DNA Extraction Mini Kit均购自Vazyme公司;质粒提试剂盒E.Z.N.A Plasmid Mini Kit I购自OMEGA公司。
1.2 方法
1.2.1 材料处理 选取橡胶树品种热研73397的根、花、枝、茎、叶和胶乳作为HbHSP90.6基因克隆和不同组织的表达量分析材料。不同的激素和胁迫按照以下方法:配制1.5%(V/V)乙烯利(ethephon, ETH)、200 μmol/L茉莉酸(jasmonic acid, JA)、66 μmol/L吲哚-3-乙酸(3-indoleacetic acid, IAA)、1 μmol/L油菜素内酯(brassinosteroids,BR),用毛刷均匀涂在橡胶树割线上下约2 cm割面上。橡胶树的伤害处理是在割线下方3 cm处,沿割线每隔5 cm按下一个大头钉,图钉一直保留到采样结束。以0.05%(V/V)乙醇溶液为对照,处理和对照分别在0、3、6、12、24 h同步采集胶乳,滴落的胶乳均用液氮速冻收集,后保存在-80 ℃冰箱中备用。以上每种处理均设3次重复。
1.2.2 RNA的提取和cDNA的合成 胶乳总RNA的提取参照刘明洋等[16]的方法进行提取,RNA反转录cDNA方法按照Thermo反转录试剂盒实验步骤进行,反转获得的cDNA均稀释到100~200 ng/μL,保存在-20 ℃冰箱后用于基因克隆和荧光定量分析。
1.2.3 荧光定量PCR分析 采用软件primer premier 6.0设计HbHSP90.6基因的qRT-PCR引物(QF: GGTATCGGCATGACCAAGG,QR: TCCG CTACAAGGTAAGCAGAGT),以反转录的cDNA为模板,HbActin基因为内参(F: GATGTGG ATATCAGGAAGGA, R: CATACTGCTTGGAGCA AGA),采用SYBR Green法在Bio-Rad公司的CFX实时荧光定量PCR仪中进行扩增,分析扩增完成后所获得的溶解曲线图和Cq值。基因相对表达结果在Excel 2016软件用2-ΔΔCT法[17]进行分析计算。使用SPSS Statistics 25(IBM)进行单因素ANOVA检验分析差异显著性。采用Origin 2018(Origin Lab Corporation)软件制图。
1.2.4 生物信息学分析 在NCBI蛋白数据库(http://www.ncbi.nlm.nih.gov/guide/)下载拟南芥、水稻的氨基酸序列用于多序列比对和系统进化树分析;用NCBI Conserved Domains(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi?)分析保守结构域;用ExPASy ProtParam(web. expasy.org/protparam/)在线软件分析HbHSP90.6理化性质;用DeepLoc1.0(www.cbs.dtu.dk/services/DeepLoc/)在线软件进行亚细胞定位预测。
1.2.5HbHSP90.6基因克隆和植物瞬时表达载体构建 在橡胶树基因组中获得HbHSP90.6基因序列,设计HbHSP90.6基因特异性引物(F: GC GCTCTTTGCTTCG, R: CCCTGAAATCGGGTA)。以反转录得到的橡胶树热研73397胶乳cDNA为模板,按照高保真酶试剂盒说明书进行扩增,PCR扩增产物纯化后连接pESI-Blunt vector平末端载体转化DH5α感受态细胞,经PCR检测后挑取阳性克隆菌落送测序确认。结合pGREEN载体图谱及去除终止密码子后的HbHSP90.6的核酸序列,通过CD designV1.04软件设计带有HindⅢ和BamHⅠ酶切位点插入片段的同源重组引物(GF:gtcgacggtatcgataagcttATGGCGGATGTGAAGATG GC, GR: tttactcatactagtggatccGTCTACTTCCTCC ATCTTGCTCTCC),以HbHSP90.6质粒为模板进行PCR扩增,同时对表达载体pGREEN进行双酶切。将扩增目的条带和载体酶切产物按Vazyme胶回收试剂盒说明书(FastPure Gel DNA Extraction Mini Kit)进行回收纯化,获得的胶回收产物通过同源重组体系连接后转化DH5α感受态细胞,在含有Kana抗性的LB平板上培养。测序验证后提取质粒电击转化农杆菌GV3101,菌液和甘油1∶1的比例混匀保存-80 ℃冰箱备用。
1.2.6HbHSP90.6基因亚细胞定位 将PCR检测为阳性的农杆菌单菌落加入5 mL LB液体培养基(50 mg/L Rif+100 mg/L Kana)28 ℃振荡培养至OD600=0.8后收集菌体,再吸取100 µL基因的菌液到含有50 mL LB培养基(50 mg/L Rif+100 mg/L Kana)的三角瓶中振荡过夜培养。在室温条件下3200g离心10 min,弃上清收集菌体,用重悬液(1/2 MS,pH 5.7)重悬菌体,静置2 min,弃上清,用侵染液(10 mmol/L MES、10 mmol/L MgCl2、150 µmol/L乙酰丁香酮)重悬菌体至OD600=0.6,避光静置2 h。选择长势一致的5~6周龄本氏烟草提前浇足水暗培养1 d,用1 mL无菌注射器吸取菌液从烟草叶片背面注射,烟草注射后24~48 h内观察,观察时撕取叶片表皮用4,6-二脒基-2-苯基吲哚(DAPI)进行染色,用0.9%生理盐水洗涤后用盖玻片盖好,用蔡司LSM 880激光共聚焦显微镜在波长为488 nm的激发光下观察绿色荧光信号,拍照并保存实验结果。
2 结果与分析
2.1 生物信息学分析
序列分析表明HbHSP90.6的编码区(CDS)为2112 bp(GenBank登录号:OP375588)。理化性质分析表明其分子量(MW)为80 774.85 Da,等电点(pI)为5.04,不稳定系数为38.98,总平均亲水性为-0.610,推测该蛋白是一个稳定的亲水蛋白。保守结构域分析和多序列比对结果显示,HbHSP90.6含有PTZ00272结构域,且包含高度保守的MEEVD基序(图1)。DeepLoc1.0预测分析显示,HbHSP90.6蛋白92.8%定位在细胞质(图2)。
2.2 进化分析
为揭示HbHSP90.6的进化特征,将其已报道的拟南芥和水稻的HSP90蛋白构建进化树(图3)。结果表明,HSP90蛋白被聚为5支,其中HbHSP90.6与拟南芥AtHSP90.1(NM_124642.4)和水稻OsHsp90-1(LOC_Os04g01740)聚在一起,同源性分别为92.34%和86.44%。

图3 HbHSP90.6与拟南芥和水稻HSP90蛋白的进化分析Fig. 3 Phylogenetic analysis of HbHSP90.6 and HSP90 proteins in Arabidopsis and rice
2.3 基因克隆和植物瞬时表达载体构建
以橡胶树热研73397胶乳cDNA为模板进行HbHSP90.6基因全长克隆,获得单一条带,长度为2196 bp(图4B),经测序验证成功克隆HbHSP90.6基因。结合pGREEN表达载体图谱(图4A),以HbHSP90.6质粒为模板PCR扩增得到的产物与双酶切后的表达载体pGREEN进行连接,经菌落PCR验证和测序,结果表明成功构建35S::HbHSP90.6::GFP融合表达载体(图4C)。

图4 HbHSP90.6过表达载体构建Fig. 4 Construction of HbHSP90.6 overexpression vector
2.4 HbHSP90.6基因表达分析
2.4.1HbHSP90.6基因的组织表达分析 采用实时荧光定量PCR对HbHSP90.6基因在橡胶树的根、花、枝、茎、叶和胶乳中进行基因表达分析。结果表明(图5),HbHSP90.6在橡胶树的不同组织中均有表达,但表达量差异显著,HbHSP90.6在胶乳中的基因表达量显著高于根、花、枝、茎、叶,HbHSP90.6基因在胶乳中的表达量相对于花达到283倍,推测HbHSP90.6基因主要在胶乳中起作用。
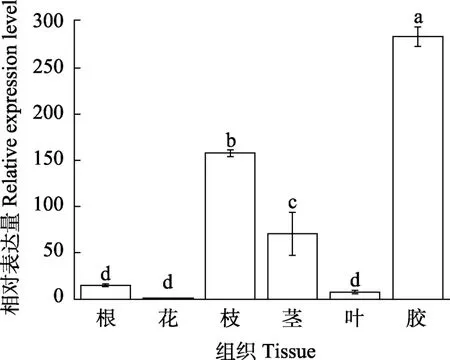
图5 HbHSP90.6基因在橡胶树不同组织中的表达分析Fig. 5 Expression analysis of HbHSP90.6 gene in different tissues of rubber trees
2.4.2 机械伤害处理对HbHSP90.6基因表达的影响 机械伤害会引起橡胶树胶乳细胞内氧化应激,严重时会导致胶乳停止流动。通过qRT-PCR分析机械伤害对HbHSP90.6基因在胶乳中表达的影响,结果表明,伤害处理明显上调了HbHSP90.6基因的表达,在12 h上调最显著,是处理前的19倍左右(图6)。

图6 机械伤害处理对HbHSP90.6的表达调控分析Fig. 6 Analysis of regulation of HbHSP90.6 expression by mechanical wounding treatment
2.4.3 激素处理对HbHSP90.6基因表达的影响植物激素在橡胶树胶乳代谢调控中发挥重要作用[18]。利用qRT-PCR分析HbHSP90.6基因在ETH、JA、IAA和BR处理下的表达模式(图7)。结果表明,HbHSP90.6基因的表达显著受乙烯利和茉莉酸调控,在6 h时表达量达到最高,分别是处理前的45倍和17倍。吲哚-3-乙酸处理后,HbHSP90.6基因的表达也显著上调。油菜素内酯处理后,HbHSP90.6基因表达量在处理12 h时显著上调表达,是处理前的50倍。整体而言,4种植物激素对HbHSP90.6基因表达都呈现显著上调表达趋势。

图7 激素处理下HbHSP90.6的表达规律Fig. 7 Expression pattern of HbHSP90.6 under different hormone treatment
2.5 亚细胞定位
将构建成功的35S::HbHSP90.6::GFP融合表达载体侵染本氏烟草,在强启动子的驱动下HbHSP90.6与GFP融合在本氏烟草中瞬时表达。在激光共聚焦显微镜下观察烟草表皮细胞的绿色荧光信号以及通过DAPI染色观察细胞核的位置。结果显示,488 nm的激发光下可观察到绿色荧光信号在HbHSP90.6的细胞质和细胞核上均有分布,对照组GFP激发出的荧光信号在烟草细胞表皮中普遍存在(图8)。

图8 HbHSP90.6亚细胞定位Fig. 8 Subcellular localization of HbHSP90.6
3 讨论
巴西橡胶树是主要的天然橡胶生产植物,橡胶树的健康生长是获取胶乳的不断来源。然而,橡胶树生长环境错综复杂,面临着各种环境胁迫的威胁,影响着橡胶树的生理代谢过程,进而影响胶乳的产量。HSP90是一种进化高度保守的多效性分子伴侣,对真核生物在生理和应激条件下的生存至关重要[19]。HSP90异构体在细胞总蛋白中占1%~2%,在不同类型的应激下,这一比例可增加到4%~6%[20-21]。在植物中,HSP90直接或间接地参与了从植物生长发育到非生物和生物胁迫反应以及激素信号传递[22-24]。本研究从橡胶树胶乳中克隆HbHSP90.6基因,该基因含有PTZ00272的结构域和包含高度保守的MEEVD基序,属于HSP90家族[25]。进化树分析表明HbHSP90.6基因的氨基酸序列与已报道的拟南芥AtHSP90.1(NM_124642.4)和水稻OsHsp90-1(LOC_Os04g01740)具有较高的同源性,推测同源性较高的基因可能执行相似的生物学功能。组织表达分析显示HbHSP90.6基因主要在胶乳中表达,推测HbHSP90.6基因可能参与乳管胞内运输和胶乳代谢调控。
胶乳开采是获得天然橡胶的唯一途径,采胶的方式割胶对橡胶树是一种不可避免的机械伤害,机械伤害影响橡胶树的乳管细胞的生长发育进而影响胶乳的再生能力[26]。本研究结果显示HbHSP90.6基因响应机械伤害处理,推测HbHSP90.6基因参与机械伤害调控的橡胶树生理与代谢活动反应。植物激素在植物的生长发育过程中协调其他因子参与胁迫修复发挥重要作用。乙烯利和茉莉酸参与植物对病原菌攻击的防御反应,并且其是系统性损伤反应的主要因素[27-28]。本研究结果显示,HbHSP90.6基因在ETH和JA处理下呈现先上升后下调的趋势,与HSP90在拟南芥中调控激素信号通路研究结果一致[29]。推测HbHSP90.6基因可能受ETH和JA信号通路调控参与植物抗病反应过程。有研究已表明ETH和JA的刺激会引起胶乳细胞的生理和代谢发生显著变化。应用乙烯利到橡胶树的树干树皮上可以显著提高橡胶树胶乳产量,而茉莉酸则是诱导橡胶树乳管细胞分化和橡胶生物合成的关键信号分子[30]。因此,推测HbHSP90.6基因在橡胶树产胶过程中发挥重要作用。生长素在植物生命周期的几乎所有方面都发挥重要作用,尤其是在植物组织和器官中呈极性分布,在植物发育过程中具有类似的形态发生活性[31]。本研究结果显示吲哚-3-乙酸处理后显著诱导HbHSP90.6基因上调表达,表明HbHSP90.6基因参与生长素诱导的信号通路。油菜素内酯是一种甾体植物激素,调节植物的各种发育过程以及生物和非生物胁迫反应[32]。本研究结果显示HbHSP90.6基因在BR处理下呈现上调表达的趋势,这与前人在拟南芥中研究HSP90基因在BR信号传导中的作用结果一致[33]。推测HbHSP90.6基因参与BR信号通路介导的基因转录调控。BR信号是通过HSP90活性介导的,并且HSP90/BES1复合体在形成的亚细胞位点主动调节BR信号,结果显示活性BR信号降低了细胞核中的BES1/ HSP90复合物,而在细胞质中BES1/HSP90复合物明显[34]。为了确定HbHSP90.6基因编码蛋白的亚细胞室,通过构建植物瞬时表达载体转化烟草,激光共聚焦观察结果显示绿色荧光信号在HbHSP90.6的细胞质和细胞核上均有分布,与亚细胞定位预测结果一致。
综上所述,本研究完成了橡胶树胶乳HbHSP90.6基因的克隆、生物信息学分析、表达模式分析及亚细胞定位。此结果为深入研究橡胶树HbHSP90.6基因在激素信号介导转录调控通路中的功能奠定坚实基础。
